超声波法提取赤水河流域竹叶黄酮工艺研究
2015-12-06朱万强张清榕
朱万强,张清榕
(遵义师范学院a.化学化工学院b.黔北特色资源应用研究实验室,贵州遵义563002)
超声波法提取赤水河流域竹叶黄酮工艺研究
朱万强,张清榕
(遵义师范学院a.化学化工学院b.黔北特色资源应用研究实验室,贵州遵义563002)
用超声波-乙醇水溶液提取法对竹叶黄酮的提取方法进行了研究;通过L9(34)正交实验考察了影响实验的各个因素:乙醇浓度、料液比、超声时间、超声次数。结果表明,当乙醇浓度为70%,料液比为1:20,每次超声时间为15min,超声3次时提取效果最好。对赤水河流域7种竹叶的黄酮含量用分光光度法进行了测定.
赤水河流域;竹叶黄酮;超声提取;分光光度法
黄酮类化合物又叫生物类黄酮,是一类重要的有机化合物,广泛存在于植物界,主要分布在高等植物中,在藻类、菌类等低等植物中很少发现[1]。许多研究已经证明,黄酮类化合物具有多种生物活性,除了在消炎、抗菌、抗肝脏病毒、解痉、止泻、利尿、镇静等方面的作用外,在防癌、抗过敏、抗肿瘤、防治高血压等方面也有明显作用。黄酮类化合物可以从维生素含量高或微量元素含量高的食物中获得,如豆类、橙类、洋葱,也可以从富含黄酮类化合物的植物中提取,作为膳食补充剂制成各种保健食品。其中竹叶黄酮是20世纪90年代新开发的以高山野生淡竹叶为原料的一种植物类黄酮制剂[2]。
目前,竹叶黄酮除了作为天然食品抗氧化剂、天然植物饲料添加剂、生物杀虫剂以及广泛应用于化妆品行业外,还被用于开发研制防治心脑血管疾病的新型药物[3]。毫无疑问,盛产竹子的地区对于竹叶黄酮的开发利用及提取研究占有绝对优势,我国盛产竹子的地区很多,贵州省赤水河流域就是其中之一,该地因盛产竹子而被誉为“竹子王国”。
赤水河主要流经贵州遵义北部,该地气候类型为亚热带湿润季风气候[4]。该地区有着适合竹子生长的气候、土壤等优良条件,丰富的竹子资源给工业
生产发展提供了得天独厚的条件,赤水地区是贵州省主要的工业原料林基地。竹业加工产品如竹地板、竹筷、竹工艺品等在赤水市竹林行业有着举足轻重的作用。对竹叶黄酮的开发利用一直受到人们的关注,但贵州地区虽然有人对竹叶黄酮进行研究,但却没有引起更多的注意,离产业化的要求更远。我们决定选取赤水河流域的部分竹子品种对其竹叶黄酮的含量和提取方法进行研究,以期为下一步的实际利用打下坚实基础。
1 材料与方法
1.1 材料
新鲜刺竹、慈竹、苦竹、楠竹、水竹、白夹竹、粽竹叶,2013年7月采自赤水河流域。实验前经干燥箱80℃干燥半小时,干燥后样品经粉碎机粉碎,过90目筛,收集粉末置于棕色试剂瓶中待用.
1.2 实验仪器
202-0型台式干燥箱(北京市永光明医疗仪器厂)、CX-200型高速多功能粉碎机(上海缘沃工贸有限公司)、722S型分光光度计(上海精密科学仪器有限公司)、SG5200HD型超声波清洗器(上海冠特超声仪器有限公司)、TB-214型电子天平(北京赛多利斯仪器有限公司)。
1.3 试剂
芦丁(上海源叶生物科技有限公司)、无水乙醇(99.7%)、亚硝酸钠、氢氧化钠、硝酸铝,所有试剂均为分析纯。
1.4 分光光度法
1.4.1 吸收波长选取
对竹叶黄酮的提取及含量测定方法已经比较成熟,主要是通过测定芦丁含量来实现[5-6]。
芦丁对紫外光和可见光都有吸收。文献报道其在紫外区的吸收波长为370nm[7]。在可见光区的吸收波长,一般采用的是510nm[8],理由是在此波长下,芦丁标准溶液在按下述顺序补足各溶液后,芦丁对该波长的光吸收最大。基于此,国内很多文献在报道测定芦丁的吸收波长时,一般都直接选定为510nm。对此,稍早的报道也有将测定波长选定在420nm处[9]。针对这种情况,我们将芦丁标准溶液的吸收波长,重新进行了测定。
准确称取芦丁标准品0.0188g,用30%的酒精溶液定容至50mL容量瓶中,得质量浓度为0.376g/L的标准液。分别取上述芦丁标准液0、0.5、1.0、1.5、2.0、 2.5mL于6只25mL容量瓶中,标号为1~6,加30%酒精溶液补充至12.5mL,加入0.7mL质量浓度为5%的NaNO2溶液,摇匀,静置5 min后加入0.7mL质量浓度为1%的Al(NO3)3溶液,摇匀,静置6 min后加入5 mL质量浓度为1mol/L的NaOH溶液,摇匀,用30%酒精溶液定容,摇匀,静置10 min后,选取3号标准试样溶液于不同波长下测定吸光度,测定结果如表1所示。
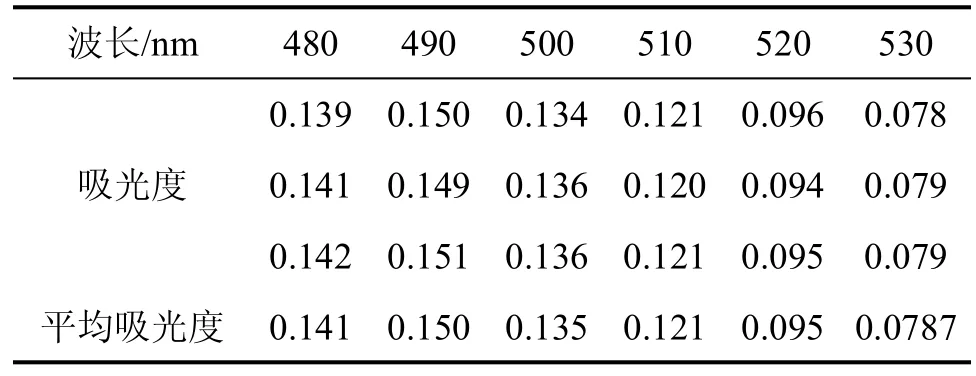
表1 3号试样溶液在不同波长下的吸光度
由表1数据可以看出,标准试样溶液在波长为490nm下吸收最大,干扰最小,所以在实验中我们选取490nm作为实验的最大吸收波长。
1.4.2 芦丁标准曲线制作
调节波长为490nm,以1号容量瓶的试样为空白参比,将上述配制好的其它标准试样溶液用比色法测定吸光度。以吸光度为纵坐标,芦丁标准溶液质量浓度为横坐标制作芦丁标准曲线[8-10]。得标准曲线回归方程:y=9.2587x+0.0069,R2=0.9985,如图1所示。
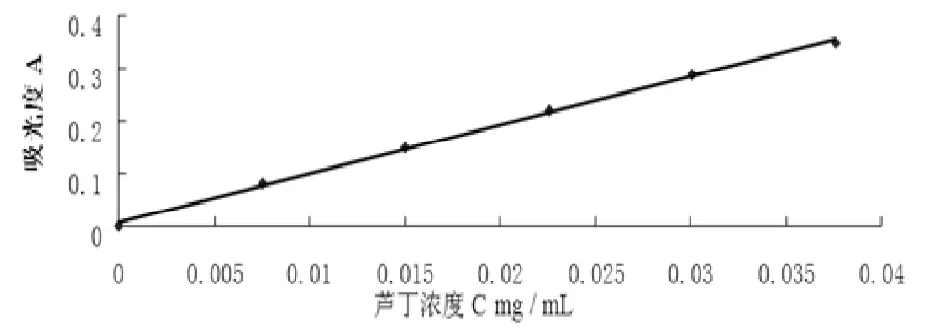
图1 芦丁标准曲线
1.5 竹叶黄酮的提取及检测
1.5.1 单因素对竹叶黄酮提取的影响
根据文献报道,目前对竹叶黄酮的提取方法有多种:索氏抽提法,乙醇浸提法,热水浸提法,溶剂超声提取法等。这些方法各有优缺点,在此不再赘述。乙醇具有溶解力较强,无毒,易得等优点;超声波具有不用加热、易于操作的特性。本研究用乙醇-超声
波提取法提取竹叶黄酮。影响该方法的因素主要有超声时间、超声功率、超声次数、料液比、乙醇浓度。一般超声设备的功率选项不是太多,我们固定在某一频率,以减少实验时的因素水平和控制实验次数。
(1)乙醇浓度对提取效果的影响
采用1:20的料液比例,准确称取2克左右某一品种(水竹)已粉粹的竹叶,按前述竹叶黄酮的提取方法,分别用不同浓度的乙醇在同样超声条件下得黄酮样品提取液。每种样品液各取2mL,按前述竹叶黄酮含量检测方法要求,测定其吸光度,结果见表2。
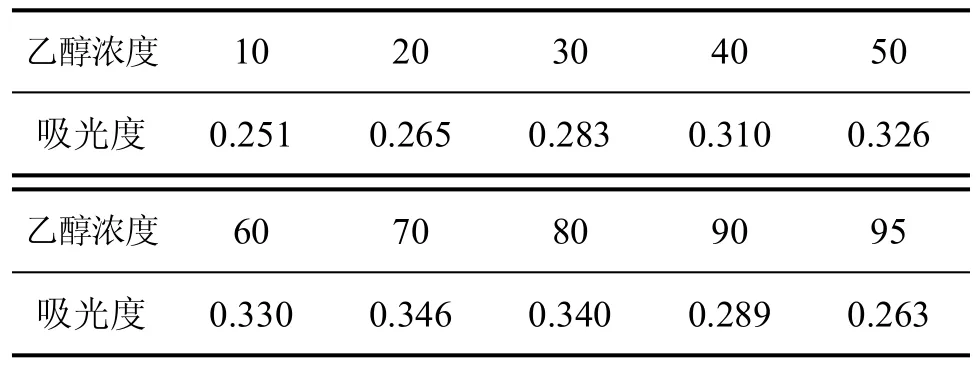
表2 不同乙醇浓度(v/v%)对吸光度的影响
由表2可以看出,乙醇浓度为70%时,吸光度最大。以70%的乙醇浓度提取最好。乙醇浓度增加导致吸光度下降,可能是由于随着乙醇浓度的增加,竹叶中其它乙醇可溶物如色素等杂质也随着溶出,并同乙醇-水分子结合,导致黄酮溶出率下降,因而吸光度下降。
(2)超声时间的影响
采用1:20的料液比例,准确称取2克左右某一品种已粉粹的竹叶,按前述竹叶黄酮的提取方法,用70%浓度的乙醇,按同一超声输出频率,在不同的超声时间条件下得黄酮样品提取液。再取每种样品液各2mL,按前述竹叶黄酮含量检测方法要求,测定其吸光度,结果见表3。
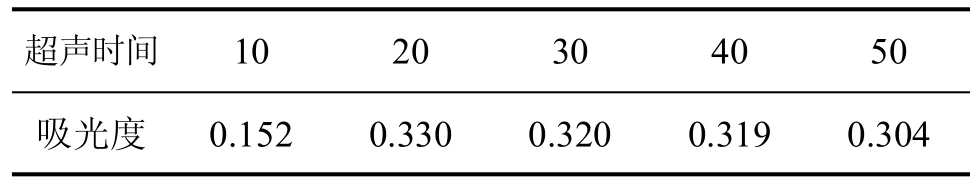
表3 不同超声时间(min)对吸光度的影响
由表3可以看出,超声时间以20min为最佳。时间延长,超声波可能使黄酮部分分解而导致吸光度下降。
(3)超声次数的影响
采用1:20的料液比例,准确称取2克左右某一品种已粉粹的竹叶,按前述竹叶黄酮的提取方法,用70%浓度的乙醇,按同一超声输出频率,每次超声20min,然后在不同的超声次数条件下得黄酮样品提取液。取每种样品液各2mL,按前述竹叶黄酮含量检测方法要求,测定其吸光度,结果见表4。
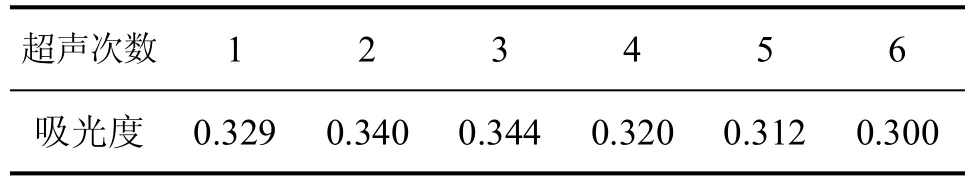
表4 不同超声次数对吸光度的影响
从表4可以看出,超声次数以3次为好。考虑到超声3次与超声2次的效果相差不大,并且多超声一次,对实际生产要产生较大影响,因此以超声2次为宜。
(4)料液比的影响
准确称取2克左右某一品种已粉粹的竹叶,按前述竹叶黄酮的提取方法,采用70%的乙醇浓度,在同样超声条件下,分别采用不同的料液比(竹叶样品/乙醇)得黄酮样品提取液。每种样品液各取2mL,按前述竹叶黄酮含量检测方法要求,测定其吸光度,结果见表5。

表5 不同料液比(质量g/体积mL)对吸光度的影响
从表5可以得出,料液比以1:20为最好。
1.5.2 正交因素水平实验对竹叶黄酮提取的影响
将前述乙醇浓度、超声时间、超声次数与料液比四个因素,设计一个四因素三水平的正交表结果见表6。
各因素的影响顺序为B〉C〉D〉A,最佳组合为A2B2C3D2。即乙醇浓度为70%,超声时间为15min,超声次数为3次,料液比为1:20。正交实验时,三个水平间间隔为5min,总时间与在单因素时所得到的结果基本相符。由于选择的乙醇浓度已经接近最佳浓度,因此在正交实验中,并不是主要的影响因素。得到的实验条件与大多数文献报道的条件基本一致。
1.5.3 对几种竹叶黄酮的提取实验
精确称取粉碎好的赤水河流域的楠竹叶、水竹叶、白夹竹叶、苦竹叶、刺竹叶、慈竹叶,粽叶粉末各5.0000g,根据正交实验得出的最佳实验条件,即分别加70%酒精溶液100mL,用超声波提取3次,每次15分钟,过滤,合并滤液,定容至100mL容量瓶中。取2.0mL样品溶液于25mL容量瓶中,加30%酒精溶液补充至12.5mL,加入0.7mL质量浓度为5%的NaNO2溶液,摇匀,静置5min后加入0.7mL质量浓度为1%的Al(NO3)3溶液,摇匀,静置6 min后加入5 mL质量浓度为1mol/L的NaOH溶液,摇匀,用30%酒精溶液定容,摇匀,静置10 min后,于波长为490nm处用比色法测定吸光度,以不加样品溶液的试样为空白参比,测得各种竹叶中黄酮的吸光度如表7所示。
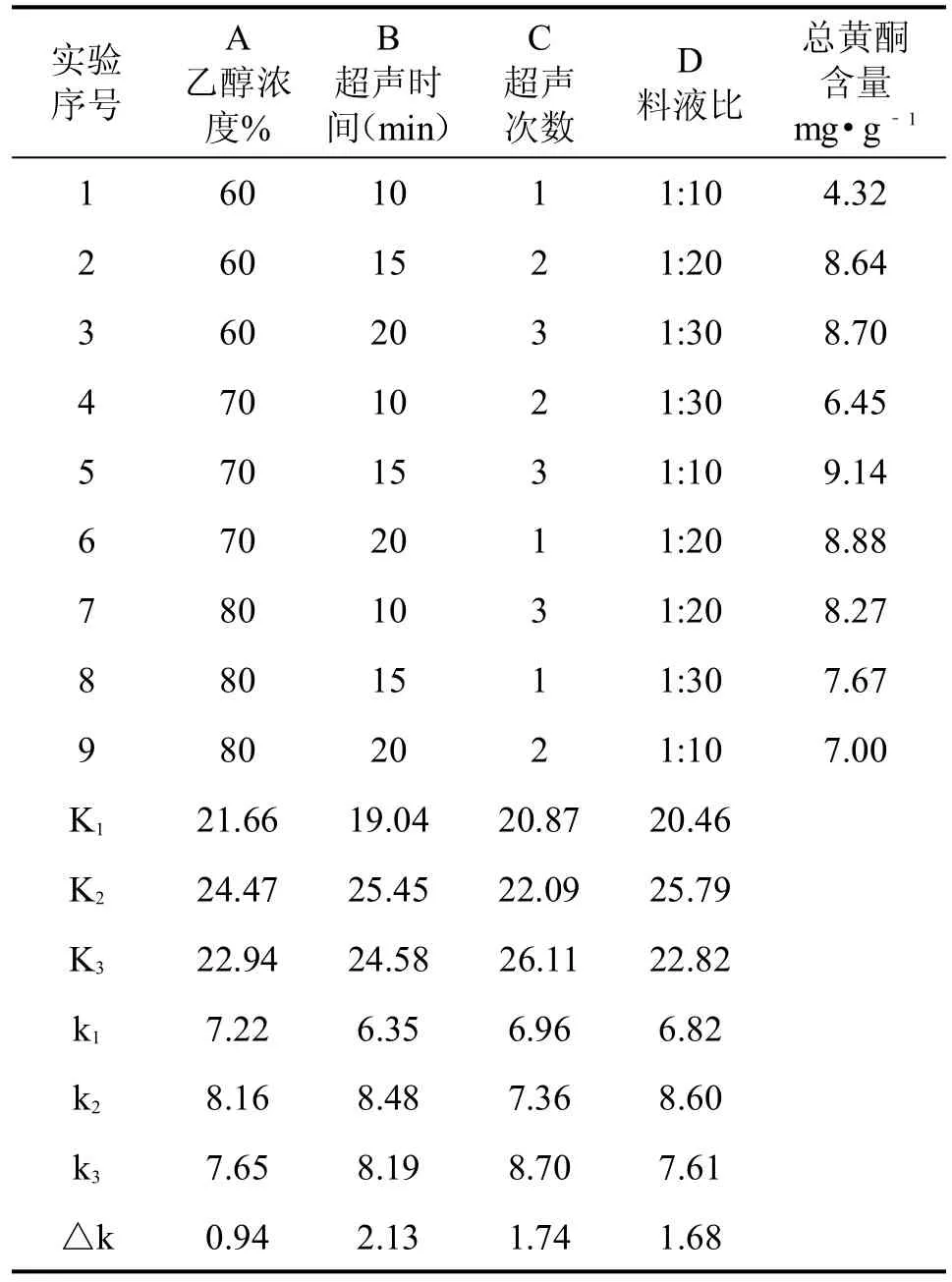
表6 L9(34)正交实验与结果
3 结语
用70%乙醇,1:20料液比,超声波提取3次(实际操作2次),每次15分钟可有效提取竹叶黄酮。赤水河流域的7种竹叶中,黄酮含量最高的楠竹为17.45mg/g;其次为白夹竹16.31mg/g、刺竹13.94mg/ g、苦竹13.07 mg/g、慈竹10.72 mg/g、水竹9.16 mg/ g、粽叶6.19 mg/g。
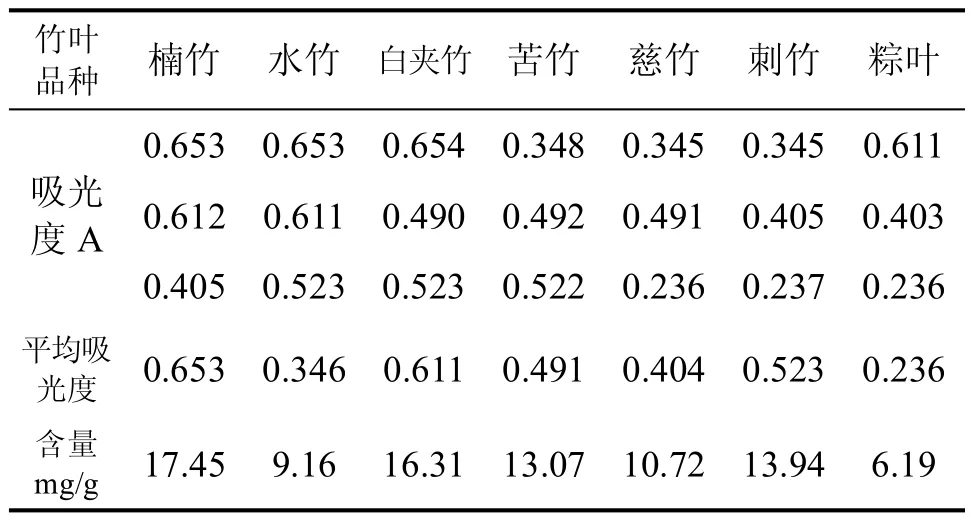
表7 竹叶中黄酮的吸光度
[1]徐怀德.天然产物提取工艺学[M].北京:中国轻工业出版社, 2011.
[2]丁灵英.神奇的竹叶黄酮[J].知识经济,2007,(1):20-22.
[3]李慧力,陶文亮,吴钰娟,等.酶法提取竹叶中总黄酮的工艺研究[J].贵州农业科学,2010,38(10):185-187.
[4].顾永顺.林风华林业生态建设分区布局研究[J].贵州林业科技,2010,38(1):11-14.
[5].杨萍,钱俊青,胡永萍.苦竹类竹种总黄酮提取工艺的比较[J].浙江林学院学报,2005,22(1):24-27.
[6]苏春花,王福生,雨龙.长节箬竹叶黄酮提取工艺[J].林业科技开发,2010,24(5):87-90.
[7]蒋益花.紫外分光光度发测定南天竹叶总黄酮含量[J].浙江树人大学学报,2011,11(1):21-24.
[8]冯涛,曹东旭,吕晓玲.竹叶总黄酮含量的测定[J].中国食品添加剂,2002,(6):85-87.
[9]邬建敏,贾之慎,唐云湖.竹类黄酮化合物总量及芦丁含量的测定[J].浙江农业大学学报,1998,24(4):339-343.
[10]许钢,张虹,胡剑.竹叶中黄酮提取方法的研究[J].分析化学, 28(7):857-859.
[11]董如何,肖必华,方永水.正交实验设计的理论分析方法及应用[J].安徽建筑工业学院学报(自然科学版),2004,12(6): 103-106.
[12]任露泉.实验设计及其优化[M].北京:科学出版社,2009.
(责任编辑:朱 彬)
A Study of Technology in Extracting Flavones from Bambooleaf Grown in Chi-shui River Valley by Ultrasonic Wave
ZHU Wang-qiang,ZHANG Qing-rong
(1.Chemistry and Chemical Technology Institute;2.Laboratory of Utilization Research on Characteristic Resources in Qianbei,Zunyi Normal College,Zunyi 563002,China)
By meansof ulitrasonic waveandalcoholsolution,the authorofthis paper makesa study of theapproach to extracting flavones from bamboo-leaf.L9(34)orthogonal experiment was used to investigate various factors influencing the experiment,such as acohol concentration,solid-liquid ratio,time,etc.The findings show that the extraction is optional when alcohol concentration is 70%,ultrasonics is 3 times,every time lasts 15 minutes,and the ratio of solid/liquid is 1:20.Flavones were determined from 7 kinds of bamboos leaves grown in Chi-shui River valley by spctrophotometry.
Chi-shui River valley;flavones from bamboos leaves;ultrasonic wave extracting;spctrophotometry;
TQ461
A
1009-3583(2015)-0099-04
2014-12-11
贵州省科学基金资助项目(黔科合J字LKZS[2012]27号)
朱万强,男,贵州遵义人,遵义师范学院化学化工学院教授。研究方向:应用化学。
