不同处理方式及试剂盒对石蜡包埋组织提取DNA影响
2015-12-05管力白丽燕王瑞晓刘晓刚
管力 白丽燕 王瑞晓 刘晓刚
(邯郸康业医学检验所 河北邯郸 056000)
近年来,现代分子生物学越来越广泛的被应用于人类疾病研究的诸领域,但试验时经常遇到短期内难以得到大量的新鲜组织标本的难题,而医院病理科档案中积存的大量石蜡包埋组织,是一个可靠的分子生物学研究的材料来源,这就需要从能长期保存的石蜡包埋的癌组织中抽提 DNA。根据现有的资料,从石蜡包埋组织中提取DNA的方法,一般主要包括脱蜡、消化和纯化3个步骤[1-2]。普通甲醛固定石蜡包埋组织中提取质量较差的原因有两个,一是经过各种理化因素刺激及残留的酶作用后产生降解,二是经过多种化学药物作用后,组织细胞内的变得更加脆弱,致使其在提取过程中对理化环境的变化更加敏感,更易断裂[3]。因此对不同的提取方法及提取条件进行比较和筛选是非常有意义的。本文针对三种不同的前处理方式(切片,玻片,刮片),选择市面上两种试剂盒(Tiangen和Qiagen),对石蜡包埋组织提取DNA质量进行了比较。以期达到能根据自己实验室条件,对石蜡包埋组织进行相应的前处理和有针对性的选择合适的提取试剂盒。

图1 三种组织处理方式提取DNA电泳图
1 材料与方法
1.1 标本
选取邯郸市中心医院2014年2月手术切除的肺癌组织,组织块全部为癌组织,质地均一,经10%中性甲醛固定,12h后石蜡包埋,室温存档。
1.2 主要试剂和仪器
二甲苯,德国Qiagen的QIAamp DNA FFPE Tissue kit和Tiangen的TIAN quick FFPE DNA kit,天根生化DNA核酸纯化试剂盒,BD 1000超微量核酸蛋白分析仪,凝胶成像系统(上海培清),PCR仪(美国ABI公司),测序仪(美国ABI公司),PCR Mix(Taq聚合酶,2×buffer,MgCl2,dNTP)均购自艾德莱。引物序列EGFR18:上游CAAATGAGCTGGCAAGTGCCGTGTC下游GAGTTTCCC AAACACTCAGTGAAAC,400bp;EGFR19:上游CCCAGCAAT ATCAGCCTTAGGT下游GGCCAGTGCTGTCTCTAAGG,434bp;GFR21:上游CTCAGAGCCTGGCATGAAC下游GCTGC GAGCTCACCCAGAATGTCTGG,377bp由赛百盛公司合成
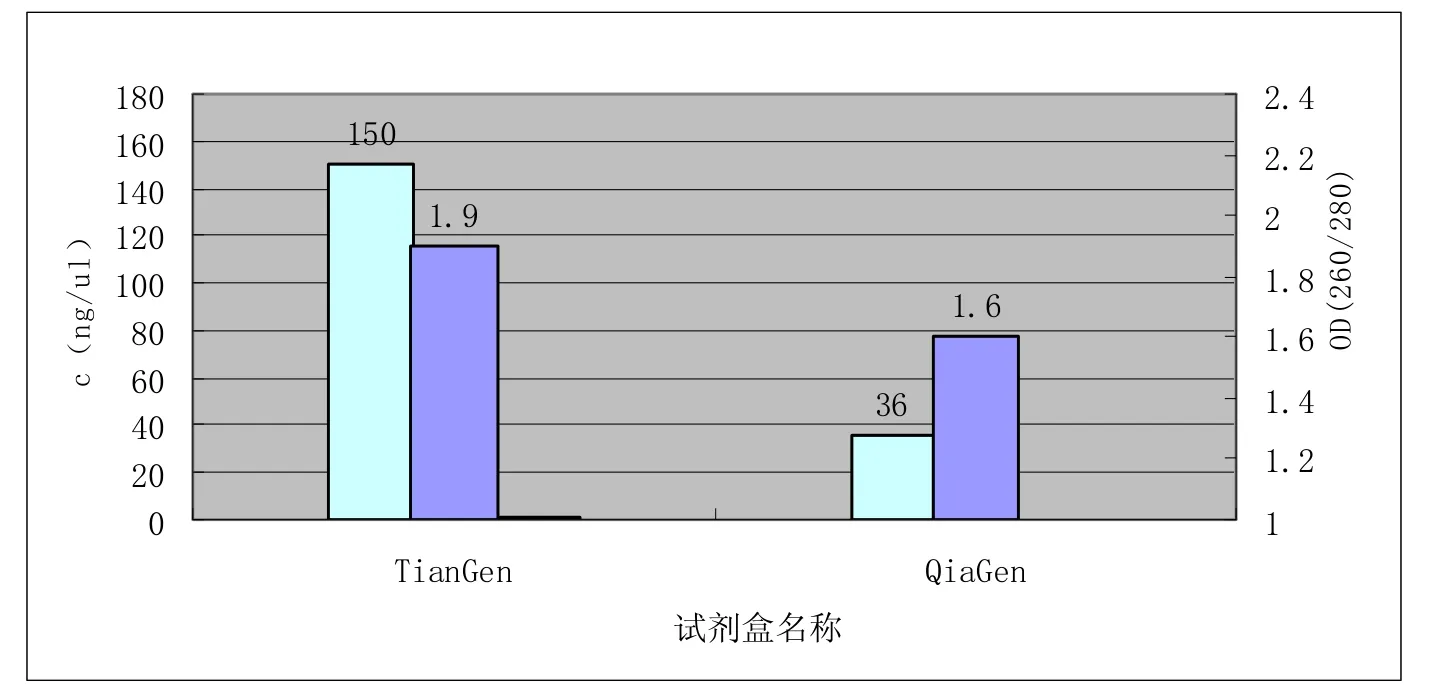
图2 石蜡切片后直接用两种试剂盒提取效果比较
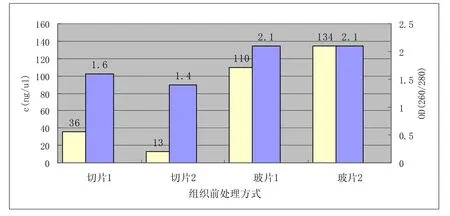
图3 石蜡组织不同前处理方式用QiaGen试剂盒提取DNA效果比较
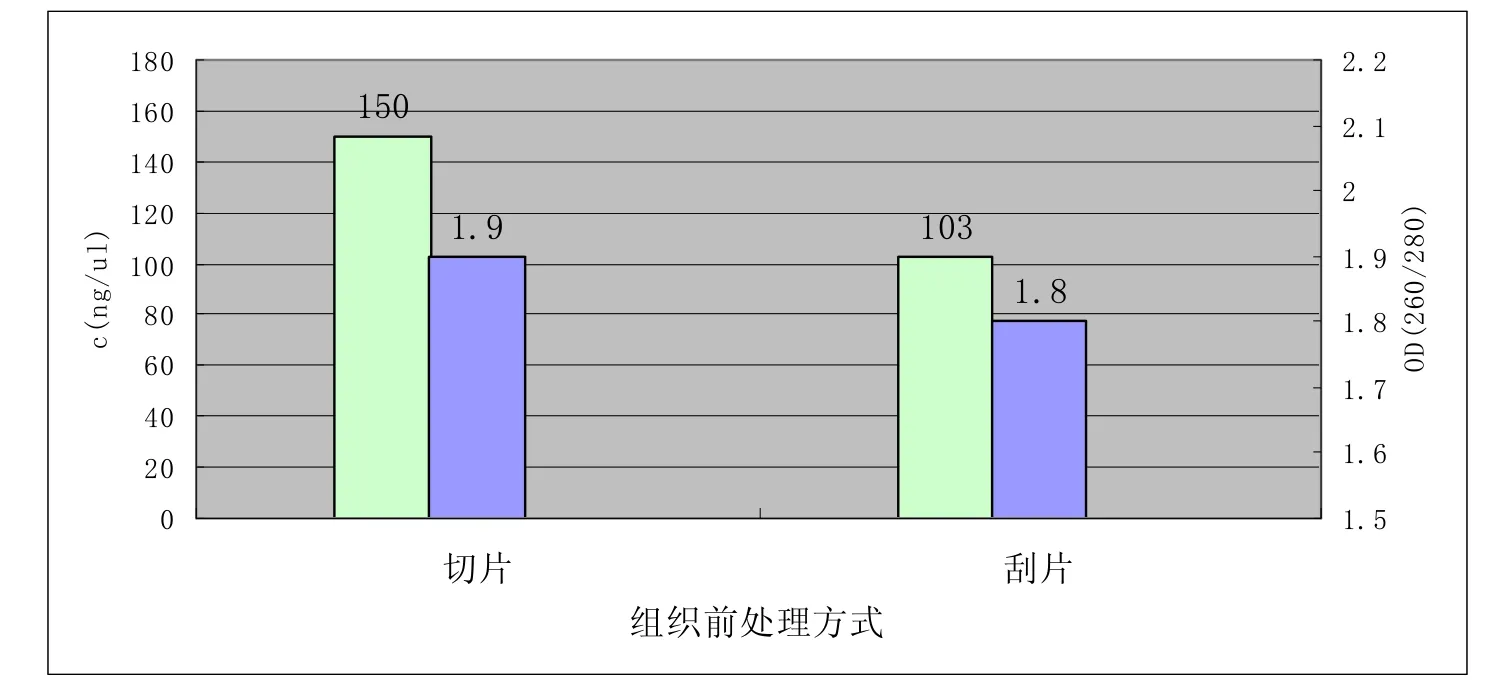
图4 石蜡组织不同前处理方式用TianGen试剂盒提取DNA效果比较
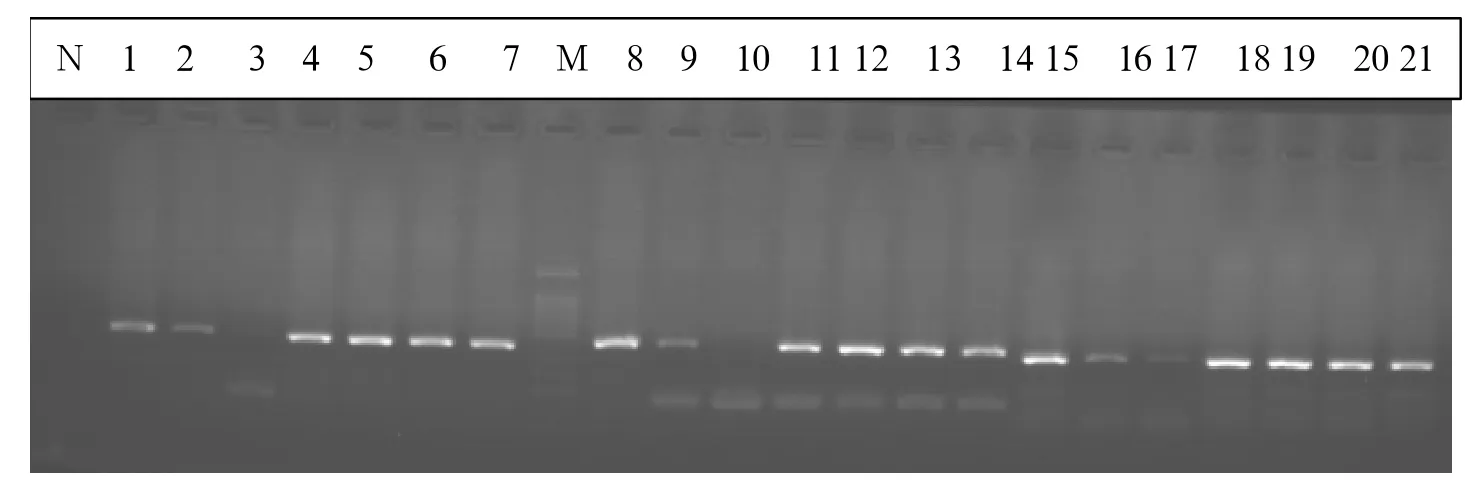
图5 提取的基因组DNA完成PCR扩增后电泳图(N为阴性对照,M为Marker,1~7道为EGFR18 PCR产物,400bp;8~14道为EGFR19 PCR产物,434bp;15~21道为EGFR18 PCR产物,377bp)
1.3 DNA提取方法
在提取DNA前,采取三种不同方式处理石蜡包埋组织,分别为切片机对石蜡组织连续切片;用刀片手动从石蜡组织上刮取组织,切片机切片后置于载玻片上进行烤片,形成三种石蜡组织形式:切片,刮片,玻片。提取方法按照试剂盒方法进行,并进行了适当的改动。
1.3.1 方法一:对切片形式的石蜡包埋组织用两种试剂盒提取DNA
石蜡包埋组织用切片机连续切片,5μm厚,8张为一组,共计两组,分别按照Qiagen和Tiangen试剂盒进行操作。
1.3.2 方法二:对刮片形式的石蜡包埋组织用Tiagen试剂盒提取DNA
用无菌刀片手动刮取2-3张石蜡组织迅速放到2ml无菌离心管中(含裂解液和脱蜡液),迅速涡旋混匀后再刮取再混匀,共刮取大约8张蜡片组织到一个离心管。之后按照Tiangen试剂盒说明进行操作。
1.3.3 方法三:对玻片形式的石蜡包埋组织用Qiangen试剂盒提取DNA
石蜡包埋组织用切片机连续切片,5μm厚,置于载玻片上60℃烤片20mins。将载玻片放在二甲苯中浸泡10mins,8张为一组,用刀片将玻片上组织刮到2ml无菌离心管中(含有1ml二甲苯),按照Qiagen试剂盒说明进行后续操作。详细步骤同1.3.1中的Qiagen方法。其中(9)56℃水浴1h,改为56℃水浴过夜。
1.4 DNA鉴定方法
1.4.1 DNA片段长度分布
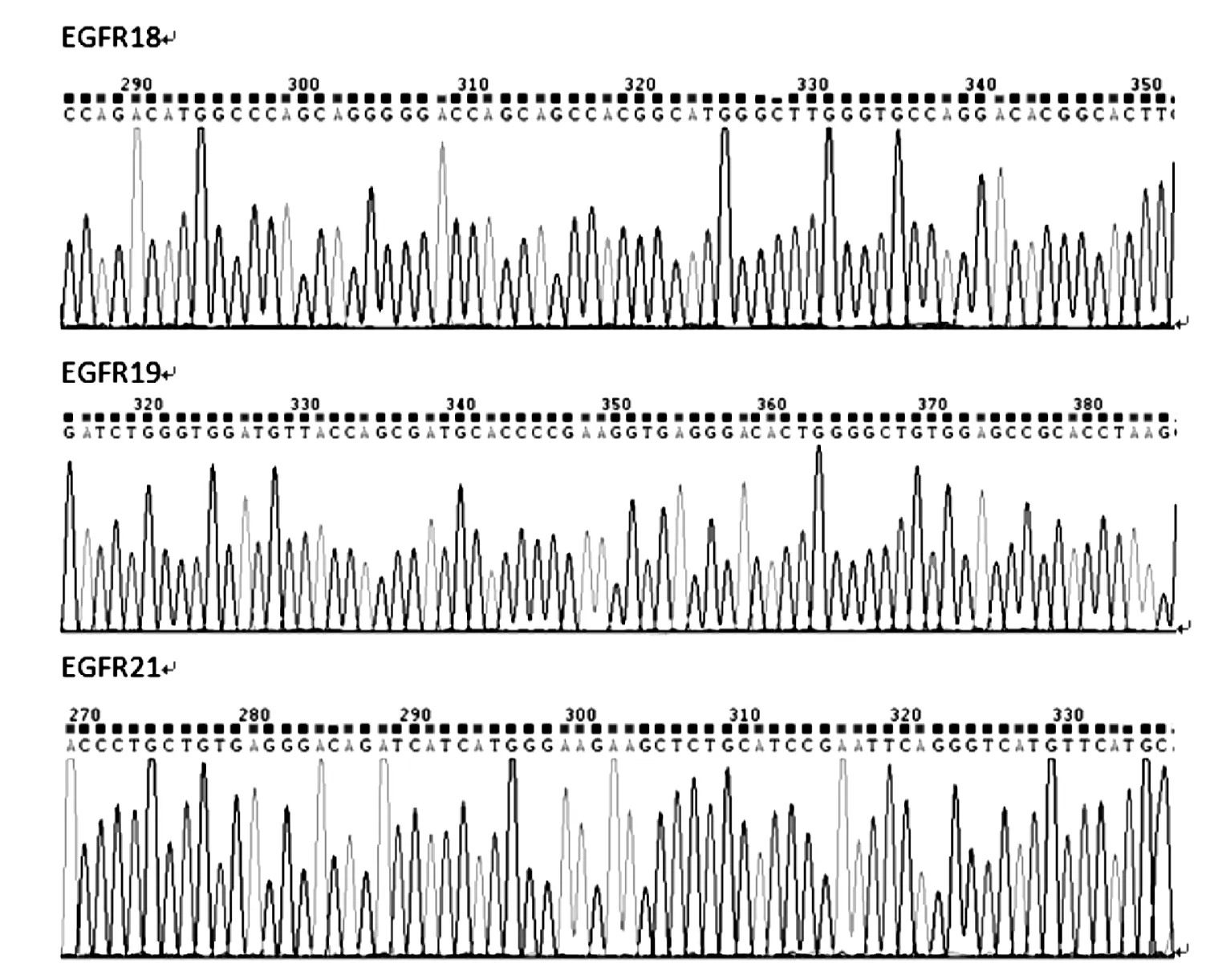
图6 提取的基因组DNA扩增EGFR三个外显子测序图
以5μl DNA样品与1μl DNA loading buffe混匀,1%琼脂糖凝胶中200V电泳30mins,在紫外凝胶成像仪下观察所提取DNA片段长度分布。
1.4.2 DNA纯度及量的鉴定
以BD 1000超微量核酸蛋白分析仪检测DNA样品OD值及其浓度。
1.4.3 PCR扩增和测序
配制PCR反应体系26ul:模板DNA 2ml,上/下游引物各1ml,2×Taq Buffer 13ml,DDH2O 9ml。PCR反应条件:95℃下5mins预变性,95℃ 30s,59℃ 30s,72℃ 30s循环35次72℃延伸5mins,水代替模板DNA为阴性对照。PCR产物经1%琼脂糖凝胶电泳后切取目的条带,按照天根生化DNA核酸纯化试剂盒进行纯化,纯化后的PCR产物经荧光标记后,ABI3100自动测序仪进行测序,,观察提取的DNA是否可以用于直接序列测定
2 结果
2.1 基因组DNA电泳图谱
如图1所示:不同组织处理方式,提取DNA是有差异的。从图中可以看出1道为切片后用Tiangen试剂盒提取的DNA,片段集中分布在400bp~1500bp,2道和3道为切片后用Qiagen试剂盒提取的DNA条带很弱;而把组织切片制作成载玻片形式后如4道和5道,再用Qiagen试剂盒提取能达到不错的效果,片段大小集中分布于100bp~2500bp左右;对于手动刮取的组织如6道和7道,用Tiangen试剂盒也能得到片段集中分布在500bp~1500bp的DNA。
2.2 DNA浓度和纯度
从图2可以看出,石蜡切片后直接按试剂盒方法提取DNA,Tiangen试剂盒的提取结果无论从浓度和纯度上都要高于Qiagen试剂盒;从图3可以看出切片制作成玻片形式后,再按Qiagen试剂盒提取DNA,浓度和纯度都要高于切片完成后直接提取的效果;从图4可以看出,手动用刀片刮取组织按Tiangen试剂盒提取DNA纯度和切片效果接近,但浓度要比切片直接做低。
2.3 PCR产物扩增电泳图谱
从图5可以看出,提取的DNA基本上能完成EGFR18(400bp),EGFR19(434bp),EGFR21(377bp)的PCR扩增,电泳图显示片段大小正确,目的带清晰,效率良好。
2.4 PCR产物测序
将PCR产物纯化后进行测序,从图六可以看出,测得的长度合适,基线平稳且峰型清晰。
3 讨论
本研究从实用角度,针对石蜡包埋组织三种不同的处理方式(切片,玻片,刮片),选择市面上两种试剂盒(Tiangen和Qiagen),对提取DNA质量进行了比较。以期达到能根据自己实验室条件,对石蜡包埋组织进行相应的前处理和有针对性的选择合适的试剂盒。
3.1 两种试剂盒Qiagen和Tiangen提取效果
针对同样是切片的石蜡包埋组织,从图一和图二可以看出,Tiangen试剂盒无论从浓度还是纯度上都要高于Qiagen试剂盒,这可能是由于Tiangen采用的是高温98℃同时进行脱蜡和蛋白酶消化,脱蜡和消化比较彻底;而Qiagne试剂盒是二甲苯脱蜡,脱蜡离心后去除上清时,容易吸到组织,因为离心完成后,并没有像试剂盒描述的那样,组织沉到管底,而是悬浮于离心管中,这种情况可能是由于脱蜡不够彻底,因石蜡可阻碍消化液对组织的渗透,从而抑制蛋白酶K与组织内蛋白的接触,影响组织消化和DNA释放,在DNA提取过程中,如未能有效去除石蜡,形成DNA-石蜡混合液,不利于PCR扩增蛋白酶K消化[4]。也可能因此导致了对切片形式的石蜡包埋组织,用Qiagen试剂盒提取DNA浓度和纯度比Tiangen低。
3.2 Qiagen试剂盒对切片和玻片形式的石蜡包埋组织提取DNA效果
从图1和图3可以看出无论是纯度还是浓度,玻片形式都要比切片形式高很多,且DNA片段分布范围更宽广。这可能是由于玻片形式的石蜡包埋组织在按照试剂盒提取之前多了一道二甲苯浸泡玻片操作,脱蜡的效果更彻底,而且在试验中我们也明显看到,离心之后,相比切片形式的组织悬浮在二甲苯中,玻片形式组织离心后已经沉入到了离心管底。而且玻片形式的在操作中将90℃水浴1h改为了90℃过夜,蛋白酶K消化时间的延长,减少了蛋白的污染,使DNA纯度提高。消化时间是一个在学术界尚无定论的问题,有人认为消化时间应适当延长,最长者有报道经7天消化,可产生高质量的DNA[5];Isola等认为增加蛋白酶 K消化,能明显增加大分子量的DNA产量,这可能与蛋白酶 K 消化能部分逆转由固定导致的交联现象有关[6],但也有研究表明: 长时间蛋白酶K 消化,使短片段增加[7]。从我们实验中,我们也发现玻片形式组织延长消化时间后,片段分布范围更宽广。
3.3 Tiangen试剂盒对切片和刮片形式的石蜡包埋组织提取DNA效果
从图一和图四中可以看出切片形式和刮片形式包埋组织提取的DNA纯度差异不大,但刮片形式浓度比切片形式低,这可能跟手动刮取的石蜡包埋得组织量少有关。
4 结论
根据各自实验室条件和样本来源,如果样本已经是烤过片的玻片形式的石蜡包埋组织,可以选择改良的Qiagen试剂盒提取DNA(提取前增加一步二甲苯浸泡玻片脱蜡,试验中90℃水浴1h改为90℃过夜); 而样本如果是石蜡块包埋的组织,有切片机的,可以将石蜡包埋组织切成5um厚切片,8张为一组,用Tiangen试剂盒提取DNA;而没有切片机的实验室可以选择用刀片刮取石蜡块组织,刮尽量薄的组织片,大约8张为一组,用Tiangen试剂盒提取DNA。得到的DNA都可以满足后续PCR扩增及测序要求。
[1]Satoy,Sugier,TsuchiyaB,etal.Comarison of the DNA extraction methods for polymerase chain reaction amplification from formalin-fixed and paraffin-embedded tissues.[J].Diagn Mol Paehol,2001,10(4):265.
[2]BielawskiK,Zaczed,LisowskaU,etal.Thesuitability of DNA extracted from formalin-fixed,Paraffin-embdded tissues for double differential polymerase chain reaction analysis.[J].Int JMol Med,2001,8(5):573.
[3]Mies C,Houldsworth J.Chaganti RS.Extraction of DNA from paraffin blocks for Southern bolt analysis.[J].Am J Surg Pathol,1991,15(2):169-174.
[4]石蜡包埋组织基因组DNA提取的条件优化,临床与试验病理学杂志,J Clin Exp Pathol,2011,Sep;27(9):1021-1023.
[5]Warford A,Pringle JH,Hay J,et al.Southern blot analysis of DNA extracted from formal-saline fixed and paraffin wax embedded tissue[J].J Pathol,1988,154(4):313-320.
[6]Isola J,DeVries S,Chu L,et al.Analysis of changes in DNA sequence copy number by comparative genomic hybridization in archival paraffin-embedded tumor samples.Am J Pathol;1994,145:1301-1308.
[7]Lonn U,Lonn S,Nilsson B,et al.Demonstration of gene-amplification by PCR in archival paraffin-embedded breast cancer tissue.Breast Cancer Res Treat,1994;30:147-152.