电针刺激对胰岛素抵抗大鼠骨骼肌ERK及JNK蛋白表达的影响
2015-12-05唐思诗唐念珍唐成林
唐思诗,唐念珍,唐成林,杨 辉,张 毅,田 源
(1.成都中医药大学针灸推拿学院2008级七年制本硕连读生,四川 成都 610075;2.重庆医科大学中医药学院2012级硕士研究生,重庆 401331;3.重庆医科大学中医药学院,重庆 401331;4.重庆医科大学第一临床学院2012级硕士研究生,重庆 400016;5.重庆医科大学中医药学院2013级硕士研究生,重庆 401331)
论 著
电针刺激对胰岛素抵抗大鼠骨骼肌ERK及JNK蛋白表达的影响
唐思诗1,唐念珍2,唐成林3,杨 辉4,张 毅5,田 源5
(1.成都中医药大学针灸推拿学院2008级七年制本硕连读生,四川 成都 610075;2.重庆医科大学中医药学院2012级硕士研究生,重庆 401331;3.重庆医科大学中医药学院,重庆 401331;4.重庆医科大学第一临床学院2012级硕士研究生,重庆 400016;5.重庆医科大学中医药学院2013级硕士研究生,重庆 401331)
目的:探讨电针对胰岛素抵抗大鼠骨骼肌ERK、JNK蛋白表达的影响。方法:将SD雄性大鼠随机分为空白组、模型1组、模型2组、电针1组、电针2组,用高脂高糖饮食喂养法建立胰岛素抵抗大鼠模型,用葡萄糖氧化酶法检测FBG、放射免疫分析法检测FINS,并计算Homa-IR。确定造模成功后,电针组大鼠取足三里、三阴交、胃脘下俞行电针治疗,用Western blot技术检测大鼠骨骼肌中ERK、JNK蛋白的表达。结果:模型组大鼠FBG、FINS、Homa-IR较空白组显著升高(P<0.05),电针组大鼠FBG、FINS、Homa-IR较模型组显著下降(P<0.05),模型组大鼠ERK、JNK蛋白表达较空白组显著上升(P<0.05),电针组大鼠ERK、JNK蛋白表达较模型组显著下降(P<0.05)。结论:电针可降低ERK、JNK蛋白表达水平,从而改善胰岛素抵抗状态。
胰岛素抵抗;大鼠模型;电针;ERK;JNK;
肥胖、2型糖尿病、多囊卵巢综合症、代谢综合征、冠心病、高血压等病理改变过程中胰岛素抵抗是共同存在的病理基础,即“共同土壤”学说所阐述的理论思想[1]。近年来,电针治疗胰岛素抵抗的研究取得较大进展。我们用高脂高糖饮食诱导大鼠发生胰岛素抵抗,电针治疗后通过Western blot技术检测大鼠骨骼肌中ERK、JNK蛋白的表达,以观察电针对胰岛素抵抗模型大鼠骨骼肌中胰岛素抵抗的影响,总结如下。
1 材料与方法
1.1 动物分组及造模
4周龄雄性SD清洁级大鼠40只,体质量(80±20)g,适应性饲养3天后随机分为空白组、模型1组、模型2组、电针1组、电针2组。空白组给予普通饲料喂养,其余组参考王艳军等[2]造模法给予高脂高糖饮食喂养建立胰岛素抵抗模型。高脂高糖饮食配方(质量比)为普通饲料60%,猪油15%,蔗糖25%。从第6周开始,每隔1周对空白组及造模组大鼠从眼眶静脉窦采血1次,检测空腹血糖(FBG)、血浆胰岛素(FINS),并计算胰岛素抵抗指数(Homa-IR)[3]进行对比,当造模组大鼠FBG、FINS、Homa-IR与空白组比较明显升高(P<0.05)时为造模成功。第8周造模成功后,空白组继续以普通饲料喂养,模型1组及电针1组继续给予高脂高糖饮食,模型2组及电针2组各8只转为普食喂养。
1.2 试剂及仪器
普通饲料由重庆医科大学实验动物中心配制提供,猪油、蔗糖为市售,胰岛素放射免疫试剂盒购自北方生物技术研究所,葡萄糖测定试剂盒购自上海博谷生物科技有限公司,华佗牌针灸针(0.25mm×13mm,中国苏州医疗用品厂有限公司),华佗牌SDZ-Ⅱ型电针仪(中国苏州医疗用品厂有限公司),发光试剂(MILLIPORE公司Immobilon Western100mL Cat.No.WBKLS0100),二抗(中杉公司,ZB-2306兔抗山羊IgG,ZB-2305山羊
抗小鼠IgG,ZB-2301山羊抗兔IgG),核酸蛋白分析仪(BECKMAN DU640),凝胶成象系统(Blo-RAO Gel Doc 2000),电泳仪(Blo-RAO POWER/PAC 1000)。
1.3 针刺方法
电针组造模成功后予以电针治疗,每日1次,连续治疗14天。用特制固定器将大鼠固定,用毫针直刺足三里、三阴交5mm,斜刺胃脘下俞5mm,接通SDZ-Ⅱ型电针仪,同侧足三里与三阴交、双侧胃脘下俞分别连接一组电针。参考有关文献报道[4]统一规定电针仪的频率为3~5Hz,强度为3mA(中等强度刺激),疏密波,通电20min。空白组和模型组仅以相同手法、相同时间段内抓取固定20min,无治疗。
1.4 标本采集
电针治疗结束后,各组大鼠均禁食12h,次日空腹眼眶静脉窦采血静置于清洁塑料离心管中,在低温离心机上3000r/min离心10min,收集血清置于-80℃冰箱中保存待测。采血结束后将大鼠脱颈椎处死,迅速分离左侧股四头肌放入小玻璃瓶中,标号封存后置于液氮罐中,送至-80℃冰箱中保存备用。
1.5 指标检测
大鼠空腹胰岛素(FINS)采用放射免疫分析法测FINS含量,空腹血糖(FBG)采用葡萄糖氧化酶法测FBG含量,所有测定步骤严格按照试剂盒说明书进行。参照李光伟[3]的方法计算胰岛素抵抗指数(Homa-IR),即Homa-IR=ln(FBG×FINS/22.5)。
大鼠骨骼肌中ERK、JNK蛋白表达采用Western blot技术检测:①取股四头肌约40mg,每组加入配好的缓冲液(蛋白质匀浆缓冲液1mL,PMSF50μg/mL,Leupin5μg/mL)0.4mL,充分匀浆;②在–20℃下冻存细胞20min后,以12000r/min离心20min,上清液移至另一EP管(100μL)中;③于试管中加考马斯亮蓝染液1mL和蛋白上清液2μL,混匀后测定蛋白浓度(60~100μg/μL较为理想);④每EP管加等量加样缓冲液100μL,煮沸6min. 根据蛋白浓度计算所需上样量(以上操作均在冰板上进行);⑤灌制聚丙烯凌胶,10%分离胶,4%浓缩胶;⑥上样量50μg,每样至少上二块平行胶,电泳电压浓缩胶90V,分离胶160V,电泳液为甘氨酸缓冲液;⑦电泳结束后取出凝胶,和相同大小的PVDF(先用95%乙醇固定)置于三层滤纸中间,放入转移槽中,加满转移液,300mA约90min;⑧取出PVDF膜,自然晾干后,置于95%乙醇中固定,自然晾干,0.01MPBST洗5min,放入5%脱脂奶粉中封闭非特异性蛋白,37℃恒温摇床下约4h;⑨加I抗体(1∶1000用0.01MPBT配制),37℃恒温摇床下3~4h,0.01MPBST洗15min×3次;⑩加HRP标记的二抗(1∶1000用0.01MPBST配制),室温下1~2h,0.01MPBST洗15min×3次;将PVDF置于NEN化学发光试剂中增强反应1~3min,在暗室中使X光片爆光,常规方法显影,定影,并扫入凝胶成象系统进行图象分析,计算光密度值(OD值),重复3次。
1.6 统计学方法
采用SPSS16.0统计软件处理实验数据,结果以均数±平均差(±s )表示,采用单因素方差分析进行多组间的比较,两组数之间的比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 实验结果
高脂高糖饮食对FBG、FINS、Homa-IR的影响见表1。
表1 造模成功后各组大鼠FBG、FINS、Homa-IR比较(±s)
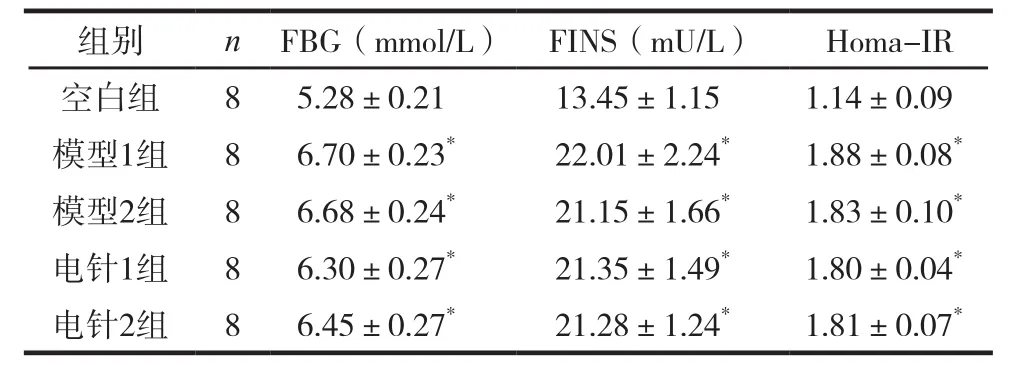
表1 造模成功后各组大鼠FBG、FINS、Homa-IR比较(±s)
注:与空白组比较,*P<0.05。
组别nFBG(mmol/L)FINS(mU/L)Homa-IR空白组85.28±0.2113.45±1.151.14±0.09模型1组86.70±0.23*22.01±2.24*1.88±0.08*模型2组86.68±0.24*21.15±1.66*1.83±0.10*电针1组86.30±0.27*21.35±1.49*1.80±0.04*电针2组86.45±0.27*21.28±1.24*1.81±0.07*
电针对大鼠FBG、FINS、Homa-IR的影响见表2。
表2 治疗结束后各组大鼠FBG、FINS、Homa-IR比较(±s)

表2 治疗结束后各组大鼠FBG、FINS、Homa-IR比较(±s)
注:与模型组比较,aP<0.05;与模型1组比较,bP<0.05;与电针1组比较,cP<0.05。
组别nFBG(mmol/L)FINS(mU/L)Homa-IR空白组85.23±0.1412.74±0.911.08±0.07模型1组87.05±0.1823.14±2.151.98±0.11模型2组86.71±0.16b19.63±1.13b1.77±0.07b电针1组86.23±0.13a16.50±0.58a1.51±0.05a电针2组85.29±0.19ac14.15±0.74ac1.20±0.04ac
电针对大鼠骨骼肌ERK、JNK蛋白表达的影响见表3。
表3 治疗结束后各组大鼠骨骼肌ERK、JNK蛋白表达比较 (±s)
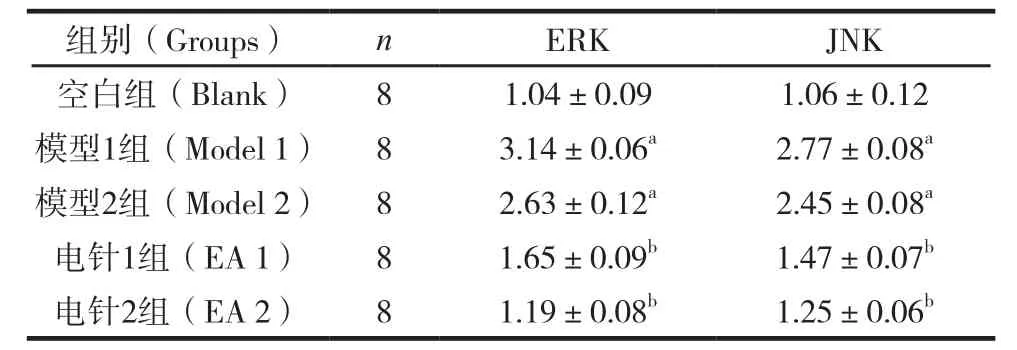
表3 治疗结束后各组大鼠骨骼肌ERK、JNK蛋白表达比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05。
组别(Groups)nERKJNK空白组(Blank)81.04±0.091.06±0.12模型1组(Model 1)83.14±0.06a2.77±0.08a模型2组(Model 2)82.63±0.12a2.45±0.08a电针1组(EA 1)81.65±0.09b1.47±0.07b电针2组(EA 2)81.19±0.08b1.25±0.06b
3 讨 论
结果显示,高脂高糖饮食喂养,各模型组及各电针组大鼠的FBG、FINS、Homa-IR均较空白组显著升高(P<0.05),存在明显的胰岛素抵抗,提示造模成功。而经过电针治疗后,各电针组大鼠FBG、FINS、Homa-IR比各模型组显著降低,表明电针明显改善大鼠胰岛素抵抗状态,这同有关研究报道结果一致[5-8]。
JNK和ERK同属于有丝分裂原家族,在肥胖患者的一些组织中代谢和炎症应激增加JNK和ERK的活性,进而诱导IRS1或IRS2 丝氨酸位点磷酸[9,10],炎性细胞因子诱导的ERK通路也介导IRS1表达的下调[11],从而妨碍胰岛素信号转导而促进胰岛素抵抗。结果显示,各模型组大鼠的ERK、JNK蛋白表达水平均高于空白组,经过电针治疗的各电针组大鼠的ERK、JNK蛋白表达水平较各模型组明显降低,这说明电针干预使大鼠ERK、JNK蛋白从兴奋水平下降到接近正常水平,从而降低ERK、JNK的活性,减少诱导IRS1或IRS2 丝氨酸位点磷酸,从而改善胰岛素抵抗状态。
研究结果证明电针治疗能够显著降低胰岛素抵抗模型大鼠FBG和FINS水平,通过降低ERK、JNK蛋白表达水平达到改善胰岛素抵抗状态的目的,证实电针具有调节内分泌、提高集体对胰岛素的利用率等作用,表明电
针具有改善胰岛素抵抗状态的作用。
[1] Mohan V,Sandeep S,Deepa R,Shah B,Verghese C.Epidemiology of type 2 diabetes:Indian scenario[J].Indian J liked hex,2007,125:217-30.
[2] 王艳军,孙巍巍,张丽霏,等.胰岛素抵抗大鼠肌肉中IRS-1、P70S6K的表达[J].中国现代医学杂志,2009,19(11):1617-1624.
[3] 李光伟,胰岛素敏感性评估及其在临床研究中的应用[J].中华内分泌代谢杂志,2000,16(3):198-200.
[4] 顾陈怿,胡军,蔡云彪.电针刺激参数的研究进展[J].中国针灸,2003,23(8):466-467.
[5] 加藤麦[日].针刺对OLETF大鼠胰岛素抵抗的影响[J].国外医学中医中药分册,1999,21(4):50.
[6] 刘志诚,孙凤岷,朱苗花,等.针灸对非胰岛素依赖性糖尿病胰岛素抵抗的影响[J].上海针灸杂志,2000,19(1):5-7.
[7] 周逸平,王月兰,汪克明,等.针刺心经经脉对自发性高血压大鼠血压及生化指标的影响[J].中国中医药科技,1996,3(6):6.
[8] 许能贵,梁兴伦.针刺对自发性高血压大鼠血压及胰岛素抵抗的效应研究[J].中国针灸,1997,17(8):493.
[9] Bashan N,Dorfman K,Tarnovscki T,et al.Mitogen-activated protein kinases,inhibitorykappaB kinase,and insulin signaling in human omental versus subcutaneous adipose tissue in obesity[J]. Endocrinology,2007,148(6):2955-2962.
[10] Shoelson SE,Herrero L,Naaz A,Obesity,inflammation,and insulin resistance[J]. Gastroenterology,2007,132(6):2169-2180.
[11] Jager J,Gremeaux T,Cormont M,et al.Interleukin-1 beta-induced insulin resistance in adipocytes through down-regulation of insulin receptor substrate-1 expression[J].Endocrinology,2007,148(1):241-251.
Objective:To investigate the influence of electroacupuncture on expression of ERK and JNK protein in the skeletal muscle of insulin resistant rat. Method:The male SD rats were randomly divided into five groups, blank group,model 1 group,model 2 group,EA 1 group and EA 2 group. To establish the insulin resistant rats model by feeding with high fat and high sugar diet. We detect FBG with the glucose oxidase method and FINS with the radioimmunoassay,and then we calculated the Homa-IR. After the successful modeling determined,the EA group were treated with electroacupuncture at Zusanli,Sanyinjiao and Weiwanxiashu. The expression of ERK and JNK protein in the skeletal muscle of rats was detected with the Western blot. Result:After electroacupuncture,the FBG, FINS and Homa-IR of each model group significantly increased more than that of blank l group(P<0.05). The expression of ERK and JNK protein of each model group significantly increased more than that of blank l group(P<0.05).The FBG, FINS, Homa-IR of each EA group significantly decreased more than that of each model group(P<0.05). The expression of ERK and JNK protein of each EA group significantly decreased more than that of each model group(P<0.05).Conclusion:The electroacupuncture could improve insulin resistant by regulating the expression level of ERK and JNK protein in the insulin resistant rat.
Insulin resistant;Rat model;electroacupuncture;ERK;JNK
R245.319
B
1004-2814(2015)04-0268-03
2015-01-16
唐成林
