BODIPY类近红外荧光染料的研究进展
2015-12-05孙丹袁雪梅徐海军徐莉沈珍
孙丹 袁雪梅 徐海军*,,2 徐莉 沈珍
(1南京林业大学化学工程学院,江苏生物质能源与化学品重点实验室,南京210037)
(2南京大学配位化学国家重点实验室,南京210093)
(3南京林业大学现代分析测试中心,南京210037)
综述
BODIPY类近红外荧光染料的研究进展
孙丹1袁雪梅1徐海军*,1,2徐莉3沈珍*,2
(1南京林业大学化学工程学院,江苏生物质能源与化学品重点实验室,南京210037)
(2南京大学配位化学国家重点实验室,南京210093)
(3南京林业大学现代分析测试中心,南京210037)
近红外BODIPY分子是一类新兴的荧光染料,因其具有优异的光物理和光化学性能而得到广泛的研究,已成为一个新兴的研究热点。本文综述了近年来BODIPY类近红外荧光分子的设计、合成及应用的最新研究进展,并展望了其未来的发展方向和应用前景。
氟硼二吡咯;近红外;荧光染料;光电功能材料
0引言
近红外荧光染料的吸收和发射波长为700~1 100 nm,在该范围内物质对近红外光的吸收比较少,因此近红外光在传播过程中受到的干扰小、对物质透过性好;特别是在该光谱区,生物分子自身的吸收和荧光最小,并且随波长的增加,可以避免生物体散射光以及自荧光对检测结果造成的偏差影响,散射干扰也大为减少;且对组织细胞渗透性强[1-3]。因此,近红外荧光染料在生物检测领域具有无与伦比的优势,不仅可避免背景干扰而获得较高的分析灵敏度,而且还可以降低对生物体的损伤[1,4]。近年来,近红外染料分子在光学成像、肿瘤诊断、军事侦察、红外伪装、非线性光学材料和荧光标识等多个领域发挥着显著作用,使得合成近红外吸收和荧光发射的染料分子成为化学、材料和生物等科学领域的研究热点[3,5-7]。
BODIPY类荧光染料是一类重要的荧光染料,其基本结构单元如图1所示。其具有以下优点[8-11]:(1)BODIPY染料具有高的荧光量子产率,有的甚至在水中的荧光量子产率可以达到1.0;(2)荧光信号对溶剂的极性和pH不敏感;(3)具有相对较好的光热稳定性;(4)BODIPY荧光光谱半峰宽较窄,作为荧光标识时有很好的灵敏度;(5)高的摩尔消光系数,通常大于80 000 L·mol-1·cm-1,吸光效率比较高;(6)结构易于修饰,发射波长可调变至近红外区域。基于以上优点,BODIPY类荧光染料越来越受到人们的关注。

图1 BODIPY中心骨架结构Fig.1 Structure of BODIPY core
经典的BODIPY荧光分子的吸收和发射波长大多在480~540 nm之间[12-13],如化合物1的最大吸收波长和荧光发射波长分别在497和507 nm[14-15];如果在生物检测中,样品的基体和杂质也会在相似或相同波长区域有吸收或者荧光发射,再加上背景散射的影响,可能会产生严重的背景干扰,从而显著降低了荧光分析法的灵敏度和应用领域。为了调节BODIPY类化合物的吸收波长和发射波长,从上世纪80年代未开始发展了许多BODIPY衍生物的合成方法;但直到2001年,Daub和Knut等[16]首次在BODIPY的3位引入对二甲氨基苯乙烯基(如化合物2),从而开创了BODIPY类近红外荧光染料的研究。近年来,通过在BODIPY核心周边位置引入不同取代基合成具有不同激发和发射波长的近红外荧光染料已引起了国内外研究者广泛的关注。通常采取以下几种方法[8,17]:(1)β位芳环共轭;(2)在3、5位引入双键等结构使母核共轭延长;(3)2、3位及5、6位芳环共轭;(4)1、7、8位芳环共轭;(5)2、6位炔基共轭;(6)meso位N原子取代C原子。因此,本文将从以上几个方面对BODIPY类近红外荧光染料分子领域的最新研究进展进行综述,并展望BODIPY类近红外荧光染料的发展前景。

1BODIPY中心β位芳环共轭近红外荧光染料
增大BODIPY类染料发射波长的有效方法之一是在其β位引入共轭的芳环结构,增大π键共轭体系。吡咯β位芳环共轭不仅增强刚性,而且还能保持BODIPY核心平面性。Ono等[18]合成了BODIPY的β位共轭苯环的染料分子3和4,它们在氯仿溶剂中的最大吸收波长分别在560和603 nm,且有很强的荧光,发射波长分别为540和618 nm。另外,为获得HOMO-LUMO能级较小的染料分子,在BODIPY的β位稠合苊烯基形成π共轭体系也是非常有效的。Ono等[17]还设计合成了染料分子5和6,它们的最大吸收波长分别在588和657 nm。

沈珍等[19]也以2-甲基-4,7-二氢-4,7-桥亚乙基-2H-异吲哚原料,通过逆Diels-Alder反应得到β位芳环稠合的系列BODIPY染料分子7a~f。7a~d在乙腈溶剂中的最大吸收波长在598 nm左右,最大发射波长在605 nm左右;7e~f在乙腈溶剂中最大吸收波长为634 nm,最大发射波长为662 nm。3、5位为甲基的染料分子荧光量子产率均在0.7以上,而3、5位为甲酸乙酯基的染料分子荧光量子产率均在0.5以下,这主要是由于甲酸乙酯基为柔性基团导致了荧光量子产率降低。另外,meso位不同芳基取代对光谱性质影响较小。相对于化合物1,尽管每个苯环导致了50~60 nm红移,然而这个系列BODIPY染料的最大吸收和发射波长仍然低于700 nm。

Vicente等[20]以4,5,6,7-四氢-2H-异吲哚-1-甲酸乙酯为原料设计合成了一系列β位苯环共轭的BODIPY染料分子8a~e,除了meso位为五氟苯基取代的8c在二氯甲烷溶剂中最大吸收和发射波长分别在658和680 nm,其它4个染料分子8a、8b、8d和8e在二氯甲烷溶剂中最大吸收波长和发射波长分别在643和665 nm左右。同样受甲酸乙酯基影响,8a~e的荧光量子产率均在0.5以下。把8a~e染色到HEp2细胞上,通过细胞荧光成像及细胞毒性研究表明8a~e容易被细胞吸收,仅有较弱的细胞毒性作用,且能生物成像,因此这些化合物具有潜在的生物应用研究价值。

沈珍等[21]设计合成了一类β位菲环共轭的BODIPY染料分子9a~d。这类化合物在叔丁醚溶剂中最大吸收波长在621~642 nm,最大发射波长在636~668 nm,具有相当高的摩尔消光系数及大的荧光量子产率(在0.9以上)。尽管菲环比苯环具有更高的共轭度,但在BODIPY的β位稠合菲环,它们的吸收和发射波长仍在700 nm以下。值得注意的是,含有N,N-二甲基氨基的化合物9d,可作为pH响应的荧光探针,在极性酸性溶剂中,荧光增强150倍。

为了获得吸收和发射波长在近红外区的荧光化合物,Okujima等[22]以双环[2.2.2]辛二烯-稠合二吡咯亚甲基为原料,通过逆Diels-Alder反应得到BODIPY中心β位共轭更大共轭体系的苯并荧蒽新型染料分子10a~b。这类荧光染料的最大吸收波长和最大发射波长在750 nm以上,达到了近红外区,10a的最大吸收波长在765 nm,最大发射波长在783 nm;10b的最大吸收波长在761 nm,最大发射波长在777 nm。遗憾的是此类线性共轭的BODIPY染料分子在空气及可见光条件下不稳定,易被氧化;另外荧光量子产率也只有0.3左右,且由于包含较多的共轭芳香结构,导致染料的溶解性太差,从而阻碍了在生化领域的应用,仍需进一步修饰以提高光稳定性及水溶性。

2012年,Uno等[23]以4,8-桥亚乙基-4,8-二氢吡咯并[3,4-f]的异吲哚为原料,并使用逆Diels-Alder反应,设计合成β位苯环共轭双BODIPY荧光染料11a~c。这类荧光染料分子最大吸收波长和发射波长已超过了700 nm,达到了近红外区,但由于包含较多共轭芳香结构,导致染料分子的溶解性太差,尽管在中位引入对叔丁基苯能有效改善其溶解性,然而此类化合物在有氧溶剂中易分解、稳定性差。
为了提高此类近红外荧光染料化合物稳定性,Uno等[24]使用吸电子氰基或乙酯基取代3,5位甲基及用氟取代β位稠合苯环上的氢原子,成功设计合成了染料分子12a~d。它们在二氯甲烷溶液中最大吸收波长分别为885、903、749和811 nm。12c~d的荧光发射波长分别为926、755和819 nm,荧光量子产率在0.2以下,且12a没有荧光发射。尽管这些染料在有氧气氛中及在室温光照下有很好的稳定性,然而在有机溶剂中溶解性较差,且不溶于水。


总之,β位芳环共轭BODIPY近红外荧光染料由于合成步骤多、难度大,且稳定性较差,量子产率低,目前文献报道不是很多,对此类染料分子设计合成及光物理性质研究仍具有较大的挑战。
2BODIPY中心3、5位苯乙烯基共轭的近红外荧光染料
BODIPY中心3、5位二甲基具有一定活性,在催化剂的作用下可与芳醛发生Knoevenagel缩合反应生成苯乙烯基,这样可形成较大BODIPY染料共轭分子体系,从而使荧光染料分子的吸收和发射波长发生显著红移。沈珍等[15]对BODIPY中心3,5位烯烃取代作了规律性总结,通常2个苯乙烯基能导致约150 nm红移,而2个4-N,N-二甲氨基苯乙烯基能导致200 nm红移。Rurack等[16]首次使用Knoevenagel缩合反应在BODIPY中心3位引入苯乙烯基合成得到染料分子2,其在正已烷溶液中最大电子吸收光谱和发射光谱分别在596和611 nm,荧光量子产率为0.97。2的荧光光谱显示明显的溶剂效应,随着溶剂极性增大峰形变得越宽,且逐渐红移。另外,还可作为酸性荧光传感器。
Akkaya等[25]等设计合成了化合物13和14。13和14在氯仿中的最大吸收波长分别在700和620 nm。显然,吸电子吡啶基对BODIPY光谱影响较小。有趣的是,2个化合物均可发生分子内电荷转移机制ICT(internal charge transfer);化合物13与化合物14在TFA有机溶剂中质子化后显示出相反的光谱变化效应;在13的溶剂中添加TFA,能导致电子吸收光谱和荧光发射光谱蓝移,相反地,添加TFA能导致化合物14的电子吸收和发射光谱红移,因此这2个化合物可用于设计红外pH荧光探针。

Wang[26]等以3、5-二甲基BODIPY与对辛基苯甲醛为原料通过Knoevenagel缩合反应在BODIPY母体3,5位引入带有长链烷烃基二苯乙烯基团,并使用Suzuki偶联反应在meso位苯基上引入苯甲酸基团得到BODIPY化合物15。其在甲苯溶剂中的最大吸收波长和发射波长分别出现在636和655 nm,且电子吸收光谱和荧光发射光谱随着溶剂极性的增加,逐渐蓝移。

Ziessel等[27]设计合成了BODIPY母体3、5位二苯乙烯基团连接长链烷烃基的染料分子16。16在四氢呋喃溶剂中最大吸收波长为646 nm,而最大发射波长为669 nm,荧光量子产率为0.4。特别重要的是化合物16在65%水-四氢呋喃溶液中,能自组装为近红外有机纳米荧光粒子,其最大吸收波长为750 nm,发射波长为743 nm。

Ziesse等[28]设计合成了一系列BODIPY中心3、5-二芳基乙烯共轭化合物17~19。化合物17的电子吸收和发射波长分别在631和645 nm,荧光量子产率为0.75;化合物18的最大吸收和发射波长分别在632和714 nm,其荧光量子产率仅为0.038;化合物19的最大吸收和发射波长分别691和720 nm,荧光量子产率为0.80。即随着芳基共轭度的增大,BODIPY染料分子的吸收光谱和发射光谱发生红移,直到发射光谱进入近红外区。另外,还通过Sonogashira偶联反应在3,5-二苯乙烯基苯环对位引入炔基共轭的芘基和苝基化合物20~22。化合物20最大吸收和发射波长分别在661和683 nm,化合物21的最大吸收和发射波长分别在659和675 nm,化合物22最大吸收和发射波长分别在662和 680 nm,化合物20~22的荧光量子产率都在0.80以上,且都具有较大摩尔消光系数,即在1×105L·mol-1·cm-1以上。然而相对于化合物17,化合物20~22的最大吸收和发射波长仅红移了30 nm左右,因此,芘乙炔基及苝乙炔基对光谱的影响是非常有限的。且由于芘和苝含有较多的共轭芳环结构,导致染料的溶解性及水溶性较差,从而也限制了这些BODIPY染料在生物领域应用研究。
Guo等[29]等设计合成基于香豆素和BODIPY构成能量转换体系的化合物23a~c。化合物23a~c能量转移效率均在98%以上,化合物23a的最大电子吸收波长和发射波长分别在641和658 nm;化合物23b其最大电子吸收波长和发射波长分别在700和750 nm。值得注意的是,染料23b的氨基可与H+结合成氨基正离子化合物23c,当pH值从7.5到慢慢减小到1.5时,随着酸性的增强,在750 nm处较弱的荧光逐渐消失,相反在632 nm处出现一个荧光增强的发射波长,荧光量子产率可达0.56,显示为亮红色溶液,因此染料23b可作为高灵敏性酸性指示剂。

Kovtun等[30]设计合成了BODIPY中心3、5-乙烯基共轭的染料分子24和25a~c。化合物24在二氯甲烷溶剂中的吸收波长为755 nm。化合物25a、25b和25c二氯甲烷溶剂中的吸收波长分别在862、895和949 nm。这类化合物在中性或者碱性条件下,氮原子上的孤对电子通过光诱导电子转移机制(PET)转移至BODIPY中心骨架因电子激发而空出电子轨道上,导致化合物荧光淬灭或较弱的荧光。而在酸性条件下,氮原子被质子化,它们电子吸收光谱发生蓝移,另外由于阻断了PET机制,化合物荧光增强且发生蓝移。


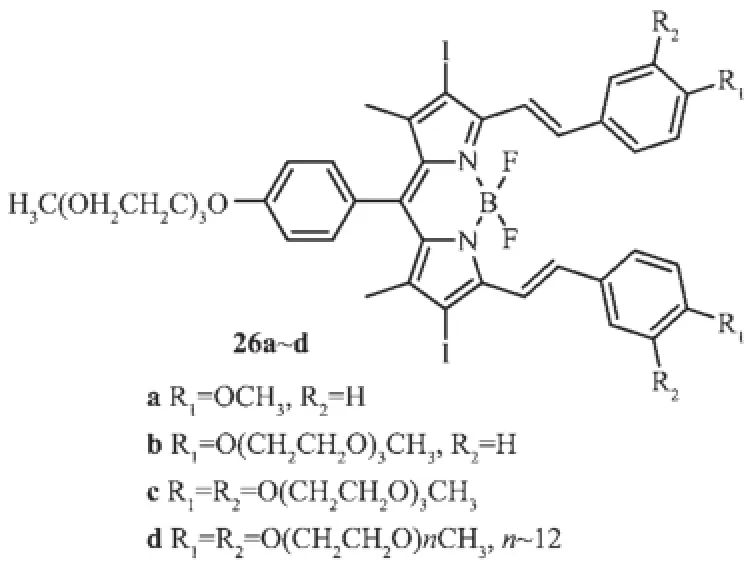
Dennis等[31]设计合成了系列化合物26a~d,其最大吸收波长和发射波长分别出现在661~667 nm和689~703 nm,并用于HT29人类大肠癌细胞荧光成像研究。激光共聚焦荧光成像结果显示,化合物26a~d有较好的光动力治疗活性,是一类非常有效的光敏剂。

3BODIPY中心2、6位炔基共轭的近红外荧光染料
BODIPY中心2、6位上有取代基时对BODIPY化合物的光谱影响较大。在这两个位置上的炔基取代会明显增大染料的最大吸收和发射波长,近年来BODIPY中心2、6-位功能化修饰也引起了极大的关注。肖义等[32]通过Sonogashira偶联反应设计合成了BODIPY中心2,6-位炔基共轭染料分子27和28。在二氯甲烷溶剂中,化合物27的最大电子吸收光谱和荧光发射光谱分别在561和594 nm,化合物28的最大电子吸收光谱和荧光发射光谱分别在575和610 nm(红光区),荧光量子产率分别为0.82和0.79。化合物27和28比大多数BODIPY化合物具有较大的斯托克斯位移,分别为33和35 nm。有趣的是,与之前报道的BODIPY化合物不同,化合物28能发射固态荧光,这是由于更大体积取代基三苯基甲基增加了空间位阻,抑制了π-π相互作用,增加了非平面性及斯托克斯位移,因此导致了激发态构型的变化,有效地抑制了固态激发态的自猝灭[33]。化合物27和28还可用作电致发光材料。
肖义等[34]对BODIPY中心2、6位进行基团修饰合成了一类具有双光子吸收的染料分子29和30,且能用于生物荧光成像。化合物29的最大电子吸收和发射光谱分别在597和653 nm,荧光量子产率为0.36。化合物30的最大电子吸收和发射光谱分别在593和659 nm,荧光量子产率为0.31。最近,肖义等[35]又合成了具有双BODIPY特征吸收的化合物31;在乙酸乙酯溶剂中吸收光谱是2、6-炔基BODIPY衍生物及母体BODIPY分子光谱叠加,即为503和568 nm,但其发射波长仅为600 nm。
沈珍等[36]以2,6-双碘代BODIPY为原料与三苯基硅基苯乙炔通过Sonogashira交叉偶联反应合成2、6-位苯乙炔基共轭的染料分子32。在二氯甲烷溶剂中的电子吸收波长和荧光发射波长分别为575和600 nm。固态荧光量子产率为0.03。与三苯基甲基一样,三苯基硅基为大体积的取代基,极大地增加了空间位阻,抑制了π-π相互作用,增加了非平面性及斯托克斯位移,有效地抑制了激发态的自猝灭,从而使化合物32能产生固态荧光。尽管BODIPY化合物在溶液中有强的荧光发射,但具有固态荧光的BODIPY化合物仍是很稀少。



2012年,Lin等[37]设计合成了BODIPY中心2、6-位炔基修饰的可用于有机太阳能敏化电池的化合物33和34。化合物33最大电子吸收光谱和荧光发射光谱分别在580和656 nm;化合物34的最大电子吸收光谱和荧光发射光谱分别在582和659 nm。由于从外围氨基向BODIPY中心显著的电荷转移导致发射光谱产生较大的斯托克斯位移。
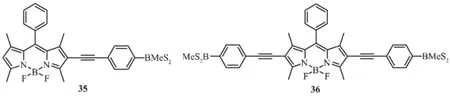
赵翠华等[38]设计合成了有机硼修饰BODIPY的染料分子35和36,35在THF的最大电子吸收光谱和发射光谱分别在535和570 nm,荧光量子产率为0.78;而36在THF的最大电子吸收光谱和发射光谱分别在576和611 nm,荧光量子产率为0.64。由于大体积的硼基抑制了固态分子间作用,因此2个化合物在固态时仍保持强的固态荧光。当往这些化合物的THF溶液中加入TBAF或TBACN时,会引起荧光光谱的变化。利用这一现象,可以将化合物35和36用作氟离子和氰离子荧光探针。
4BODIPY中心2、3位及5、6位芳环共轭近红外荧光染料
在BODIPY的吡咯环融合共轭的芳环基团,不仅可以保持BODIPY刚性,还可以扩展π共轭体系及增加分子的平面性,与BODIPY中心β位芳环共轭类似,在BODIPY中心2、3位及5、6位稠合芳环,同样也可以导致吸收光谱和发射光谱移向更长波长。2008年,Suzuki等[39-40]通过在BODIPY的2、3和5、6位引入共轭的呋喃环合成了化合物36a~d,此类化合物减小了分子的扭转程度,从而使其最大吸收波长和发射波长红移。36d为吸收波长和发射波长分别在723和738 nm的近红外荧光染料分子,且其最大摩尔消光系数高达253 000 L·mol-1· cm-1,高的摩尔吸光系数有利于促进单线态氧的产生,从而有可能使荧光染料应用于光动力学治疗[41]。另外还可以通过引入电子给体和电子受体调节光谱吸收和发射波长。

Samuel等[42]用硫原子取代氧原子及溴原子取代BODIPY中心部分氢原子设计合成了化合物37a~d。染料分子37b和37c的最大吸收光谱和发射光谱分别在720~766 nm和738~820 nm。引入的溴原子有利于三重激发态的产生,与氧相互作用能产生单线态氧及显现很高的亮度,可用作近红外荧光成像及光动力治疗光敏剂。

Suzuki等[43]合成了一种用于Ca2+检测的新型近红外荧光探针分子38。其最大吸收波长在655 nm,且不受Ca2+的影响;与Ca2+配位后,化合物的荧光量子产率增加120倍(最大发射波长为670 nm)。在ATP的存在下,化合物38能够用于生物体系内钙离子荧光成像。

2012年,Shinokubo等[44]设计合成了在BODIPY中心的2、3和5、6位引入共轭的联苯基团的染料分子39,其在二氯甲烷溶剂中的最大吸收波长和发射波长分别为673和692 nm,且具有较高的荧光量子产率(Φ=0.51)及较低的LUMO能级轨道,可用作n-型光伏材料。


最近,沈珍等[45]设计合成BODIPY中心2、3位和5、6位稠合五元噻吩环化合物40a~b。化合物40a和40b具有较强的摩尔吸光系数(203 000 L· mol-1·cm-1,230 000 L·mol-1·cm-1),40a在二氯甲烷溶剂中的最大吸收波长和发射波长分别为684和712 nm,荧光量子产率为0.31。β位溴化后的产物40b,在二氯甲烷中的最大吸收波长和发射波长发生红移,分别为698和724 nm;但由于溴原子在BODIPY荧光染料中心上,产生较强的重原子效应,导致荧光量子产率降低,仅为0.04。另外,他们还利用单线态氧捕捉剂1,3-二苯基异苯并呋喃(DPBF)来测定光敏剂40a和40b单线态氧的产生能力,并与甲基蓝对比,在波长为635 nm激光照射下,40b产生单线态氧显著优于甲基蓝。而且,他们还将39b用于HeLa细胞实验,实现了对HeLa细胞激光共聚焦成像,证明40b作为近红外光敏剂在光动力治疗中具有潜在的应用价值。然而这些化合物的水溶性及对肿瘤细胞的选择性仍需要进一步研究。
5BODIPY中心1、7、8芳环共轭近红外荧光染料
在meso位引入共轭聚乙烯基,BODIPY的光谱性质也会发生显著变化,但更多的是显示菁染料衍生物性质。Kovtun等[46]合成了一系列BODIPY中心meso位乙烯基共轭的染料分子41、42a~c和43。化合物41在二氯甲烷溶剂中最大电子吸收波长在501 nm,同样由于分子内光致电子转移导致荧光淬灭;但经酸化后会电子吸收光谱蓝移55 nm并有强荧光发射。化合物42a和42b在二氯甲烷溶剂中的最大电子吸收波长在分别在661和679 nm,发射波长分别为712和726 nm;而化合物42c和43在二氯甲烷溶剂中最大电子吸收波长分别在710和737 nm,进入近红外区。然而,不同于经典的BODIPY染料分子,这些化合物仅有较小的摩尔消光系数。

Wu等[47]注意到BODIPY染料分子中心的meso位和β位形成了理想的“锯齿状”构型,可以有效稠合芳香族单元结构,这样形成的共轭有利于BODIPY化合物的吸收波长和发射波长红移到远红外和近红外区光谱区。他们以苝醛衍生物为原料设计合成BODIPY中心meso位及β位稠合N-稠苝的化合物44。44在甲苯中的最大电子吸收波长在670 nm,荧光发射波长在742和830 nm,荧光量子产率为0.82。化合物44的甲苯溶液在空气中放置几个月光谱都没有变化,具有良好的光稳定性。
卟啉和BODIPY周边均具有锯齿状构型,Wu[48]等设计合成了BODIPY中心meso位和β位与卟啉共轭的染料分子45和46。45和46的最大电子吸收光谱波长分别在890和1 040 nm。


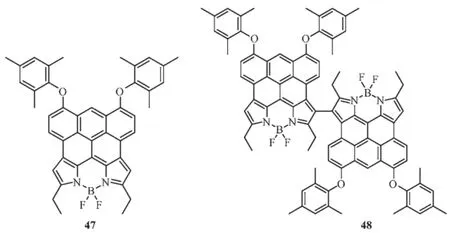
后来,Wu等[49]又设计合成了BODIPY中心meso位和β位共轭蒽环的化合物47和二聚体化合物48。化合物47在紫外-可见区及近红外区均有很强的电子吸收光谱,例如301、401、606、650、760和826 nm。同样的,二聚体化合物48具有与化合物47相类似的电子吸收光谱,相对于47仅有些许红移。47和48发射波长均在910 nm以上,然后荧光量子产率小于0.01。另外,在空气中化合物47和48的甲苯溶液在紫外光(4 W,254 nm)照射118 h后,它们吸收光谱几乎没有明显变化,证实了该类化合物具有很好的光稳定性。
6BODIPY中心meso位N原子取代Aza-BODIPY近红外荧光染料
BODIPY中心meso位C原子被N原子取代能导致该荧光染料电子吸收光谱和发射光谱显著红移,俗称aza-BODIPY荧光染料。2002年,O′Shea等[50]报道了meso位C被N取代的第一类aza-BODIPY荧光染料化合物49a~b和50a~b。化合物49a在氯仿中的最大电子吸收波长和发射光谱分别为650和672 nm,荧光量子产率为0.34;相对于经典的BODIPY荧光染料分子电子吸收光谱和荧光发射波长红移了150 nm左右。49a的激发波长和发射波长仍在700 nm以下,仍需对其结构进行修饰,如在3、5位苯环对位引入给电子基甲氧基能导致电子吸收光谱进一步红移,即49b电子吸收光谱波长在688 nm,发射波长为727 nm,荧光量子产率为0.36。接着他们通过在aza-BODIPY荧光染料中心2、6位引入溴原子研究其光物理性质,当溴化后,最大吸收和荧光发射波长变化不大,只产生轻微蓝移,但溴原子较强的重原子效应显著减少了荧光量子产率,50a和50b在氯仿溶剂中的吸收波长分别为650和679 nm,荧光发射波长分别为673和714 nm,荧光量子产率为分别为0.012和0.1。另外,O′Shea等[51]还将50b作为PDT光敏剂用于活体成像的研究,将50b注射到具有肺肿瘤模型的小鼠尾静脉血管内,经过15 min的血液循环以后,利用活体荧光成像系统在小鼠肿瘤部位观察到了明亮的荧光,证明50b能够实现对活体肿瘤的靶向诊断。

Carreira等[52]通过引入环状结固定3、5-苯环结构增加核心部分的刚性平面结构设计合成了化合物51,其在氯仿溶液中最大吸收波长为740 nm,摩尔消光系数为159 000 L·mol-1·cm-1,发射波长在751 nm,荧光量子产率为0.28。相对于化合物49b,由于减少了分子的扭转程度,使其最大吸收波长红移了52 nm。同时他们研究了溶剂对它的影响和光稳定性,结果表明不同溶剂(氯仿、甲苯、乙酸乙酯、乙腈、乙醇)对它的荧光发射波长和量子产率基本没影响,且具有良好的光稳定性。

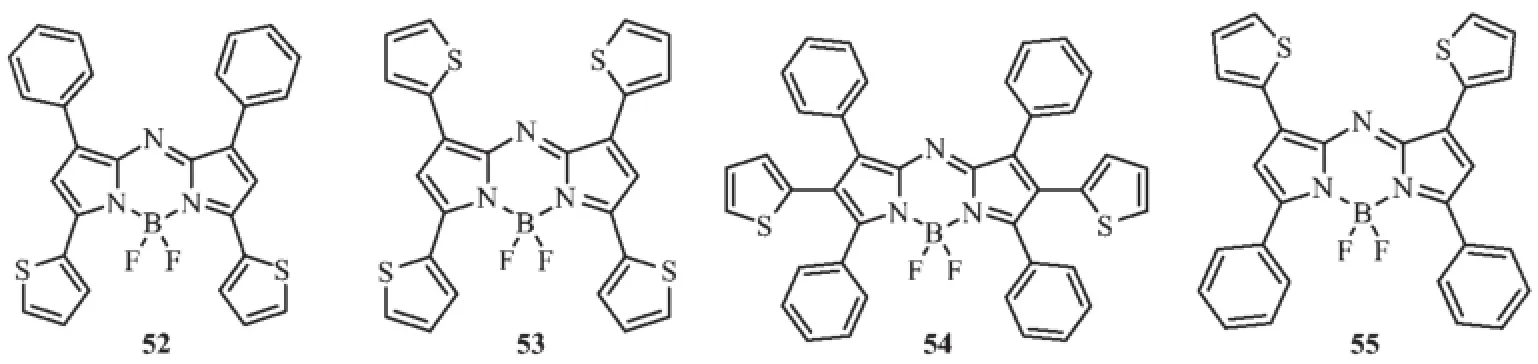
有趣的是富电子的噻吩基取代49a中1、3、5、7四个苯基更有利于Aza-BODIPY荧光染料分子吸收和发射光谱红移。肖义等[53]及Hartmann等[54]先后设计合成了噻吩修饰Aza-BODIPY化合物52和53。52和53在二氯甲烷溶剂中最大吸收光谱分别是718和742 nm,而发射光谱各自为740和768 nm,荧光量子产率分别为0.44和0.11;且对溶剂极性仅有很小的敏感性。令人惊奇的是,Aza-BODIPY中心2、6位被噻吩基取代后的化合物54,其最大吸收波长为650 nm,与2、6位未取代的化合物49a是一样的,但峰形变宽,且紫外区吸收减少了,表明2、6-位噻吩基取代对可见光部分吸收没有影响[54]。同时,化合物55也成功被合成出来[54],通过比较52、53和55的光谱性能,表明aza-BODIPY中心3、5位噻吩基取代比1、7位取代对光谱性质影响更加显著。
由于Aza-BODIPY荧光染料合成步骤多、难度大;近年来,Lukyanets等[55]报道了一种新的Aza-BODIPY合成方法,且可以在Aza-BODIPY中心的β位稠合芳环,以增大母体π共轭体系,使染料分子的吸收和发射波长红移。他们以对苯二腈与格氏试剂为原料合成β位苯环共轭的Aza-BODIPY荧光染料56a~b。相对于49a,Aza-BODIPY中心β位苯环稠合导致了65 nm的红移;化合物56a和56b的最大吸收波长为分别为715和724 nm,最大荧光发射波长分别为736和749 nm,荧光量子产率分别为0.15和0.11,是一类可应用于生物领域的近红外荧光染料,且可作为有效光敏剂应用于光动力学治疗(PDT)。

Gresser等[56]也以邻苯二氰和不同格氏试剂为原料合成了一系列β位苯环的共轭的Aza-BODIPY荧光染料分子57a~f。它们在二氯甲烷溶剂中最大吸收波长在681~793 nm,而荧光发射波长在723~841 nm,优越的光学性能使这些分子可作为近红外吸收及荧光染料。

沈珍等[57]也使用溴化芳基镁与苯二腈或者萘二氰反应合成了一系列芳环稠合的氮杂硼二吡咯亚甲基(Aza-BODIPY)染料分子56a、58a~b及59。苯并和1、2-萘并-3,5-二芳基Aza-BODIPY的最大吸收和荧光光谱都在近红外区域(〉700 nm)。相对于化合物56a,3、5位苯基对位F原子取代化合物58a的摩尔消光系数显著减小,但对其他光物理性质影响较小,如在二氯甲烷溶剂中最大吸收波长和发射波长分别为713和724 nm。3、5位苯基对位二甲基氨基取代导致了吸收光谱显著红移,但峰形变宽;化合物58b在二氯甲烷溶液中的最大吸收光谱和发射波长分别在794和830 nm,荧光量子产率为0.01。他们还研究了pH值对58b的影响,随着pH值的减少,吸收光谱和发射波谱都发生显著蓝移,最大吸收波长从794 nm先蓝移到771 nm再蓝移到724 nm,最大荧光发射波长从830 nm蓝移到745 nm,且荧光强度增强,因此化合物58b可作为近红外的荧光增强型pH探针。另外,Aza-BODIPY中心β位萘环稠合的化合物59在二氯甲烷溶液中最大吸收光谱和发射光谱分别在737和753 nm,荧光量子产率为0.20。

Ramaiah等[58]设计合成了一系列Aza-BODIPY的母核及周围被溴或碘取代的染料分子60a~c和61a~c。在BODIPY的母核上无论是溴化或碘化,对其电子吸收光谱的影响较小,但由于溴和碘原子的重原子效应导致荧光量子产率显著降低。他们利用单线态氧捕捉剂1,3-二苯基异苯基呋喃(DPBF)研究这些染料分子单线态氧的产生能力,结果表明,可以通过Aza-BODIPY的母核及周围溴或碘取代数量调节单线态氧的产生效率。他们还将化合物61b作为光氧化催化剂用于1-萘酚氧化为1,4-萘醌的反应,证明了这些Aza-BODIPY化合物作为光敏剂在光动力治疗及光氧化中具有潜在应用价值。

7总结和展望
BODIPY是一类具有良好光物理性质的荧光染料,并且具有结构易于修饰等优势。BODIPY中心骨架的各取代位置引入不同的取代基可得到具有不同功能的近红外吸收和荧光发射的系列染料。尽管近红外BODIPY染料的研究已取得很大进展,但真正商业化仍存在很多不足,如合成步骤多、难度大,染料的Stokes位移小及化学性质、光、热稳定性差等。目前,国内外对BODIPY类近红外荧光染料构效关系研究较少,因此全面系统地探索BODIPY衍生物结构对其性能的影响,对于合理设计具有高量子产率、光稳定性好和溶解性可调等优点的近红外BODIPY荧光染料具有重要意义。另外,近红外BODIPY染料的水溶性与它的实际应用密切相关,如何引入具有水溶性、细胞兼容性等特点的氨基酸、糖、肽等分子,进一步提高其生物相容性、细胞渗透性、降低其毒性,仍是该领域科研工作者关注的重点和难点,需要化学科学、生物科学和材料科学等学科的交叉融合。设计并合成具有量子产率高、光稳定性及生物相容性好的近红外BODIPY染料,把近红外BODIPY染料真正应用到生物体系中,对生物检测、医学成像、基因组学等有重要意义,也将推动BODIPY类近红外荧光染料研究的进一步发展。
[1]Frangioni J V.Curr.Opin.Chem.Biol.,2003,7:626-634
[2]Ntziachristos V,Bremer C,Weissleder R.Eur.Radiol.,2003, 13:195-208
[3]LIU Zheng(刘政),SUN Li-Ning(孙丽宁),SHI Li-Yi(施利毅), et al.Progress in Chemistry(化学进展),2011,23(1):153-164
[4]Jin Y,Ye F,Zeigler M,et al.ACS Nano,2011,5(2):1468-1475
[5]Yuan L,Lin W Y,Zheng K B,et al.Chem.Soc.Rev.,2013,42 (24):622-661
[6]Qian G,Wang Z Y.Chem.Asian J.,2010,5(5):1006-1029
[7]Pogue B,Jiang S D,Dehghani H.Alternative Breast Imaging. Chapter 10.Boston:Springer,2005:201-226
[8]Lu H,Mack J,Yang Y,et al.Chem.Soc.Rev.,2014,43: 4778-4823
[9]Ulrich G,Goeb S,Nicola D A,et al.J.Org.Chem.,2011,76 (11):4489-4505
[10]WANG Cui-Ping(王红萍),CUI Ai-Jun(崔爱军),TIAN Mao-Zhong(田茂忠),et al.Contemp.Chem.Ind.(当代化工), 2007,36(2):198-201
[11]Karolin J,Johansson L B A,Strandberg L.J.Am.Chem. Soc.,1994,116(17):7801-7806
[12]Ulrich G,Ziessel R,Harriman A.Angew.Chem.Int.Ed., 2008,47(7):1184-1201
[13]Loudet A,Burgess K.Chem.Rev.,2007,107(11):4891-4932
[14]Gabe Y,Urano Y,Kikuchi K,et al.J.Am.Chem.Soc., 2004,126(10):3357-3367
[15]Wang Y W,Descalzo A B,Shen Z,et al.Chem.Eur.J., 2010,16(9):2887-2903
[16]Rurack K,Kollmannsberger M,Daub J.Angew.Chem.Int. Ed.,2001,40(2):385-387
[17]Yu C J,Xu Y J,Jiao L J,et al.Chem.Eur.J.,2012,18(21): 6437-6442
[18]Ono N,Yamamoto T,Shimada N,et al.Heterocycles,2003, 61(1):433-447
[19]Shen Z,Rhr H,Rurack K,et al.Chem.Eur.J.,2004,10(19): 4853-4871
[20]Uppal T,Hu X K,Fronczek F R,et al.Chem.Eur.J.,2012, 18(13):3893-3905
[21]Descalzo A B,Xu H J,Xue Z L,et al.Org.Lett.,2008,10 (8):1581-1584
[22]Okujima T,Tomimori Y,Nakamura J,et al.Tetrahedron, 2010,66(34):6895-6900
[23]Nakamura M,Tahara H,Takahashi K,et al.Org.Biomol. Chem.,2012,10(34):6840-6849
[24]Nakamura M,Kitatsuka M,Takahashi K,et al.Org.Biomol. Chem.,2014,12(8):1309-1317
[25]Deniz E,Isbasar G C,Bozdemir A,et al.Org.Lett.,2008,10 (16):3401-3403
[26]Lu J S,Fu H Y,Zhang Y G,et al.Angew.Chem.Int.Ed., 2011,50(49):11658-11662
[27]Olivier J H,Widmaier J,Ziessel R.Chem.Eur.J.,2011,17 (42):11709-11714
[28]Ziessel R,Rihn S,Harriman A.Chem.Eur.J.,2010,16(39): 11942-11953
[29]Zhao Y,Zhang Y,Lü X,et al.J.Mater.Chem.,2011,21(35): 13168-13171
[30]Shandura M P,Yakubovskyi V P,Gerasov A O,et al.Eur. J.Org.Chem.,2012,9:1825-1834
[31]He H,Lo P C,Yeung S L,et al.J.Med.Chem.,2011,54(8): 3097-3102
[32]Zhang D K,Wen Y G,Xiao Y,et al.Chem.Commun.,2008, 49:4777-4779
[33]Lai R Y,Bard A J.J.Phys.Chem.B,2003,107(21):5036-5042
[34]Zhang D K,Wang Y C,Xiao Y,et al.Tetrahedron,2009,65 (39):8099-8103
[35]Xiao Y,Zhang D K,Qian X H,et al.Chem.Commun., 2011,47:11513-11515
[36]Lu H,Wang Q H,Gai L Z,et al.Chem.Eur.J.,2012,18 (25):7852-7861
[37]Lin H Y,Huang W C,Chen Y C,et al.Chem.Commun., 2012,48:8913-8915
[38]Fu G L,Pan H,Zhao Y H,et al.Org.Biomol.Chem.,2011, 9(23):8141-8146
[39]Umezawa K,Nakamura Y,Makino H,et al.J.Am.Chem. Soc.,2008,130(5):1550-1551
[40]Umezawa K,Matsui A,Nakamura Y,et al.Chem.Eur.J., 2009,15(5):1096-1106
[41]Wang H,Zeng J.Can.J.Chem.,2009,87(9):1209-1212
[42]Awuah S G,Polreis J,Biradar V,et al.Org.Lett.,2011,13 (15):3884-3887
[43]Matsui A,Umezawa K,Shindo Y,et al.Chem.Commun., 2011,47:10407-10409
[44]Hayashi Y,Obata N,Tamaru M,et al.Org.Lett.,2012,14 (3):866-869
[45]Yang Y C,Guo Q L,Chen H C,et al.Chem.Commun., 2013,49:3940-3942
[46]Yakubovskyi V P,Shandura M P,Kovtun Y P.Eur.J.Org. Chem.,2009,19:3237-3243
[47]Jiao C,Huang K W,Wu J.Org.Lett.,2011,13(4):632-635
[48]Jiao C,Zhu L,Wu J.Chem.Eur.J.,2011,17(24):6610-6614
[49]Zeng L,Jiao C,Huang X,et al.Org.Lett.,2011,13(22):6026-6029
[50]Killoran J,Allen L,Gallagher J F,et al.Chem.Commun., 2002,17:1862-1863
[51]Byrne A T,OConnor A E,Hall M,et al.Br.J.Cancer,2009, 101:1565-1573
[52]Zhao W,Carreira E M.Angew.Chem.Int.Ed.,2005,44(11): 1677-1679
[53]Zhang X,Yu H,Xiao Y.J.Org.Chem.,2012,77(1):669-673
[54]Gresser R,Hartmann H,Wrackmeyer M,et al.Tetrahedron, 2011,67(37):7148-7155
[55]Donyagina V F,Shimizu S,Kobayashi N,et al.Tetrahedron Lett.,2008,49(42):6152-6154
[56]Gresser R,Hummert M,Hartmann H,et al.Chem.Eur.J., 2011,17(10):2939-2947
[57]Lu H,Shimizu S,Mack J,et al.Chem.Asian J.,2011,6(4): 1026-1037
[58]Adarsh N,Shanmugasundaram M,Avirah R R,et al.Chem. Eur.J.,2012,18(40):12655-12662
Progress on Near-infrared Fluorescent BODIPY Dyes
SUN Dan1YUAN Xue-Mei1XU Hai-Jun*,1,2XU Li3SHEN Zhen*,2
(1College of Chemical Engineering,Jiangsu Key Lab of Biomass-based Green Fuels and Chemicals,Nanjing Forestry University,Nanjing 210037,China) (2State Key Laboratory of Coordination Chemistry,Nanjing University,Nanjing 210093,China) (3Advanced Analysis and Testing Center,Nanjing Forestry University,Nanjing 210037,China)
Near-infrared(NIR)fluorescent dyes based-on boron difluoride dipyrromethene(BODIPY)are a new type of fluorescent dyes,which have been widely studied because of their excellent photophysical and photochemical properties and have become a newly-emerging hotspot in recent years.In this review article,we summarize the latest research progresses in the design,synthesis and application of near-infrared fluorescent BODIPYs,in addition their future research aspects and application perspectives are also prospected.
boron dipyrromethene;near-infrared(NIR);fluorescent dyes;photoelectric functional materials
O613.8+1;O641.4
A
1001-4861(2015)08-1467-13
10.11862/CJIC.2015.209
2015-02-21。收修改稿日期:2015-05-21。
国家自然科学基金(No.21301092,21371090)、霍英东教育基金会(No.141030)、江苏省自然科学基金(No.BK20130054)、江苏省生物质绿色燃料与化学品重点实验室开放基金(No.JSBGFC12002)、江苏高校优势学科建设工程资助项目。
*通讯联系人。E-mail:zshen@nju.edu.cn;xuhaijun_jx@163.com;会员登记号:S06N892M1305。
