细胞色素C与NO的反应机制
2015-12-05唐乾史珊珊曹洪玉郭相金张涛郑学仿
唐乾 史珊珊 曹洪玉 郭相金 张涛 郑学仿*,
(1大连大学生命科学与技术学院,大连116622)
(2辽宁省生物有机化学重点实验室,大连大学,大连116622)
细胞色素C与NO的反应机制
唐乾1,2史珊珊1,2曹洪玉1,2郭相金2张涛1郑学仿*,1,2
(1大连大学生命科学与技术学院,大连116622)
(2辽宁省生物有机化学重点实验室,大连大学,大连116622)
细胞色素C(Cytochrome C,Cyt C)与NO(由NO供体药物proliNONOate提供)之间的反应已在电化学和医疗方面受到重视,而直接与NO气体作用尚未得到关注;且前者主要是从Q带进行分析的,Soret带未提及。本文采用紫外-可见(UV-Vis)吸收光谱、电子顺磁共振(EPR)光谱、紫外可见时间过程光谱以及同步荧光光谱等方法同时分析了其Soret带与Q带的变化,探讨了不同价态的Cyt C与NO气体结合及解离反应的过程。结果表明:Cyt C与NO相互作用时,无论是高铁细胞色素C(ferric cytochrome C,Fe(Ⅱ)-Cyt C)还是亚铁细胞色素C(ferrous cytochrome C,Fe(Ⅱ)-Cyt C),反应产物都是细胞色素C配合物(Cyt C-NO);Fe(Ⅱ)-Cyt C先被NO氧化生成Fe(Ⅱ)-Cyt C,之后再与NO结合生成Cyt C-NO,Fe(Ⅱ)-Cyt C则直接与NO结合生成Cyt C-NO。Cyt C-NO是一种不稳定的配合物,当通入少量NO时Cyt C-NO很快解离生成Fe(Ⅱ)-Cyt C,其解离速率为(0.005 07±0.001)s-1,是与供体药物结合所形成配合物解离速率的十分之一;NO过量时,生成的Cyt C-NO不会再发生解离。对实验结果分析,得出Cyt C与NO配位反应机制为溶液中的NO进入Heme腔内,Fe-S断裂,Fe-N间形成新的配位键,NO气体可以直接与Cyt C反应,生成的配合物比供体药物稳定,同时Soret带具有明显变化。这对于利用NO来缓解细胞内的氧化压以及利用NO检测细胞内呼吸类酶的变化,进而检测细胞凋亡具有重要意义。
细胞色素C;NO气体;光谱法;配位反应;解离
0引言
血红素蛋白与生物活性小分子的配位反应广泛存在于生命体中,例如二价血红素铁蛋白可逆结合氧气来完成储存和运输氧气[1-3]功能,二价和三价血红素蛋白均可与信使分子NO配位[4-5]完成各种生理功能,因此,血红素蛋白与生物活性小分子的配位反应研究备受关注。细胞色素C(Cyt C)是C型血红素蛋白,在呼吸链中将电子由复合物Ⅲ(细胞色素bc1复合物)传递到复合物Ⅳ(细胞色素C氧化酶)[6],使氧气还原为水[7]。最近发现Cyt C与细胞程序性死亡[8]、细胞氧化压力、亚硝基硫醇的形成[9]、过氧硝酸盐作用的靶向物质、脂肪酸酰胺的生物合成等有关。另外Cyt C还具有亚硝酸还原酶活性,在低氧和硝酸压力下生成五配位Cyt C,使其具有明显的亚硝酸还原酶活性,可以将亚硝酸盐还原生成NO,后者作为细胞凋亡的信号分子[10]。
NO分子一直受到高度关注,是许多生物系统中关键性细胞信号分子,控制和调节各种不同生理过程,包括控制血压,松弛肌肉,血小板聚集,神经递质传递,免疫反应等[11]。NO作为一个活性配体,既可以与高铁血红素结合也可以与亚铁血红素结合,氧合血红蛋白与NO结合可以形成亚硝基硫醇化合物,氧合亚铁肌红蛋白与NO反应生成氧合高铁肌红蛋白与硝酸盐[12-14]。Kruqlik等[15]利用皮秒时间分辨拉曼光谱和飞秒吸收光谱研究了NO与肌红蛋白反应对血红素辅基结构的影响,发现NO与肌红蛋白的结合会抑制其血红素辅基结构的变化,而当NO光解后其血红素辅基又会由平坦结构恢复至圆顶形结构。
Sharper等[16]已报道Cyt C与NO之间的相互作用情况,研究了在生理条件下NO在线粒体内的代谢机制,线粒体内过多的NO可以与膜蛋白反应,从而抑制其与细胞色素C氧化酶结合,破坏呼吸作用,生成的NO-与氧气结合会生成过氧硝酸盐;2011年,Silkstone等[17]发现NO与Cyt C反应时NO先与O2反应生成NO2+,然后Fe(Ⅱ)-Cyt C再与之反应生成Fe(Ⅱ)-Cyt C和NO2-,最后生成Cyt C-NO。而当NO加入野生型高铁细胞色素C(Fe(Ⅱ)-Cyt C)中时,也可以快速的形成Cyt C-NO配合物[18],心磷脂可以使Cyt C中的血红素铁由六配位变成五配位,形成与高铁肌红蛋白类似的结构[19-21],五配位的Cyt C可以与NO反应,其反应机制与高铁肌红蛋白相似。
以上研究均是用NO供体药物(proliNONOate)代替NO进行实验,而直接与NO气体的反应尚未受到关注。而且其研究主要集中在Q带,关于Soret带的变化未提及,根据Gouterman的四轨道模型,Cyt C分子Soret带是由卟啉中的电子跃迁产生的,其归属与π-π*跃迁的第二激发态,对于检测血红素卟啉的变化具有重要意义。本文通过UV-Vis吸收光谱、电子顺磁共振光谱、紫外可见时间过程光谱、同步荧光光谱等技术同时从Soret带及Q带研究了不同价态的Cyt C与NO的结合与解离反应,发现六配位的Cyt C可直接与NO气体反应,其反应产物为Cyt C-NO。根据实验数据我们从分子水平上分析了Cyt C与NO的配位反应机理。
1实验部分
1.1 试剂与仪器
马心细胞色素C(Cyt C)样品(美国Sigma公司,〉99%),使用时用Na2HPO4-NaH2PO4缓冲溶液(PB缓冲液)配制成浓度为1×10-5mol·L-1的溶液(避光4℃保存并尽快用于实验);连二亚硫酸钠(0.5 mol·L-1);过氧化氢(0.01 mol·L-1,H2O2);亚硝酸钠(5 mol·L-1,上海生物工程公司);浓硝酸(HNO3)(稀释为0.01、0.025、0.05、0.1、0.16、0.2、0.5、1.15 mol·L-1);均为国产分析纯;实验用水均为超纯水。NO气体(大连光辉气体有限公司,高纯一氧化氮,〉99%)。V-560型UV-Vis分光光度计(日本Jasco公司)、FP-6500型荧光分光光度计(日本Jasco公司)、电子顺磁共振波谱仪(德国Bruker公司)、F-12型制冷和加热循环器(德国Julabo公司)、实验室pH计(PHSJ-4A,上海雷磁分析仪器厂)。
1.2 实验方法
1.2.1 Fe(Ⅱ)-Cyt C与Fe(Ⅱ)-Cyt C的制备
野生型细胞色素C(Cyt C)用0.05 mol·L-1PB缓冲液配制成1×10-5mol·L-1的样品溶液,取2 mL Cyt C溶液于比色皿内,用微量注射器逐次加入定量的0.5 mol·L-1的连二亚硫酸钠溶液(制备亚铁细胞色素C,实验过程通N230 min,将其O2排出),过量的连二亚硫酸钠对亚硝酸盐没有影响[22],同时检测其紫外吸收光谱(415、520及549 nm处的吸收强度)[23]。测定条件:狭缝宽度为2 nm,扫描波长为220~700 nm,扫描速率为400 nm·min-1,响应时间中等。同样的方法用H2O2制备高铁细胞色素C(检测其在409、530 nm处的紫外吸收光谱)[23]。
1.2.2 样品前期处理
将Cyt C溶解在磷酸盐缓冲液中,蛋白的最终浓度达到1×10-5mol·L-1;取样品分别通入NO,通气速率为每分钟100个气泡,时间为2 min;Fe(Ⅱ)-Cyt C与Fe(Ⅱ)-Cyt C处理同上,所得样品用于UV-Vis吸收光谱、时间过程光谱和同步荧光光谱测定。
将Cyt C溶解在磷酸盐缓冲液中,终浓度为1× 10-4mol·L-1;分别制备没有通入NO气体、通入NO气体1 min、通入NO气体2 min、以及通入NO气体2 min后放置30 min的样品各200 μL放置在液氮中,所得样品用于电子顺磁共振谱测定。
1.2.3 UV-Vis吸收光谱
将已处理的Cyt C(WT)、Fe(Ⅱ)-Cyt C和Fe(Ⅱ)-Cyt C样品置于1 cm石英比色皿中进行测定,测定条件为:狭缝宽度为2 nm,扫描波长范围220~700 nm,扫描速率400 nm·min-1,响应时间中等。
1.2.4 紫外可见时间过程光谱
将已处理的Cyt C(WT)、Fe(Ⅱ)-Cyt C和Fe(Ⅱ)-Cyt C样品置于1 cm石英比色皿中进行测定,测定条件为:狭缝宽度为2 nm,固定波长为416、562 nm,灵敏度高,响应时间为2 s。
1.2.5 同步荧光光谱
将已处理的Cyt C(WT)、Fe(Ⅱ)-Cyt C和Fe(Ⅱ)-Cyt C样品置于1 cm石英比色皿中进行测定,测定条件为:激发狭缝与发射狭缝分别为3和5 nm,扫描速率为500 nm·min-1,响应时间为0.5 s,检测器灵敏度为中等,控制温度为(20±0.01)℃。
1.2.6 电子顺磁共振谱
将液氮中的样品管垂直放入凹槽内使其底部与里面的基架接触再进行检测,测定条件为:9.33 GHz,6-G,10.2 mW,时间常量40.96 ms,扫描速度83.97 s,扫描范围2 900~3 900 G,温度100 K,扫描次数20次。
2结果与讨论
2.1 Fe(Ⅱ)-Cyt C与NO的反应过程
Fe(Ⅱ)-Cyt C在415 nm(Soret带)、520、549 nm(Q带)和314 nm(δ带)处有最大吸收峰[22],而光谱检测得到Cyt C在360 nm(δ带)、409.5 nm(Soret带)、522.5、527.5和549 nm(Q带)处均有吸收峰,说明Cyt C同时存在氧化态与还原态,实验所用Fe(Ⅱ)-Cyt C(全部排出O2)由连二亚硫酸钠还原得到。向Fe(Ⅱ)-Cyt C溶液中通入不同量的NO气体,随着气体量增加,Fe(Ⅱ)-Cyt C样品的UV-Vis吸收光谱变化如图1所示。由图1可知,在415 nm处Soret吸收带先蓝移到409 nm,随着NO继续增加又红移到416 nm;520 nm处Q带红移到530 nm,同时549 nm处特征吸收峰消失,在562 nm出现新的特征吸收峰,其Q带的变化与Sharpe等[16]报道的Fe(Ⅱ)-Cyt C与NO结合的吸收光谱相同,同时soret带也出现了其特征吸收峰。NO进入溶液中暂以NO分子形式存在,具有较强的氧化性,而Fe(Ⅱ)-Cyt C本身具有还原性,直接被氧化生成Fe(Ⅱ)-Cyt C,使得415 nm处Soret吸收带蓝移到409、520 nm处Q带红移到530、549 nm处特征峰消失,同时产生NO-,此时停止通NO,放置一段时间后其光谱没有变化,继续通NO,NO进入溶液中以NO·存在,具有较强的亲电作用,改变了血红素周围微环境,使得Fe-S变弱,NO进攻Fe-S,N取代S与Fe配位,生成Cyt C-NO,因此Soret的峰红移到416 nm、Q带在562 nm处出现新的特征吸收峰。在整个反应过程中,Fe(II)-Cyt C直接生成Fe(Ⅱ)-Cyt C,其不能与NO反应生成配合物,与Fe(Ⅱ)-Cyt C反应的NO为通入的过量的NO,因此只有Fe(Ⅱ)-Cyt C可以与NO进行配位反应。
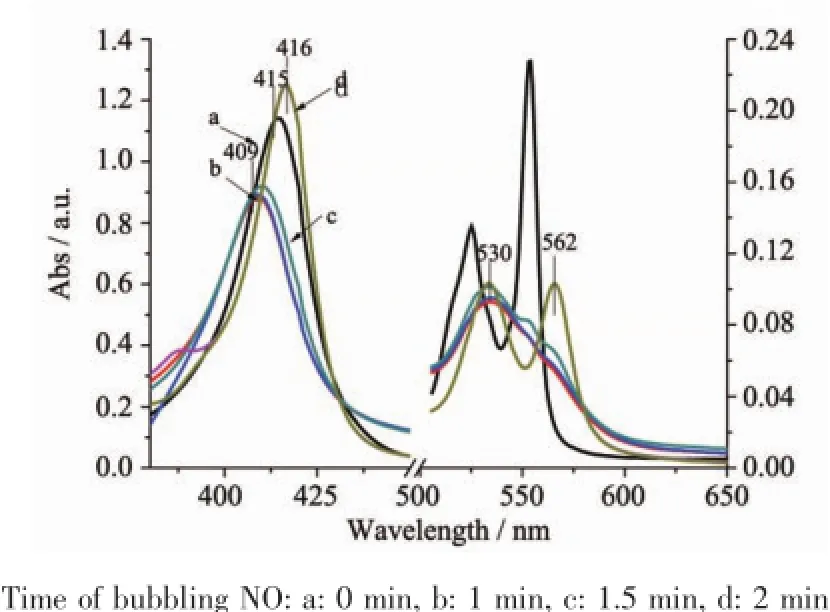
图1 Fe(Ⅱ)-Cyt C与NO反应的紫外吸收光谱Fig.1 UV-Vis absorbance spectra of the reaction of Fe(Ⅱ)-Cyt C with NO
2.2 Fe(Ⅱ)-Cyt C与NO的反应过程
Fe(Ⅱ)-Cyt C溶液在409 nm(Soret带)、529 nm(Q带)和360 nm(δ带)处有特征吸收峰[22],实验所用Fe(Ⅱ)-Cyt C是由H2O2氧化得到。由图2可知,Fe(Ⅱ)-Cyt C与NO反应的最终现象与Fe(Ⅱ)-Cyt C相同,Soret带峰红移到416 nm、Q带在562 nm处出现新的特征吸收峰,生成的都是Cyt C-NO。上述结果表明,NO主要是与Fe(Ⅱ)-Cyt C结合,Fe(Ⅱ)-Cyt C中血红素铁是六配位结构,其第6个是与甲硫氨酸(Met)的硫形成配位键,NO进入溶液中以NO·存在,具有较强的亲电作用,改变了血红素周围微环境,使得Fe-S变弱,NO进攻Fe-S,N取代S与Fe配位,生成Cyt C-NO,但该类化合物并不稳定[24],其受到NO浓度的调节,在695 nm处小的吸收峰是Met80与血红素Heme中心三价铁的电荷转移峰,即Met80与血红素Heme配位的特征峰[25-26],图3为Cyt C通NO前后Met80与血红素Heme配位的特征吸收峰,由图3可知,在没有通气前Cyt C在695 nm处有明显的特征吸收峰,通入NO后695 nm处吸收峰消失。由此可知,NO进入Cyt C溶液后,Met80与血红素Heme中心铁不再配位,铁周围电子分布发生变化,溶液中NO易进入Heme腔内,与Fe形成新的配位键如图示1所示。在整个反应过程中生成的Cyt C-NO中Cyt C均是以Fe(Ⅱ)-Cyt C存在。

图2 Fe(Ⅱ)-Cyt C与NO反应的紫外吸收光谱Fig.2 UV-Vis absorbance spectra of the reaction of Fe(Ⅱ)-Cyt C with NO

图3 Cyt C中Fe-S键的紫外吸收光谱变化Fig.3 UV-Vis absorbance spectra changes of Fe-S in Cyt C
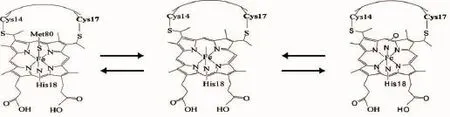
图式1细胞色素C中Fe-S的变化过程Scheme 1Course of the changes about Fe-S in Cyt c
2.3 Cyt C与NO相互作用的电子顺磁共振谱
EPR是由不配对电子的磁矩发源的一种磁共振技术,可用于从定性和定量方面检测物质原子或分子中所含的不配对电子,并探索其周围环境的结构特性[27]。Cyt C与NO相互作用的电子顺磁共振谱如图4所示,图4A为Cyt C中没有通入NO时的EPR谱,其没有顺磁信号产生,图4B/C是通入NO的量逐渐增多的EPR谱,其中图B通气1 min,图C通气2 min,在3 210、3 355和3 385G有明显的顺磁信号产生,说明Cyt C中的血红素Fe在与NO进行配位反应过程中生成了新的配合物,图4D为图4C放置长时间(30 min)后测得的EPR谱,其产生的顺磁信号消失。这与Basu等[10]所得的结果相同,Cyt C中通入NO气体后与之反应生成新的配合物,然而Basu[10]、Kapralov等[28]认为只有加入脂质体或心磷脂等能够使其由六配位变成五配位结构的物质后Cyt C才可以与NO反应,本实验证明在没有加入其它物质的情况下,Cyt C可以直接与NO进行配位反应,生成一种不稳定的配合物Cyt C-NO,其会发生解离,这与紫外、荧光中通少量NO气体所得实验结论是一致的。

图4 Cyt C与不同量NO相互作用及解离的电子顺磁共振光谱Fig.4 Electron Paramagnetic Resonance(EPR)Spectra of Cyt c reacting with different amounts of NO and their dissociation process
2.4 硝酸(HNO3)及亚硝酸钠(NaNO2)对Cyt C的影响
NO通入Cyt C溶液时,会有部分被氧化生成NO2-,进入溶液后,NO2-继续被氧化生成NO3-[29],在没有进行排氧的Cyt C溶液中NO会被氧化,溶液中存在NO3-、NO2-、H+离子均有可能与Cyt C进行反应,为排除这些离子的影响,本文进行了不同浓度的HNO3以及不同pH的NaNO2与Cyt C反应的实验。
图5中,随HNO3浓度的增加,Cyt c在409 nm处Soret带吸收波长逐渐蓝移且吸收强度增大,530 nm处Q带吸收峰变化不明显,549 nm处特征峰逐渐消失,但随着HNO3浓度的继续增加,其Q带的所有特征吸收峰消失,且吸收强度下降,同时在300 nm处出现了NO3-的特征吸收峰[30],由以上结果可知,低浓度HNO3可以将还原态的Cyt C氧化,高浓度的HNO3会破坏Cyt C的结构,而不会与之发生配位反应,HNO3本身既是一种强酸又是强氧化剂,因此一开始当HNO3浓度很低时对Cyt C的影响较小,只是将其中还原态Cyt C氧化,随着HNO3浓度的增加,Cyt C结构逐渐被破坏,血红素中卟啉环暴露,因此Soret带的吸收波长发生蓝移,同时强度增大,Q带特征吸收峰消失。

图5 Cyt C与不同浓度的HNO3相互作用的紫外吸收光谱Fig.5 UV-Vis absorbance spectra of Cyt C interacted with different concentrations of HNO3
Cyt C与NaNO2相互作用的光谱如图6所示,随NaNO2量的增加,Soret带的特征吸收峰基本没有变化,Q带530 nm处的吸收强度有微弱变化,而549 nm处特征峰消失,所以NaNO2只是将Cyt C溶液中还原态Cyt C氧化,而没有与之发生配位反应,已有文献报道,Cyt C本身具有亚硝酸还原酶活性[10],因此NaNO2与Cyt C之间只是发生了氧化还原反应,并没有发生配位反应。实验中所用的NaNO2的浓度为0.03~0.17 mol·L-1,此处只列出pH=7.4的光谱图,pH=3、5.8的结果与之相同未列出。因此和不会影响Cyt C与NO的反应。

图6 Cyt C中加入不同量NaNO2后的紫外吸收光谱变化Fig.6 UV-Vis absorbance spectra changes of Cyt C with different amount of NaNO2
2.5 细胞色素C-NO配合物(Cyt C-NO)的解离
通入一定量NO气体后,Fe(Ⅱ)-Cyt C和Fe(Ⅱ)-Cyt C均会生成Cyt C-NO,在416 nm(Soret带)、530 nm、562 nm(Q带)出现特征吸收峰,由于生成的配合物并不稳定,随时间延长逐渐发生解离,由图7A可知随时间变化Cyt C-NO逐渐解离为Fe(Ⅱ)-Cyt C。Orii等[31]已经证明当pH值在8~10之间时,Fe(Ⅱ)-Cyt C与NO反应生成Fe(Ⅱ)-Cyt C-NO后先被还原为Fe(Ⅱ)-Cyt C-NO和NO+,最终解离为Fe(Ⅱ)-Cyt C与NO+。图7A为通NO 1.5 min,在10 min内的解离光谱,随时间增加Q带562 nm处的吸收峰逐渐消失,529 nm峰位置红移到530 nm,Soret带由413 nm下降并蓝移到409 nm。图7B为通气2.5 min,4 h及20 h后的解离光谱,随时间变化光谱基本没有发生变化。Cyt C与NO反应主要是在Fe(Ⅱ)-Cyt C下进行,与NO结合后生成Cyt C-NO,不稳定而自身发生解离,生成Fe(Ⅱ)-Cyt C,可以调节生物体内NO的量,而当通NO过量时,溶液中的NO·过量,生成大量的NO-,破坏该反应的平衡,使得反应生成的Fe(Ⅱ)-Cyt C-NO不变,因此当通入过量NO时,Cyt CNO未发生解离。图8 A1、A2为通NO 2 min后Cyt C-NO在Soret带416 nm以及Q带562 nm处时间变化的光谱图,图8B1、B2为通NO 2.5 min后Cyt C-NO在Soret带416 nm以及Q带562 nm处的时间变化的光谱图。由图可知当通入的NO气体较少时,Cyt C与NO之间的反应是一个可逆的过程,Cyt C与NO的反应产物随时间逐渐解离,一定时间以后达到稳定(500~1 000 s内),说明反应所生成的Cyt C-NO是一种不稳定的配合物,NO过量时,Cyt CNO不再发生解离。因此适当浓度的NO对调节Cyt C的生理作用非常重要。
对Cyt C-NO的时间解离曲线进行拟合发现该曲线符合方程(1),结果如表1所示:


图7 通不同量NO的CytC-NO随时间的解离光谱Fig.7 Dissociation spectra of CytC-NO with different amounts of NO by time

图8 通不同量NO的Cyt C-NO的时间过程光谱Fig.8 Time course spectra of Cyt C-NO with different amounts of NO

表1 Cyt C-NO的解离速率常数及相关参数Table1 Dissociation rate constants and the related parameters of Cyt C-NO
其中y为固定波长下的紫外吸收强度,t为反应时间,A为振幅,k为解离速率常数,y0为截距。因此随时间变化Cyt C-NO的解离过程属于一级反应,Soret带的k值为0.005 07 s-1,Q带的k值为0.003 97 s-1,两谱峰所计算的k值接近,其相关系数R分别为0.978 26、0.990 2,均接近1,排除实验中一些外界因素的影响,结果在误差允许范围内,说明Cyt C-NO的解离曲线符合上述方程。而其解离速率较供体药物((0.087±0.054)s-1)慢,仅是其十分之一,说明NO气体与Cyt C形成的配合物更稳定。而改变外界条件,如离子强度、温度、pH值、缓冲溶液、粘性剂以及光照等,均会影响Cyt C与NO的结合及解离速率。随离子强度增大,其反应速率下降;温度、pH变化会影响Cyt C的二级结构[32],从而影响NO与Cyt C的结合速率;而光照会促进Cyt C-NO解离等,其具体影响机制,在今后的文章中会有详细阐述。
2.6 Cyt C与NO反应的同步荧光光谱
Cyt C分子含有1个色氨酸残基和4个酪氨酸残基,选择合适的Δλ可得到酪氨酸和色氨酸残基的特征性同步荧光光谱[33],Δλ=20 nm时,Cyt C的荧光光谱只出现酪氨酸的荧光峰,Δλ=80 nm或60 nm时只出现色氨酸的荧光峰[34],本实验通过对比发现在Δλ=60 nm时得到的荧光图谱较明显,因此实验中色氨酸的同步荧光光谱均是在Δλ=60 nm的条件下得到的。Cyt C酪氨酸与色氨酸的同步荧光光谱如图9A/B。由图9A可知,Cyt C在305和460 nm有明显的荧光峰,305 nm是其酪氨酸的同步荧光峰,而460 nm处是其卟啉环的同步荧光峰。随NO通入量的增加,305 nm处的荧光峰强度逐渐下降,460 nm处的强度逐渐上升,同时在394 nm附近出现了一个新的荧光峰。Cyt C中的血红素卟啉环上的Fe原子与Met80中的S和His中的N相连接,它的血红素基团由数个赖氨酸残基形成环状,这些赖氨酸的ε-氨基带有正电荷,对其侧链中的酪氨酸造成荧光猝灭,而且酪氨酸67苯环上的羟基被认为同Met80的S有氢键形成,对维持Met80与Heme的配位起着重要的作用[35],当NO进入Cyt C溶液后破坏了Heme所在腔的极性环境,Met80与Heme相连的铁硫键断裂,使得Heme暴露程度增加,促进酪氨酸的荧光猝灭,因此随着NO量增加使得酪氨酸在305 nm处的荧光强度逐渐减小,而460 nm处荧光强度逐渐增大,这与前面紫外吸收光谱中Soret带变化一致,新荧光峰的出现与前面Q带变化一致。由图9B可知,Cyt C在344和444 nm处有荧光峰,344 nm是其色氨酸的同步荧光峰,444 nm处是其卟啉环的同步荧光峰。随NO的通入,344 nm处发射波长蓝移至337 nm,且强度下降,而444 nm红移到446 nm强度上升。Cyt C中只含有一个色氨酸残基,位于第59位,并以氢键方式与血红素相键合,因而色氨酸残基的最大发射峰的位移直接反映了血红素对溶剂的暴露程度,当NO通入Cyt C溶液后,与其相互作用,改变了其周围环境,Cyt C中血红素暴露程度增强,色氨酸残基最大发射峰发生蓝移,而444 nm处发射峰也与前文中紫外吸收光谱中的Soret带变化是一致的。酪氨酸与色氨酸的同步荧光光谱的变化说明Cyt C与NO进行了配位反应。

图9 Cyt C的同步荧光光谱Fig.9 Synchronous fluorescence spectra of Cyt C

图示2Cyt C与NO的反应过程Scheme 2Reaction course of Cyt C with NO
3结论
本文采用光谱法研究不同价态Cyt C与NO气体之间的相互作用,其可能存在的配位有3种:(1) NO进攻铁硫键,使其断裂后,与之结合生成Cyt CNO;(2)NO进入溶液后生成硝酸根离子,再与Cyt C结合,生成Cyt C-NO;(3)NO进入溶液后生成亚硝酸根离子(NO2-),再与Cyt C结合生成Cyt C-NO;最终通过实验证明只能是第一种途径,结果同时显示NO气体与供药物的反应过程基本相同:Fe(Ⅱ)-Cyt C与NO反应先生成Fe(Ⅱ)-Cyt C,之后再与NO反应生成Fe(Ⅱ)-Cyt C-NO,Fe(Ⅱ)-Cyt C-NO在没有其他还原剂存在的情况下,会逐步解离为Fe(Ⅱ)-Cyt C。NO气体可以直接与Cyt C结合,所生成的配合物解离速率仅是供体药物的十分之一,对于有效的利用NO具有重要的参考意义。NO过量会破坏溶液的平衡使反应向生成Fe(Ⅱ)-Cyt C-NO方向进行,不再发生解离。Cyt C与NO之间的具体配位反应机制为:NO进入溶液以NO·形式存在,使Cyt C周围的微环境发生变化,进入到Heme腔中改变其电子分布,增大了Met80与Heme之间的距离,使其相互作用减弱,Met与Heme之间的配位键改变,分子间发生重排,其中心Fe与NO形成新配位键,但所形成的Fe-N键不稳定,当NO量较少时,随时间变化又会断裂,再次生成五配位Fe,可以与溶液中的自由基团结合,最终达到一个平衡,当不断通入NO时,所形成的配位键不再发生断裂,破坏了其达到的平衡。呼吸作用在人类生命活动中必不可少,NO气体无色无味的,容易被吸入,通过研究该反应机制,为今后研究其它血红素类蛋白与NO及其它气体(CO)之间的相互作用提供参考依据,同时在医学上治疗NO中毒以及合理利用NO提供支持。
[1]Wittenberg B.J.Physiol.Rev.,1970,50(4):559-636
[2]Hills B A.Science,1973,182(4114):823-825
[3]Cassina A M,Hodara R,Souza J M,et al.J.Biol.Chem., 2000,275(28):21409-21415
[4]Soldatova A V,Ibrahim M,Olson J S,et al.J.Am.Chem. Soc.,2010,132(13):4614-4625
[5]Rong Z,Cooper C E.Adv.Exp.Med.Biol.,2013,789:361-368 [6]Larson S K,Dwyer D S,Lo H H,et al.Biochem.Biophys. Res.Commun.,2006,342(3):991-995
[7]Godoy L C,Munoz-Pinedo C,Castro L,et al.PNAS USA, 2009,106(8):2653-2658
[8]Kanokwiroon K,Chatpun S.J.Asian Trans.Sci.,2014,8(2): 100-104
[9]Basu S,Keszler A,Azarova N A,et al.Free Radical Biol. Med.,2010,48(2):255-263
[10]Basu S,Azarova N A,Font M D,et al.J.Biol.Chem., 2008,283(47):32590-32597
[11]Jaeheung Park T L,Manho L.J.Phys.Chem.B,2013: 12039-12050
[12]Herold S,Exner M,Nauser T.Biochemistry,2001,40(11): 3385-3395
[13]Yukl E T,Vries S,Moënne-Loccoz P.J.Am.Chem.Soc., 2009,131(21):7234-7235
[14]Gow A J,Luchsinger B P,Pawloski J R,et al.PNAS USA, 1999,96(16):9027-9032
[15]Kruglik S G,Yoo B K,Franzen S,et al.PNAS USA,2010, 107(31):13678-13683
[16]Sharpe M A,Cooper C E.Biochem.J.,1998,332(1):9-19
[17]Silkstone R S,Mason M G,Nicholls P,et al.Radical Bio. Med.,2012,52(1):80-87
[18]Kim J,Park J,Lee T,et al.J.Phy.Chem.B,2012,116(46): 13663-13671
[19]Jitkaew S,Witasp E,Zhang S,et al.J.Leukocyte Biol., 2009,85(3):427-437
[20]Kagan V E,Bayir A,Bayir H,et al.Mol.Nutr.Food.Res., 2009,53(1):104-114
[21]Kagan V E,Bayir H A,Belikova N A,et al.Free Radical Biol.Med.,2009,46(11):1439-1453
[22]Grubina R,Basu S,Tiso M,et al.J.Biol.Chem.,2008,283 (6):3628-3638
[23]Margoliash E,Frohwirt N.J.Biochem.,1959,71(3):570-572
[24]Zhao X J,Sampath V,Caughey W S.Biochem.Biophys. Res.Commun,1994,204(2):537-543
[25]Gray A L,Raphael A L.Proc.Struct.Funct.Genet.,1989,6 (3):338-340
[26]Stellwagen E,Cass R.Biochem.Biophys.Res.Commun, 1974,60(1):371-375
[27]WANG Cui-Ping(王翠平),YE Liu(叶柳),XIE Jian-An (谢建安),et al.Res.Explor.Lab.(实验室研究与探索), 2013,32(5):5-7
[28]Kapralov A A,Kurnikov I V,Vlasova I I,et al.Biochem., 2007,49(46):14232-14244
[29]Smagghe B J,Trent J T,et al.PLoS One,2008,3(4):1-10
[30]Jayakumari N R,Reghuvaran A C,et al.Biol.Chem.,2014, 08(2):35-44
[31]Orii Y,Shimada H.J.Biochem.,1978,84(6):1543-1552
[32]Balakrishnan G,Hu Y,Oyerinde O F,et al.J.Am.Chem. Soc.,2007,129(3):504-505
[33]JIAN Ju(剑菊),QU Xiao-Gang(曲小刚),LU Tian-Hong (陆天红),et al.Chem.J.Chinese Universities(高等学校化学学报),1995,16(8):1270-1274
[34]George T,Doreen W S,English A M,et al.Biochemistry, 1998,37(7):2004-2016
[35]Takano T,Dickerson R E.J.Mol.Biol.,1981,153(1):95-115
Reaction Mechanism of Cytochrome C with NO
TANG Qian1,2SHI Shan-Shan1,2CAO Hong-Yu1,2GUO Xiang-Jin2ZHANG Tao1ZHENG Xue-Fang*,1,2
(1College of Life Science and Biotechnology,Dalian University,Dalian,Liaoning 116622,China)
(2Liaoning Key Laboratory of Bio-organic Chemistry,Dalian University,Dalian,Liaoning 116622,China)
The research of cytochrome C(Cyt C)reacting with NO donor drugs(proliNONOate)has been focused on electrochemistry and medical treatment,while the study about reacting with NO gas is ignored.The previous study usually concentrated on Q band changes,but the Soret band was hardly mentioned.In this paper,we studied the reaction of two states of Cyt C with NO gas and the dissociation process by Soret band and Q band spectra,using ultraviolet-visible absorption spectra,electron paramagnetic resonance(EPR)spectra,ultravioletvisible time course absorption spectra and synchronous fluorescence.The spectroscopic data showed that,ferric cytochrome C(Fe(Ⅱ)-Cyt C)and ferrous cytochrome C(Fe(Ⅱ)-Cyt C)could react with NO to convert to cytochrome C coordination compound(Cyt C-NO)with different mechanisms.Fe(Ⅱ)-Cyt C reacting with NO generated Fe(Ⅱ)-Cyt C firstly,then it combined with NO,while Fe(Ⅱ)-Cyt C can combine with NO directly.However,Cyt C-NO is not a stable coordinated macromolecule.With a small amount of NO bubbled into the sample,Cyt C-NO dissociated rapidly with rate constant value of(0.005 07±0.001)s-1,which is one-tenth of Cyt C-NO with NO donor drugs; while under excessive NO gas condition,the dissociation process was prevented.According to the experimentaldata,the coordination mechanism of the reaction between Cyt C and NO is that gas molecule gets access into the cavity of Heme,making the separation of Fe-S and the formation of Fe-N.Cyt C can react with NO gas directly, the Cyt C-NO is more stable than that reacted with NO donor drugs,and the Soret band have an obvious change. These results will be significant for us to remit the oxidative stress in cells and detect the respiratory enzymes change which could monitor the cell apoptosis and some diseases by NO.
cytochrome c;nitric oxide;spectrometry;coordination reaction;dissociation
O629.73;Q518.2
A
1001-4861(2015)08-1511-09
10.11862/CJIC.2015.216
2014-09-05。收修改稿日期:2015-05-07。
国家自然科学基金(No.21271036,20871024);辽宁省教育厅科学技术研究(No.L2013470,L2013471)资助项目。
*通讯联系人。E-mail:dlxfzheng@126.com
