奥沙利铂与卡铂治疗中晚期非小细胞肺癌的meta分析
2015-12-04杜习智赵成龙秦玉花赵红卫
杜习智,赵成龙,秦玉花,赵红卫
河南省人民医院药学部 郑州450003
△男,1970年7月生,本科,副主任药师,研究方向:微生物生化药学,E-mail:dxzzz@163.com
肺癌是全球发病率和病死率最高的恶性肿瘤之一。按病理学分型,肺癌可分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),NSCLC 约占肺癌的80%,其中超过半数患者确诊时已属晚期,失去手术机会,化疗仍是最重要的治疗手段[1]。目前第三代化疗药物与顺铂或卡铂组成的含铂双药方案为NSCLC 化疗的一线方案[2]。奥沙利铂为第三代铂类药物,其肾毒性极微弱,血液学毒性较低,消化道反应易于处理,临床上选用奥沙利铂治疗NSCLC 的案例屡见不鲜[3],但由于单个试验样本量小,各研究实施的干预措施和结局指标不尽统一,其研究结论有待进一步评估。为了进一步明确奥沙利铂联合化疗与卡铂联合化疗治疗中晚期NSCLC 的有效性和安全性,该研究采用meta 分析方法对现有随机对照试验(randomized controlled trial,RCT)进行全面评价,以期为临床应用提供更可靠的证据。
1 资料与方法
1.1 研究的纳入标准 研究设计采用RCT,研究对象为经病理学或细胞学诊断证实的中晚期NSCLC患者,无化疗禁忌证;治疗方法为奥沙利铂或卡铂为基础的两药联合方案;观察的主要指标为客观缓解率(完全缓解+ 部分缓解)、客观控制率(完全缓解+部分缓解+稳定),次要指标为不良反应(血液学毒性、消化道毒性、神经毒性)发生率。
1.2 文献检索 以non-small cell lung cancer、carboplatin、oxaliplatin、NSCLC、卡铂、奥沙利铂等为检索词,所有检索采用主题词与自由词相结合的方式,RCT 的检索遵循Cochrane 协作网制定的检索策略进行。检索PubMed、EMbase、Medline、Cochrane library、CNKI、VIP、WANFANG、CBM 数据库,检索时限从建库至2013年12月。收集关于比较奥沙利铂联合化疗与卡铂联合化疗治疗中晚期NSCLC 疗效的RCT。由两位研究者按照标准筛选文献、提取资料和评价质量,对有分歧而难以确定的试验通过讨论决定是否纳入。
1.3 文献质量评价 参考Cochrane 协作网提供的标准进行质量评价:①随机分配方法。②分配方案隐藏。③基于结局指标的基线情况,是否有良好的可比性。④结果数据的完整性,失访情况。⑤是否正确使用盲法。以上条件全部满足为A 级,若1 条及以上不清楚为B 级,若1 条及以上不正确为C 级。
1.4 统计学处理 采用RevMan 5.1 进行分析。应用χ2检验比较各研究结果间的异质性,当各研究间不存在异质性时,应用固定效应模型;存在统计学异质性时,分析异质性来源,对可能导致异质性的因素进行亚组分析;若两个研究之间存在异质性而临床差异无统计学意义时,应用随机效应模型进行分析,检验水准α=0.05。
2 结果
2.1 文献检索结果 初检出相关文献76 篇,去重后得到41 篇,阅读标题、摘要及全文,排除非临床研究文献、非RCT,最终得到6 篇,其中英文文献3 篇、中文文献3 篇。6个RCT 共纳入了788例患者(4例患者因某些原因中断治疗而无法统计疗效和不良反应,故纳入分析的共784例患者,其中奥沙利铂组390例,卡铂组394例),两治疗组基线资料均具有可比性,纳入研究的基本特征见表1。
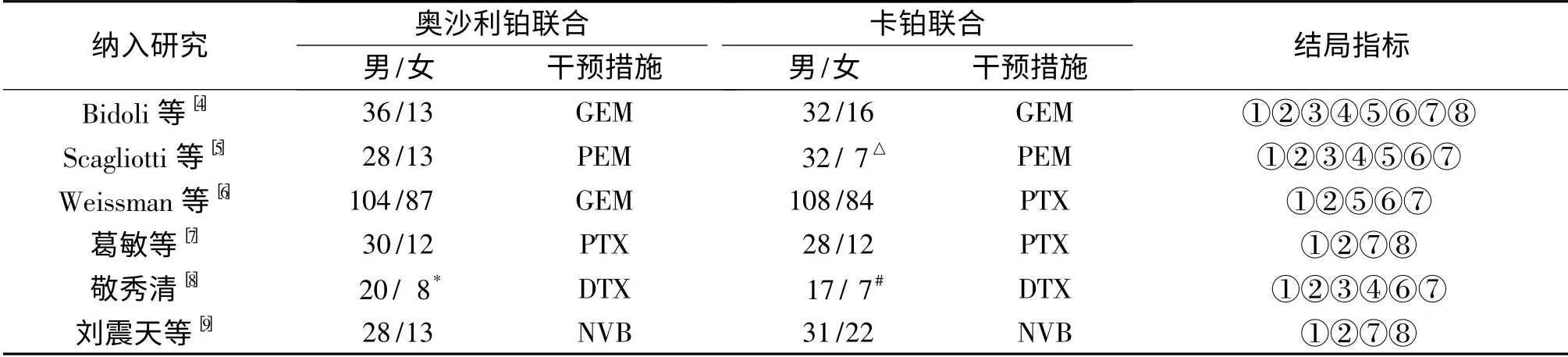
表1 纳入研究的基本特征
2.2 纳入研究的质量评价结果 纳入的6个RCT均(Bidoli 等[4]、Scagliotti 等[5]、Weissman 等[6]、葛敏等[7]、敬秀清[8]和刘震天等[9])声明在研究中采用了随机方法,但均未描述具体的随机方法,纳入研究的文献对所有对象进行意向性治疗分析,且基线一致性较好,并报道了研究对象的失访和退出情况,质量评价结果均为B 级。
2.3 分析结果
2.3.1 客观缓解率 6个RCT 报告了疾病缓解率,各研究间无统计学异质性(χ2=2.79,P=0.73,I2=0%;Z =1.19,P =0.23),采用固定效应模型,meta分析结果(图1)显示含奥沙利铂方案与含卡铂方案的客观缓解率差异无统计学意义(OR =0.82,95%CI:0.60~1.14)。
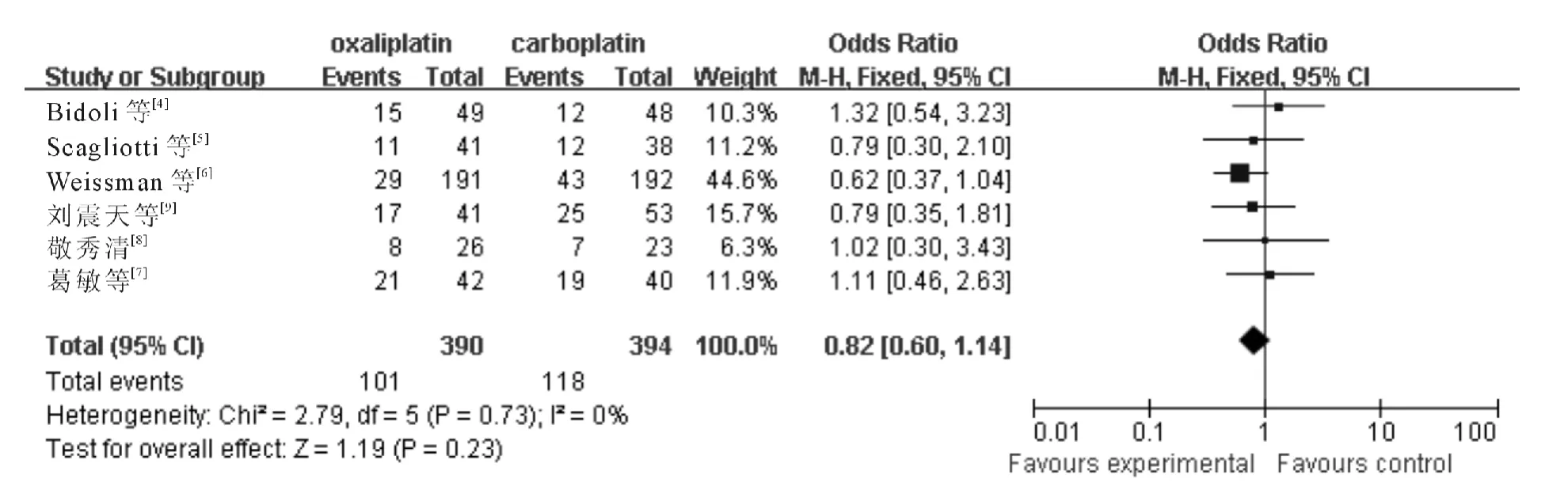
图1 含奥沙利铂和含卡铂方案治疗中晚期NSCLC 客观缓解率的分析结果
2.3.2 客观控制率 6个RCT 报告了疾病控制率,各研究间无统计学异质性(χ2=1.50,P=0.91,I2=0%;Z =0.19,P =0.85),采用固定效应模型,meta分析结果(图2)显示,含奥沙利铂方案与含卡铂方案的客观控制率差异无统计学意义(OR =0.97,95%CI:0.72~1.31)。
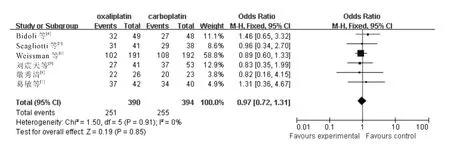
图2 含奥沙利铂和含卡铂方案治疗中晚期NSCLC 疾病控制率的分析结果
2.3.3 贫血 3个RCT 报告了Ⅲ-Ⅳ度贫血,各研究间无统计学异质性(χ2=0.27,P =0.87,I2=0%;Z=2.66,P =0.008),采用固定效应模型,meta分析结果(图3)显示含奥沙利铂方案致Ⅲ-Ⅳ度贫血发生率低于含卡铂方案(OR =0.18,95%CI:0.05~0.63)。
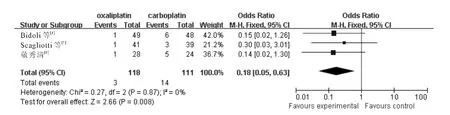
图3 含奥沙利铂和含卡铂方案治疗后引起Ⅲ-Ⅳ度贫血发生率的分析结果
2.3.4 白细胞减少 3个RCT 报告了Ⅲ-Ⅳ度白细胞减少,各研究间无统计学异质性(χ2=1.43,P =0.49,I2=0%;Z=3.64,P<0.001),采用固定效应模型,meta 分析结果(图4)显示含奥沙利铂方案致Ⅲ-Ⅳ度白细胞减少显著低于含卡铂方案(OR =0.29,95%CI:0.15~0.57)。
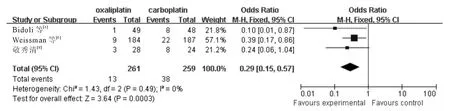
图4 含奥沙利铂和含卡铂方案治疗后引起Ⅲ-Ⅳ度白细胞减少的分析结果
2.3.5 中性粒细胞减少 3个RCT 报告了Ⅲ-Ⅳ度粒细胞减少,各研究间无统计学异质性(χ2=1.49,P=0.47,I2=0%;Z =4.43,P<0.001),采用固定效应模型,meta 分析结果(图5)显示含奥沙利铂方案致Ⅲ-Ⅳ度中性粒细胞减少显著低于含卡铂方案(OR=0.41,95%CI:0.28~0.61)。
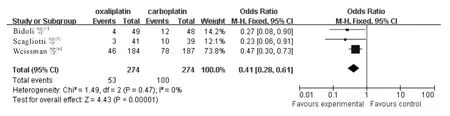
图5 含奥沙利铂和含卡铂方案治疗后引起Ⅲ-Ⅳ度粒细胞减少的分析结果
2.3.6 血小板减少 4个RCT 报告了Ⅲ-Ⅳ度血小板减少,各研究间有统计学异质性(χ2=22.73,P<0.001,I2=87%;Z =0.41,P =0.68),采用随机效应模型,meta 分析结果(图6)显示含奥沙利铂方案与含卡铂方案的Ⅲ-Ⅳ度血小板减少差异无统计学意义(OR=0.60,95%CI:0.05~6.78)。
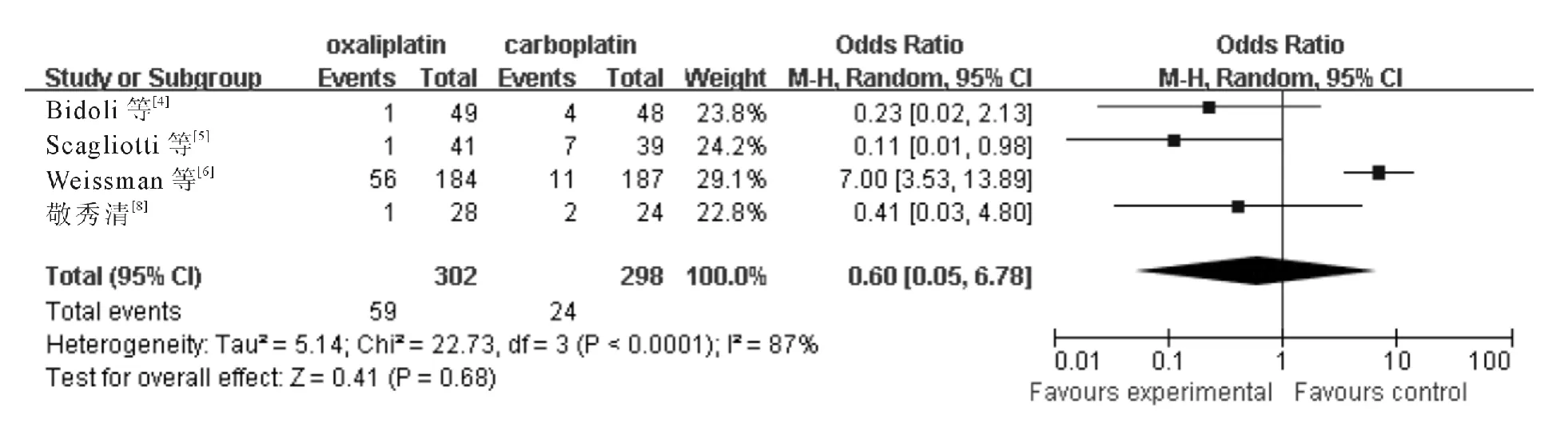
图6 含奥沙利铂和含卡铂方案治疗后引起Ⅲ-Ⅳ度血小板减少的分析结果
纳入的研究具有高度异质性,Weissman 等[6]的研究中采用的方案为吉西他滨/奥沙利铂对比紫杉醇/卡铂方案,即除铂类外,联合应用的药物也不同,因此考虑奥沙利铂组Ⅲ-Ⅳ度血小板不良反应与吉西他滨的使用有关,故将该实验剔除后进行meta 分析如下所示,各研究间无统计学异质性(χ2=0.60,P=0.74,I2=0%;Z=2.49,P=0.01),采用固定效应模型,meta 分析结果(图7)显示含奥沙利铂方案致Ⅲ-Ⅳ度血小板减少显著低于含卡铂方案(OR =0.20,95%CI:0.05~0.71)。
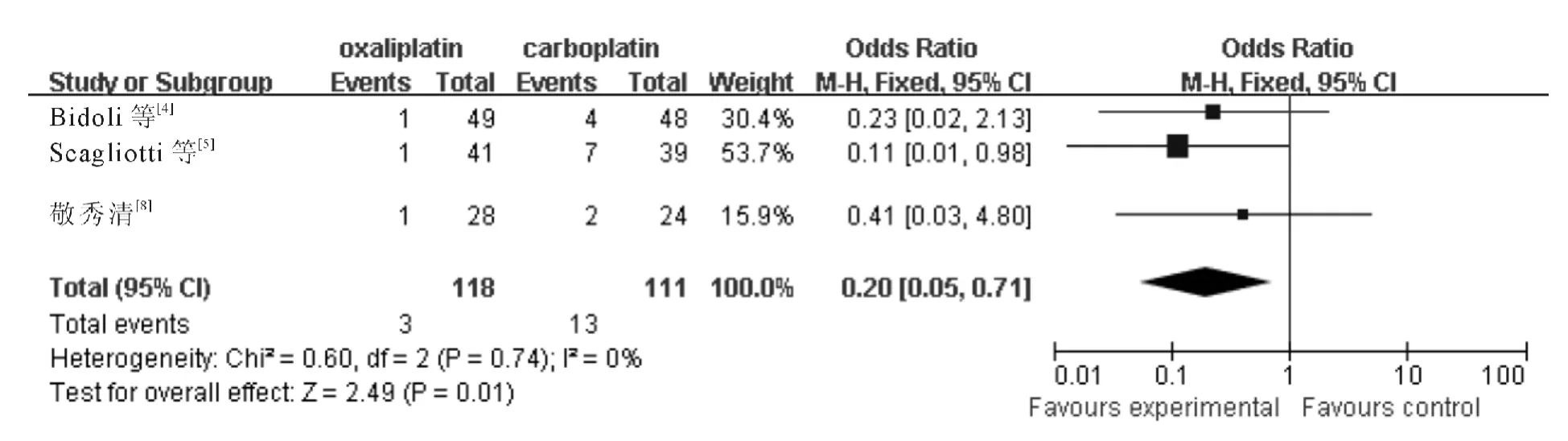
图7 含奥沙利铂和含卡铂方案治疗后引起Ⅲ-Ⅳ度血小板减少的分析结果(剔除后)
2.3.7 恶心呕吐 6个研究报告了Ⅲ-Ⅳ度恶心、呕吐,各研究间无统计学异质性(χ2= 6.25,P =0.10,I2=52%;Z =0.07,P =0.94),采用固定效应模型,meta 分析结果(图8)显示含奥沙利铂方案与含卡铂方案的Ⅲ-Ⅳ度恶心、呕吐差异无统计学意义(OR=1.02,95%CI:0.55~1.91)。
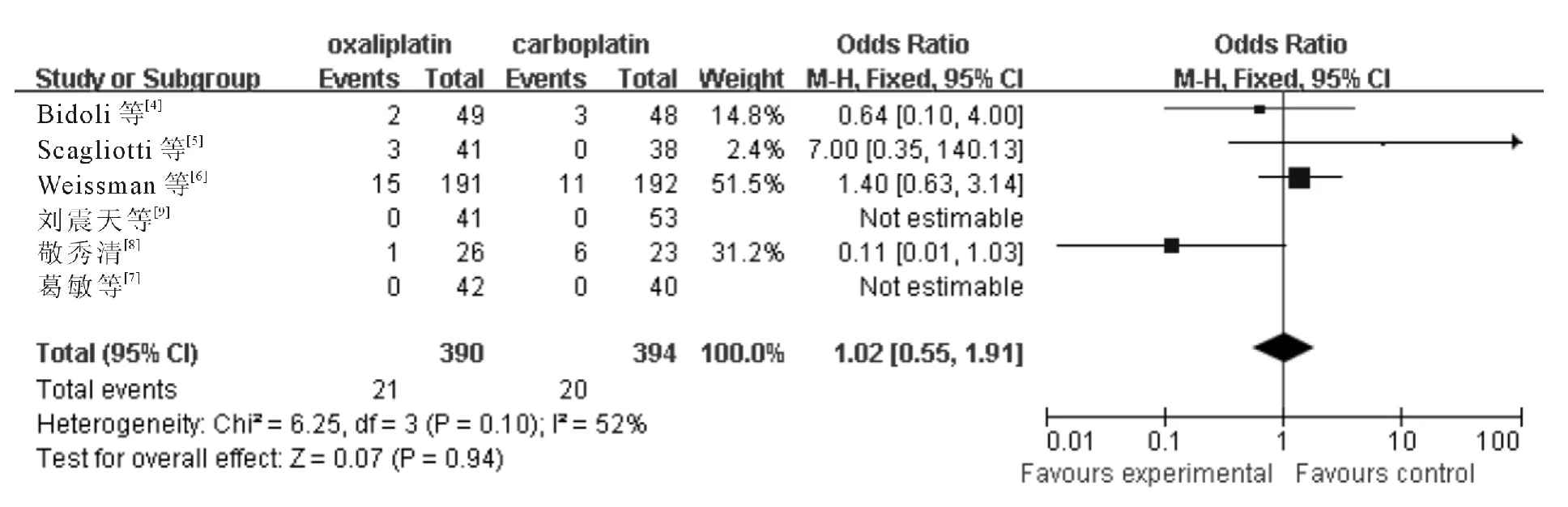
图8 含奥沙利铂和含卡铂方案治疗后引起Ⅲ-Ⅳ度恶心、呕吐的分析结果
2.3.8 神经毒性 3个研究报告了神经毒性,各研究间无统计学异质性(χ2=0.11,P =0.94,I2=0%;Z=4.62,P<0.001),采用固定效应模型,meta分析结果(图9)显示含奥沙利铂方案致神经毒性高于含卡铂方案(OR = 30.58,95% CI:7.17~130.38)。
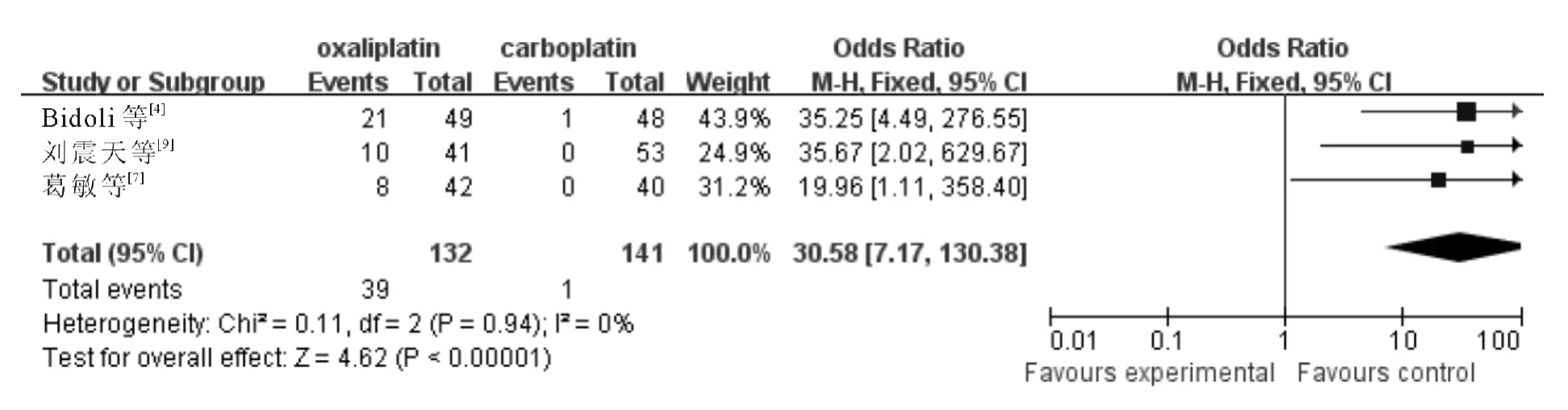
图9 含奥沙利铂和卡铂方案治疗后引起神经毒性的分析结果
3 讨论
以顺铂或卡铂为基础的两药方案已被确立为中晚期NSCLC 的标准化疗方案[2],而顺铂及卡铂的恶心、呕吐和耳、肾毒性等不良反应大大地限制了其在临床上的应用。奥沙利铂为继顺铂和卡铂之后的第三代铂类药物,主要用于消化道肿瘤,不良反应较轻且容易控制,易于被情况较差的患者接受[10]。在临床实际应用中,常有奥沙利铂联合方案治疗中晚期NSCLC 的实践[3],但是含奥沙利铂联合方案与含卡铂联合方案相比,是否在有效性与安全性方面更具优势,目前尚无相应的系统分析进行评价。
该meta 分析纳入的6 篇RCT 文献,质量等级均达到B 级。通过meta 分析发现,疗效方面,二者在客观缓解率、客观控制率方面差异无统计学差异;不良反应方面,奥沙利铂联合方案的血液学毒性较卡铂低,而神经毒性较卡铂高。鉴于meta 分析为二次研究,受纳入分析的原始文献质量影响较大,且评价过程可能存在偏倚等局限性,在今后的临床应用中尚需进行更高质量、更大样本的临床研究进一步验证奥沙利铂联合化疗治疗中晚期NSCLC 的有效性和安全性。
综上所述,该meta 分析结果显示,在治疗中晚期NSCLC 上,奥沙利铂联合化疗疗效与卡铂联合化疗相当,但安全性一定程度上优于卡铂联合化疗方案,对于老年患者、身体状况较差患者、不能耐受卡铂不良反应等情况者,可考虑作为诊疗指南与规范之外的一种超常规化疗方案。
[1]Cataldo VD,Gibbons DL,Perez-Soler R,et al.Treatment of non-small-cell lung cancer with erlotinib or gefitinib[J].N Engl J Med,2011,364(10):947
[2]Peters S,Adjei AA,Gridelli C,et al.Metastatic non-smallcell lung cancer (NSCLC):ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2012,23(Suppl 7):vii56
[3]赵成龙,赵红卫,柴东燕,等.2012年河南省人民医院200例肿瘤患者化疗药应用合理性分析[J].中国医院用药评价与分析,2013,13(11):983
[4]Bidoli P,Zilembo N,Cortinovis D,et al.Randomized phaseⅡthree-arm trial with three platinum-based doublets in metastatic non-small-cell lung cancer:an Italian trials in medical oncology study[J].Ann Oncol,2007,18(3):461
[5]Scagliotti GV,Kortsik C,Dark GG,et al.Pemetrexed combined with oxaliplatin or carboplatin as first-line treatment in advanced non-small cell lung cancer a multicenter,randomized,phase Ⅱtrial[J].Clinical Cancer Research,2005,11(2):690
[6]Weissman CH,Reynolds CH,Neubauer MA,et al.A phaseⅢrandomized trial of gemcitabine-oxaliplatin versus carboplatin-paclitaxel as first-line therapy in patients with advanced non-small cell lung cancer[J].J Thorac Oncol,2011,6(2):358
[7]葛敏,彭海鹰.多西紫杉醇联合奥沙利铂治疗晚期非小细胞肺癌临床分析[J].河北医药,2008,30(11):1704
[8]敬秀清.多西他赛联合奥沙利铂或卡铂治疗晚期非小细胞肺癌的近期疗效观察[J].中国医药指南,2012,10(19):26
[9]刘震天,陈颖兰.长春瑞宾联合顺铂、卡铂、奥沙利铂在治疗晚期非小细胞肺癌的比较[J].实用临床医学,2006,7(10):61
[10]Piché N,Leblond FA,Sidéris L,et al.Rationale for heating oxaliplatin for the intraperitoneal treatment of peritoneal carcinomatosis:a study of the effect of heat on intraperitoneal oxaliplatin using a murine model[J].Ann Surg,2011,254(1):138
