非重型再生障碍性贫血患儿端粒长度及端粒酶活性与免疫抑制治疗的关系
2015-12-04张雁儒王西阁
付 亮,张雁儒,王西阁#,王 璇
1)郑州大学第三附属医院儿内科 郑州450052 2)郑州大学基础医学院人体解剖学教研室 郑州450001
再生障碍性贫血(aplastic anemia,AA)是儿童时期常见的血液系统疾病,其发病机制尚未完全阐明。随着研究的深入,端粒及端粒酶与AA 的关系引起国内外学者的关注。有研究[1]显示:成人AA存在端粒长度缩短及端粒酶活性降低的现象,这部分患者对免疫抑制治疗反应差。与成人AA 不同,儿童患者尤其是非重型再生障碍性贫血(non-severe aplastic anemia,NSAA)患儿骨髓增生程度以活跃及明显活跃为多见。作者分析了NSAA 患儿端粒长度及端粒酶活性与免疫抑制治疗反应及预后的关系,现将结果报道如下。
1 临床资料
1.1 一般资料 NSAA组为2010年1月至2015年1月郑州大学第一附属医院及第三附属医院初次确诊为NSAA 的患儿102例,男57例,女45例,中位年龄10(4~16)岁,诊断标准参考《儿童获得性再生障碍性贫血诊疗建议》[2],确诊后未治疗时留取外周血6 mL,EDTA 抗凝。选择同期进行体检的年龄及性别构成匹配的健康儿童45例作为正常对照组,男24例,女21例,中位年龄9(3~15)岁,取外周静脉血6 mL,EDTA抗凝。该研究征得研究对象家属知情同意。
1.2 治疗方案及疗效判定标准 该研究中治疗方案为环孢素A(CsA)联合司坦唑醇:CsA 3~5 mg·kg-1·d-1,分2次口服;司坦唑醇0.1~0.3 mg·kg-1·d-1,分2次口服。治疗期间监测血常规、肝肾功能、网织红细胞等,合并感染、严重贫血或出血者酌情应用抗生素、输注红细胞或血小板。患儿接受治疗后6个月评估疗效,分为完全缓解(CR)、部分缓解(PR)、未缓解(NR)[2]。
1.3 主要试剂及仪器 细胞/细菌/酵母基因组DNA 提取试剂盒购自上海莱枫生物科技有限公司;SYBR®Premix Ex TaqTM试剂盒购自大连TaKaRa 有限公司;TRAP-PCR 试剂盒购自南京凯基生物有限公司,Trizol 试剂购自Invitrogen 公司,单个核细胞分离液及造血干细胞分离液购自天津灏洋试剂公司;引物由上海Invitrogen 生物技术有限公司设计、合成;TE Buffer(pH =8.0)、异丙醇、乙醇均为市售分析纯。实时荧光定量PCR 仪为ABI Prism®7500 型。
1.4 外周血单个核细胞DNA 提取及端粒长度检测 取EDTA 抗凝血3 mL,用单个核细胞分离液分离外周血单个核细胞,按照试剂盒步骤提取基因组DNA,测定DNA 浓度及纯度,用TE Buffer 将样品DNA 调整至10 mg/L,所有DNA 样本放入-20℃冰箱保存待测。利用RT-PCR 分别检测样品端粒及内参36B4 基因PCR 扩增的Ct 值。每次反应均设标准曲线,每个样品设3个复孔。引物序列:端粒上游引物5'-CGGTTTGTTTGGGTTTGGGTTTGGGTTT GGGTTTGGGTT-3' ,下游引物5'-GGCTTGCCTTAC CCTTACCCTTACCCTTACCCTTACCCT-3';36B4 基因上游引物5'-CAGCAAGTGGGAAGGTGTAATCC-3',下游引物5'-CCCATTCTATCATCAACGGGTACAA-3'。反应体系均为20 μL:2 × SYBR®Premix Ex TaqTM10 μL,ROX Reference Dye 0.4 μL,样品DNA(10 mg/L)3 μL,上、下游引物(10 μmol/L)各0.4 μL,用去离子水调整终体积为20 μL。反应条件:95℃30 s;95℃5 s,60℃30 s,40个循环。采用2-ΔΔCt法计算端粒相对长度。
1.5 外周血造血干细胞分离及端粒酶活性检测取EDTA 抗凝血3 mL,用造血干细胞分离液分离外周血造血干细胞,按照试剂盒说明提取端粒酶,Bradford 法测定端粒酶浓度,用Lysis Buffer 将样品调整至1 g/L,-20℃保存待测。利用TRAP-PCR银染法测定端粒酶活性,TRAP 反应体系共50 μL:5 μL 10 ×TRAP Buffer,1 μL dNTPs,1 μL Taq-DNA 聚合酶,1 μL TS Primer,2 μL 端粒酶提取物,用DEPC水调整终体积为50 μL;23℃保温30 min 后加入1 μL CX Primer,混匀,于PCR 扩增仪上进行扩增。反应条件:94℃5 min;94℃30 s,50℃30 s,72℃90 s,30个循环;72℃延伸10 min。用硝酸银对TRAP产物聚丙烯酰胺凝胶电泳的结果进行染色,采用Multi Anslust 软件计算端粒酶活性。
1.6 统计学处理 采用SPSS 17.0 进行统计学分析。NSAA组与正常对照组端粒相对长度及端粒酶活性的比较采用两独立样本的t 检验;不同疗效组端粒相对长度及端粒酶活性的比较采用单因素方差分析,两两比较采用LSD-t 检验。检验水准α=0.05。
1.7 结果 NSAA组端粒相对长度小于正常对照组,端粒酶活性高于正常对照组,见表1。NR组及PR组端粒相对长度小于CR组,且NR组端粒相对长度小于PR组;CR组及PR组端粒酶活性高于NR组,但CR组与PR组端粒酶活性相比,差异无统计学意义,见表2。

表1 正常对照组和NSAA组端粒相对长度及端粒酶活性比较
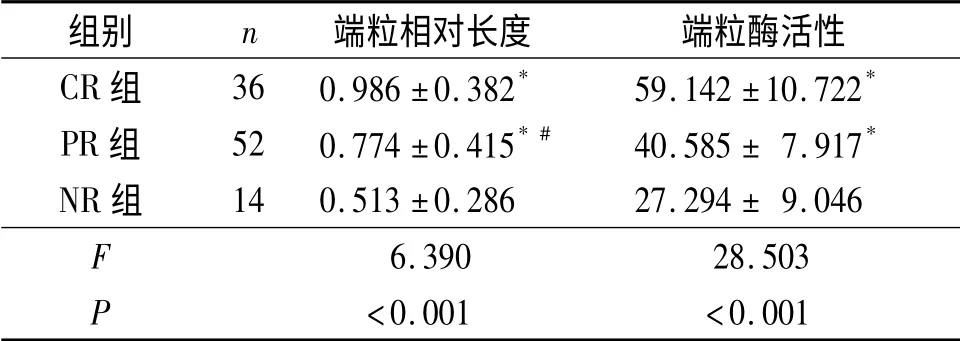
表2 不同疗效组NSAA患儿端粒相对长度及端粒酶活性比较
2 讨论
AA 是一种全血细胞减少的骨髓衰竭性疾病,其发病机制尚不明确,大部分AA 患者应用免疫抑制剂疗效显著,因此认为AA 的发病与免疫机制有关[3],但仍有一部分患者经过免疫抑制治疗无效或复发。端粒是真核生物染色体末端一段高度保守的结构,其作用是保护染色体DNA 完整性。端粒长度随年龄的增长逐渐缩短,其长度的维持需要端粒酶合成端粒DNA 并添加到染色体末端[4-5]。
早在20 世纪末,Ball 等[6]研究发现AA 患者外周血白细胞端粒DNA 长度较年龄调整后的正常人群缩短。而在对于儿童AA 的研究[7]中发现,AA 患儿造血干细胞端粒酶活性较对照组升高,且慢性AA组较急性组升高尤为明显。该研究中NSAA组患儿初诊时端粒长度较正常对照组缩短,而端粒酶活性升高,与既往研究结果一致。分析其原因如下,儿童造血干细胞自我更新能力及增生潜能较高,造血功能代偿能力强,因而骨髓增生程度较为活跃。AA 患者由于各种因素导致机体免疫功能紊乱,免疫细胞异常活化,通过细胞因子作用杀伤骨髓干/祖细胞并抑制其分化,剩余造血干细胞因代偿造血而大量分裂使细胞端粒缩短[8]。正常人端粒酶活性维持在低水平状态[9],而在AA 患者中,机体通过负反馈作用上调端粒酶活性,延长端粒使之恢复正常水平。由于慢性AA 进展时间长,更多的干细胞可以进入细胞周期,充分进行代偿,因而端粒酶活性升高,端粒损耗不明显。
该研究中作者发现,CR组及PR组AA 患儿初诊时端粒酶活性明显升高。分析其原因可能与端粒酶自身的特点有关,正常情况下造血干细胞端粒酶活性较低,当端粒长度足够长时,端粒酶活性并非必需的,而当端粒的长度缩短到一定程度时,端粒酶活性高低成为维持端粒长度的关键因素。CR组端粒酶活性升高可以充分代偿端粒长度的缩短,使之恢复正常水平,这部分患儿造血干细胞可以恢复正常造血潜能,因而临床治疗效果好。PR组患儿同样表现出端粒酶活性升高,但端粒相对长度小于CR组,而较NR组高。推测这部分患儿虽表现出一定的负反馈调节机制,在一定程度上可以延长损耗的端粒,但代偿相对不足,这也可以解释为什么大部分NSAA 患儿经免疫抑制治疗后可以长期生存,另一部分患儿则出现不同的转归。而NR组端粒相对长度较CR组及PR组明显缩短,其端粒酶活性水平较低。提示造血细胞过度分裂,端粒酶活性不足以代偿端粒损耗,导致造血功能衰竭,临床表现为治疗效果不佳[10-13]。
目前对于高表达端粒酶活性的白血病等增殖性疾病,通过靶向治疗抑制其端粒酶活性可取得理想的疗效。据此在NSAA 患儿中,尤其是存在端粒长度缩短或端粒酶活性下降的患儿,可通过靶向性激活端粒酶的活性延长端粒长度,从而改善预后,这为NSAA 的治疗提供了新的思路。
[1]Aalbers AM,Calado RT,Young NS,et al.Telomere length and telomerase complex mutations in pediatric acute myeloid leukemia[J].Leukemia,2013,27(8):1786
[2]中华医学会儿科学分会血液学组,中华儿科杂志编辑委员会.儿童获得性再生障碍性贫血诊疗建议[J].中华儿科杂志,2014,52(2):103
[3]谢垒,盛光耀,徐学聚,等.抗胸腺细胞球蛋白联合环孢素治疗重型再生障碍性贫血[J].实用儿科临床杂志,2011,26(9):701
[4]Geserick C,Blasco MA.Novel roles for telomerase in aging[J].Mech Ageing Dev,2006,127(6):579
[5]Heiss NS,Knight SW,Vulliamy TJ,et al.X-linked dyskeratosis congenita is caused by mutations in a highly conserved gene with putative nucleolar functions[J].Nat Genet,1998,19(1):32
[6]Ball SE,Gibson FM,Rizzo S,et al.Progressive telomere shortening in aplastic anemia[J].Blood,1998,91(10):3582
[7]王西阁,周玉洁,王丹凤,等.再生障碍性贫血患儿骨髓造血干细胞端粒酶活性及相关基因表达的研究[J].中国当代儿科杂志,2013,15(1):25
[8]Li JP,Zheng CL,Han ZC.Abnormal immunity and stem/progenitor cells in acquired aplastic anemia[J].Crit Rev Oncol Hematol,2010,75(2):79
[9]Yamaguchi H,Calado RT,Ly H,et al.Mutations in TERT,the gene for telomerase reverse transcriptase,in aplastic anemia[J].N Engl J Med,2005,352(14):1413
[10]宋佳音,邝丽萍,王洋,等.端粒及端粒酶与再生障碍性贫血免疫抑制治疗疗效关系[J].中华血液学杂志,2013,34(9):771
[11]Scheinberg P,Cooper JN,Sloand EM,et al.Association of telomere length of peripheral blood leukocytes with hematopoietic relapse,malignant transformation,and survival in severe aplastic anemia[J].JAMA,2010,304(12):1358
[12]Göhring G,Lange K,Hofmann W,et al.Telomere shortening,clonal evolution and disease progression in myelodysplastic syndrome patients with 5q deletion treated with lenalidomide[J].Leukemia,2012,26(2):356
[13]Mukherjee Nee Chakraborty S,Ghosh U,Bhattacharyya NP,et al.Curcumin-induced apoptosis in human leukemia cell HL-60 is associated with inhibition of telomerase activity[J].Mol Cell Biochem,2007,297(1/2):31
