沉默热休克蛋白70基因对A549细胞凋亡的影响*
2015-12-04阙菡雅王小龙徐小艳夏艳秋
阙菡雅,王小龙,李 杰,徐小艳,夏艳秋,周 舫#
1)郑州大学公共卫生学院劳动卫生学教研室 郑州450001 2)靖边县疾病预防控制中心慢性病科 靖边718500 3)河南省职业病防治研究院毒理科 郑州450052
肺癌是目前中国发病率最高的肿瘤,位于致死性癌症的首位[1]。热休克蛋白70(heat shock protein 70,HSP70)是机体受到应激刺激后产生的一类高度保守的蛋白质,其主要功能是参与调控细胞内蛋白的折叠,从而保护细胞免受应激损伤。研究[2]发现,HSP70 在肺癌组织中的表达量高于正常组织。c-jun 氨基末端激酶(c-jun N-terminal kinase,JNK)是促分裂原活化蛋白激酶超家族的成员之一,应激刺激能够促使其激活并参与细胞凋亡的调控。研究[3]证实,诱导产生的HSP70 能够通过影响JNK 的活化水平来抑制细胞凋亡。目前关于抑制HSP70是否能促进肺癌细胞凋亡的研究较少[4],因此课题组利用小干扰RNA(siRNA)靶向性下调人肺腺癌细胞株A549 细胞中HSP70 的表达,观察细胞凋亡率的变化,检测HSP70、p-JNK 和活化型Caspase-3 的表达量,探讨HSP70 在A549 细胞凋亡中的作用机制以及HSP70 作为肺癌治疗的新靶点的可能性,以期为肺癌的治疗提供新的思路和实验依据。
1 材料与方法
1.1 主要材料和仪器 A549 细胞由中科院上海细胞生物研究所提供。HSP70 siRNA 由上海吉玛制药有限公司合成:正义链序列为5’-AGGACGAGUUU GAGCACAATT-3’,反义链序列为5’-UUGUGCU CAAACUCGUCCUTT-3’;阴性对照siRNA 正义链序列为5’-UUCUCCGAACGUGUCACGUTT-3’,反义链序列为5’-UUGUGCUCAAACUCGUCCUTT-3’。超纯RNA 抽取试剂盒、RT-PCR 定量试剂盒及哺乳动物蛋白抽提试剂盒均购于北京康为世纪生物科技有限公司。
1.2 细胞培养 在37℃、体积分数5%CO2、相对湿度95%条件下用含体积分数10%无支原体胎牛血清的RPMI 1640 培养液培养、传代A549 细胞。
1.3 实验分组 实验分为3组:空白对照组(仅加入转染试剂Lipofectamine 2000)、阴性对照组(转染无关序列)和干扰组(转染HSP70 siRNA),每组均设6个复孔。转染前1 d,将细胞密度调整到(4~5)×104mL-1,接种到12 孔板,每孔1 mL 单细胞悬液,待细胞增殖至50%~60%融合时,进行转染。采用瞬时转染的方法,转染试剂为Lipofectamine 2000,严格按照说明书操作。
1.4 各组A549 细胞凋亡的流式细胞仪检测 转染48 h 后,将细胞吹打成密度不低于1.0×105mL-1单细胞悬液,用PBS 清洗2次后弃去上清,取50.0 μL 的Binding Buffer 重悬细胞后加入5.0 μL的Annexin V-FIFC 和5.0 μL 的碘化丙啶,室温下避光反应15 min 后,用流式细胞仪测定细胞凋亡率。
1.5 各组A549 细胞中HSP70 mRNA 表达的实时定量PCR 检测 转染24 h 后,PBS 缓冲液清洗12孔板2次后,用超纯RNA 提取试剂盒提取RNA 并逆转成cDNA,以cDNA 为模板进行实时定量PCR,以β-actin 作为参照。HSP70 上游引物序列5’-CTG GAGTCCTACGCCTTCAACAT-3’,下游引物序列5’-ACACATTGGGGTAGTAGTAGTCGC-3’;β-actin 上游引物序列5’-CCAGGGCGTTATGGTAGGCA-3’,下游引物序列5’-TGGTTGACCCTGCTATACCTT-3’。引物由上海生工生物工程技术服务有限公司设计并合成。PCR 反应体系:cDNA 2.0 μL,2 ×UltraSYBR Mixture 25.0 μL,上下游引物各1.0 μL,RNase-Free水21.0 μL。PCR 反应:95℃预变性10 min;95℃变性15 s,60℃退火1 min,37个循环。采用2-ΔΔCt法计算HSP70 mRNA 的相对水平。
1.6 各组A549 细胞中HSP70、p-JNK 及Caspase-3 蛋白表达的Western blot 检测 转染48 h 后收集各组细胞,提取总蛋白,调整浓度,使每孔上样量均为30 μg。蛋白样品和上样缓冲液按比例混匀,95℃5 min 变性后进行SDS-PAGE 凝胶电泳,电泳条件为80 V 40 min,120 V 90 min。电泳结束后将蛋白转移至PVDF 膜上。用50 g/L 的脱脂奶粉溶液封闭2 h 后用TBST 溶液洗脱3次,10 min/次,然后一抗(按1∶1 000 稀释)4℃孵育过夜,二抗(按1∶5 000 稀释)37℃孵育2 h 以上,TBST 洗3次后,在暗室中进行ECL 显影。用图像分析软件Quantity One 分析条带的积分光密度。
1.7 统计学处理 采用SPSS 21.0 进行分析。应用单因素方差分析和LSD-t 检验比较各组细胞凋亡率、HSP70 mRNA 和蛋白、p-JNK 以及Caspase-3 蛋白表达水平的差异,检验水准α=0.05。
2 结果
2.1 A549 细胞转染条件的确定 转染12 h 后,在荧光显微镜下观察转染FAM 标记的NC siRNA 的A549 细胞是否成功,并使用流式细胞仪进行计数,重复3次。结果显示转染率稳定在80%以上。
2.2 各组细胞凋亡率、HSP70 mRNA 和蛋白、p-JNK及Caspase-3 蛋白表达的比较 见图1、2 和表1。

图1 各组A549 细胞中p-JNK 蛋白的表达
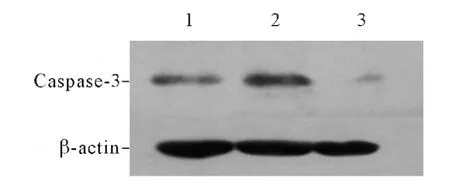
图2 各组A549 细胞中Caspase-3 蛋白的表达
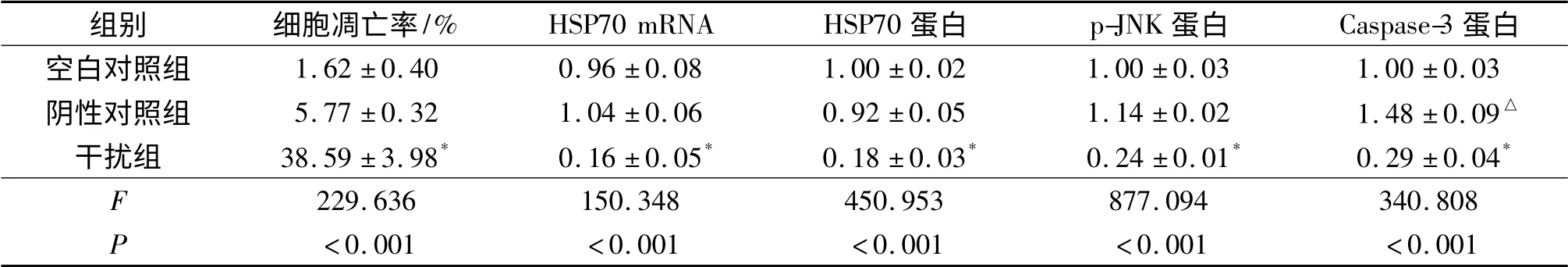
表1 各组细胞凋亡率、HSP70 mRNA 和蛋白、p-JNK 及Caspase-3 蛋白表达的结果(n=6)
3 讨论
热休克蛋白又称热应激蛋白,是生物体在热诱导条件下合成的一组具有高度保守性的蛋白质。研究[5]证实HSP70 在正常组织或癌旁组织中低表达或不表达,而在许多恶性肿瘤组织中高表达。刘金钢等[6]发现HSP70 与PI3K/AKT 信号传导通路之间可能具有互相促进肝癌细胞增殖的作用,肝癌组织中HSP70、PI3K 和Akt 蛋白表达是影响患者无瘤生存期的重要因素之一,HSP70 蛋白表达量越高,患者的预后越差。RNAi 是由双链RNA 介导的由特定酶参与的特异性基因沉默现象,它能够在转录水平、转录后水平和翻译水平上阻断基因的表达,RNAi 介导的基因沉默具有高度特异性、高效率及高稳定性等特点,因此被广泛地应用于探索基因功能及恶性肿瘤的治疗领域[7]。作者针对HSP70 设计的siRNA 能特异性地沉默HSP70 靶基因,荧光定量PCR 及Western blot 结果表明,与其他2组相比,干扰组细胞中HSP70 mRNA 及蛋白的表达水平明显下降。
细胞的凋亡受抑制是肿瘤细胞的主要特征之一。HSP70 作为“分子伴侣”能与癌基因、抑癌基因及其产物相互结合形成HSP70-癌蛋白复合体,使得与癌症相关蛋白的结构与功能保持完整,从而在癌细胞中发挥抗凋亡的作用[8]。作者采用siRNA 抑制A549 细胞中HSP70 的表达后,细胞凋亡率相比空白对照组上升,这也从另一方面表明HSP70 在肺腺癌A549 细胞中发挥着抗凋亡的作用。
研究[9-10]表明,诱导型HSP70 能够抑制JNK 的活化。作者采用RNAi 下调A549 细胞中HSP70 表达水平后,活化型JNK 表达水平下降,其原因可能是抑制了HSP70 的表达后,细胞内HSP90 反馈性增加,从而抑制活化型JNK 的表达。有研究[11]表明,在胎盘内皮细胞中HSP70 和HSP90 能够同时调控JNK 和ERK 的表达。Caspase-3 是Caspase 家族的重要成员,是Caspase 依赖的细胞凋亡过程的最终执行者[12]。作者的研究结果显示,采用siRNA 下调HSP70 的表达后,不但细胞凋亡增加,且伴随有Caspase-3 水平的降低,提示siRNA 下调HSP70 可能通过Caspase-3 之外的途径促进细胞凋亡[13]。目前已有研究[14]表明使用siRNA 抑制HSP70 的表达后,褪黑素可以反馈性地抑制其所诱导Caspase-3 的激活,甚至引起其表达水平的下降。
综上所述,siRNA 抑制HSP70 的表达可以促进A549 细胞的凋亡,且该过程伴随着JNK 和Caspase-3 表达水平的降低。细胞凋亡的过程是多个信号通路共同作用的结果,HSP70 可能与其他热休克蛋白家族成员如HSP90 同时参与多个细胞信号通路的调控,具体的作用机制需进一步的研究加以证实。
[1]曾红梅,陈万青.中国癌症流行病学与防治研究现状[J].化学进展,2013,25(9):1415
[2]Park TS,Kim HR,Koh JS,et al.Heat shock protein 70 as a predictve marker for platinum-based adjuvant chemotherapy in patients with resected non-small cell lung cancer[J].Lung Cancer,2014,86(2):262
[3]Rallis A,Lu BW,Ng J.Molecular chaperones protect against JNK-and Nmnat-regulated axon degeneration in Drosophila[J].J Cell Sci,2013,126(3):838
[4]Sherman MY,Gabai VL.Hsp70 in cancer:back to the future[J].Oncogene,2014,Oct 27.doi:10.1038/onc.2014.349.[Epub ahead of print]
[5]李超,陈力,沈学远.Hsp70 与肿瘤转移相关蛋白MMP-9,VEGF,E-cadherin 和CD44v6 对非小细胞肺癌转移的诊断价值分析[J].中国现代医学杂志,2014,24(15):30
[6]刘金钢,李岩,刘丹,等.HSP70 与PI3K/Akt 信号通路在肝细胞肝癌组织中的表达及意义[J].中华肝脏外科手术学电子杂志,2013,2(1):45
[7]王翔凌,孙宁玲,马丽萍,等.大鼠PER2 基因RNAi 慢病毒载体的构建及干扰效率的测定[J].西安交通大学学报:医学版,2014,35(1):16
[8]Murphy ME.The HSP70 family and cancer[J].Carcinogenesis,2013,34(6):1181
[9]王小龙,冯斐斐,孙鹏辉,等.HSP70、JNK 和p38 在放线菌素D 诱导的A549 细胞凋亡中的作用[J].郑州大学学报:医学版,2014,49(5):668
[10]Sun LW,Fan H,Yang LG,et al.Tyrosol prevents ischemia/reperfusion-induced cardiac injury in H9c2 cells:involvement of ROS,Hsp70,JNK and ERK,and apoptosis[J].Molecules,2015,20(3):3758
[11]Padmini E,Uthra V,Lavanya S.Effect of HSP70 and 90 in modulation of JNK,ERK expression in preeclamptic placental endothelial cell[J].Cell Biochem Biophys,2012,64(3):187
[12]Mei JM,Niu CS.Effects of CDNF on 6-OHDA-induced apoptosis in PC12 cells via modulation of Bcl-2/Bax and caspase-3 activation[J].Neurol Sci,2014,35(8):1275
[13]Sabirzhanov B,Stoica B,Hanscom M,et al.Over-expression of HSP70 attenuates caspase-dependent and caspase-independent pathways and inhibit s neuronal apoptosis[J].J Neurochem,2012,123(4):542
[14]Kleszczyński K,Zwicker S,Tukaj S,et al.Melatonin compensates silencing of heat shock protein 70 and suppresses ultraviolet radiation-induced inflammation in human skin ex vivo and cultured keratinocytes[J].J Pineal Res,2015,58(1):117
