酶水解pH值对酸性亚硫酸氨盐预处理杨木糖化效率的影响
2015-12-03朱杨苏金永灿
王 琰,朱杨苏,勇 强,金永灿*
酶水解pH值对酸性亚硫酸氨盐预处理杨木糖化效率的影响
王 琰1,朱杨苏1,勇 强2,金永灿1*
(1. 南京林业大学 江苏省制浆造纸科学与工程重点实验室,江苏 南京 210037;2. 南京林业大学 林木遗传与生物技术教育部重点实验室,江苏 南京 210037)
改变酶水解pH值可以影响木质纤维生物质碳水化合物的酶水解糖化作用效果。以经酸性亚硫酸氢盐预处理的杨木浆为底物,探究了酶水解pH值对其碳水化合物转化率的影响。结果表明,预处理杨木浆的酶水解总糖得率随pH值增加呈现先升高后趋于平缓的规律,酶水解最佳pH值范围为4.8~5.4。当酶水解液pH值为4.8时,经6%亚硫酸氢钠预处理杨木浆在20 FPU/g酶用量下水解,葡聚糖和总糖转化率达到最高值,分别为91.3%和84.3%。
pH值;预处理;酸性亚硫酸氢盐;酶水解;糖转化率
利用可再生的木质纤维生物质,通过预处理和酶水解将其中的碳水化合物转化成单糖,后续发酵并提纯生产生物乙醇[1]。木质纤维生物质制备生物乙醇是当前新能源开发利用的热点之一,符合我国可持续发展战略。但由于木质纤维生物质中纤维素、半纤维素和木质素会形成致密的网状结构,直接对其酶水解的效果较差,因此必须采用适当的预处理。预处理可以降低木质素和半纤维素的含量[2-8],降低纤维素的结晶度,增加纤维素的比表面积和孔隙率,以提高纤维素对酶的可及性。亚硫酸氢盐预处理源自制浆造纸工业中的亚硫酸盐蒸煮,是在酸性条件下降解半纤维素使之溶出,通过磺化作用使木质素引入亲水性的磺酸基并溶出部分木质素,增加纤维素酶的可及度,从而提高底物的酶水解效率。大量研究表明该方法能有效促进木质纤维生物质酶水解糖转化效率,纤维素转化率高达90%,并且产生较少的发酵抑制物[9-13]。
酶水解糖化作用是生产生物乙醇过程中成本较高的步骤之一。一般认为,纤维素酶的活性在pH值4.5~5.0范围内最大,而且超出该范围时,酶的活性降低。例如,Novozymes建议的Trichoderma reesei纤维素酶和CTec2的酶水解最适pH值分别为4.8和5.0,美国能源部标准实验方法特别注明木质纤维生物质的酶水解缓冲液pH值为4.8[14]。但有研究指出,纤维原料的预处理方法有可能影响底物的最适pH值,如美国林产品研究所发现,提高酶水解pH至 5.2~6.2可以促进SPORL法预处理浆料的酶水解糖化作用[15-16]。本文主要探讨酶水解pH值对酸性亚硫酸氢钠预处理杨木浆料酶水解糖化的影响。
1 实验
1.1 材料
速生杨木(Populus deltoids),取自苏北,原木去皮后旋切成厚度约为2 mm的薄片,手工剪成长×宽约为30 mm×20 mm的木片,风干后置于密封袋中平衡水分。原料的主要化学成分如表1所示。

表1 杨木原料的主要化学成分
酶水解所用酶液为Cellic®CTec 2复合酶(Novo Nordisk A/S,Demark),酶活力以纤维素酶活计,按文献[17]的方法测定其滤纸酶活。根据文献[18]配制有效缓冲范围为4.5~5.7的醋酸―醋酸钠缓冲溶液。
1.2 酸性亚硫酸氢钠预处理
酸性亚硫酸氢钠预处理在自制10×1.25 L回转式电加热油浴蒸煮器中进行。每个蒸煮罐中加入100 g绝干杨木木片,亚硫酸氢钠用量(相对于绝干原料,w/w)分别为0%、2%、4%、6%、8%,硫酸用量为0.92%(w/w),固液比1∶5(w/V),与药液充分混合后在80℃下回转预浸渍30 min,以1℃/min的速率升温至170℃,保温30 min完成预处理。
经预处理的杨木用水充分洗净,离心脱水后置于密封袋中平衡水分,称重、测定水分含量并计算得率。取部分样品用于化学成分分析,余下部分用双圆盘磨浆机(磨盘直径300 mm,磨片间距0.04 mm,转速3 000 r/min)疏解成浆,重复磨浆两次。所得浆料经离心脱水,撕碎后置于密封袋中平衡水分备用。
1.3 酶水解
精确称量称取相当于0.5 g葡聚糖的预处理浆料于150 mL锥形瓶中,在不同pH值的缓冲溶液中进行酶水解,酶水解底物浓度为2%,以每克葡聚糖为基准的酶用量(下同)为20 FPU/g,用醋酸―醋酸钠缓冲溶液调节酶水解pH值分别为4.5、4.8、5.1、5.4和5.7。将锥形瓶置于恒温振荡器(SHA-C,上海精宏)中,在180 r/min和50±2℃条件下振荡处理48 h。酶水解结束后将酶水解液和残渣混合物转移至离心管中,在5 000 r/min下离心20 min,取上清液分析其中各单糖的含量。
1.4 分析与检测
1.4.1 原料及预处理浆料成分分析
杨木原料及预处理的浆料的苯―醇提取物和灰分根据国家标准分析[19]。杨木原料及预处理杨木浆中的木质素含量根据美国能源部的方法分析[20]。用G3玻砂漏斗真空过滤分离Klason木质素和酸水解液,计算Klason木质素时扣除灰分(575℃灼烧)含量;取0.5 mL酸水解液,用4% H2SO4稀释定容至10 mL,以稀释后的水解液为样品,以4% H2SO4为参比,用紫外―可见分光光度计(UV-1800,Shimazdu)测定波长205 nm处的吸光值,计算酸溶木质素(ASL)的含量。
1.4.2 原料、预处理浆料和酶水解液中糖含量检测
采用高效液相色谱(HPLC,Agilent 1200 Series,USA)分析单糖含量,分析柱和保护柱分别为Bio Rad Aminex HPX-87H 20 n(300 mm×7.8 mm)和Cation-H Refill Cartridges(30 mm×4.6 mm)(Bio-RadLaboratories,USA),进样量为10 μL,流动相为5 mmol/L H2SO4,流速为0.6 mL/min,柱温55℃。检测器为RID示差检测器,外标法测定。酶水解清液用去离子水稀释10倍,经0.22 μm尼龙滤器过滤后进样;原料或预处理浆料测定木质素时得到的水解液,用50%(w/w)NaOH水溶液调节pH至1~3以满足HPLC的进样pH范围,经0.22 μm尼龙滤器过滤后进样分析还原糖的含量。检测结果为水解液中单糖的含量,为便于计算酶水解糖转化率,分别将六碳糖乘以0.9,五碳糖乘以0.88,换算成样品中聚糖的含量。本研究酶水解还原糖转化率定义为水解液中各聚糖与预处理物料中各聚糖的质量百分比,所有的数据均为两次平行实验的平均值。
2 结果与讨论
2.1 酸性亚硫酸氢钠预处理对杨木得率和预处理液pH的影响
亚硫酸氢钠用量对杨木预处理得率及预处理液pH值得影响如表2所示。杨木经酸性亚硫酸氢钠预处理后其物料得率随着亚硫酸氢钠用量的增加先减小后趋势渐缓。在亚硫酸氢钠用量为0时,硫酸主要水解半纤维素,由于纤维素的聚合度高,结晶度高,在硫酸水解过程中降解较少,因此杨木浆料得率高。随着亚硫酸氢钠用量增加,预处理液中亲核试剂HSO3-和SO2·H2O的浓度增大,促进了木质素的磺化反应,使木质素磺化溶出,并且硫酸降解部分碳水化合物,因此得率下降。当亚硫酸氢钠用量为8%时,pH增加会抑制半纤维素的水解[21],因此得率趋于平缓。此外,酸性预处理能降解木质素―半纤维素复合体。由于半纤维素和木质素的主要连接键型是苯基糖苷键、酯键、苯甲醚键、半缩醛和缩醛键,在酸性亚硫酸氢钠预处理中,硫酸会破坏木质素和半纤维素之间α-芳基醚键连接的作用,并且苯甲醚键、酯键和苯基糖苷键易被酸水解,因此酸性预处理物料得率较低[22]。

表2 酸性亚硫酸氢钠预处理对杨木浆料得率及预处理液pH的影响
预处理液pH值随着亚硫酸氢钠用量的增加先减小,后趋势渐缓。预处理初始时半纤维素会水解生成乙酸、糖醛酸等[22]物质,使预处理液pH值降低;随着亚硫酸氢钠用量的增加,预处理液pH值趋于平缓。
2.2 酸性亚硫酸氢钠预处理对杨木主要成分的影响
不同亚硫酸氢钠用量预处理后的杨木浆料化学成分含量(以初始原料为基准)的变化如表3所示。亚硫酸氢钠用量为0%(即稀酸预处理)时,由于木质素结构单元间的主要连接键型―酚型和非酚型的β-O-4在酸性条件下不断裂,只能断裂部分α-芳基醚键,因此木质素脱除率低。随着亚硫酸氢钠用量增加,预处理液中亲核试剂HSO3-和SO2·H2O浓度增大,原料中木质素磺化溶出,因此残余木质素含量随着亚硫酸氢钠用量的增加而减少。此外,亚硫酸氢钠用量增加导致Klason木质素含量显著下降,而酸溶木质素的含量变化较小,可能是由于杨木浆料中被磺化的木质素具有良好的亲水性,在测定木质素含量时更易溶出,使得酸溶木质素含量保持稳定。
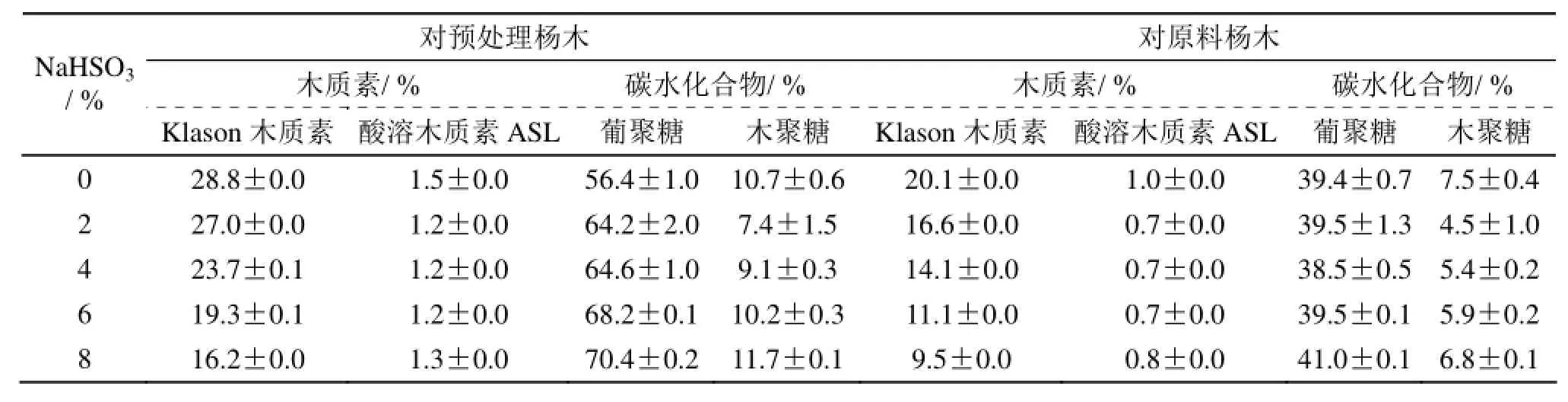
表3 酸性亚硫酸氢钠预处理杨木浆料的主要化学成分
葡聚糖和木聚糖的总和反映了杨木原料中高聚糖的含量。一般而言,杨木高聚糖的含量随着预处理条件的增强而降低。由表3数据可发现,杨木浆料中的高聚糖含量随亚硫酸氢钠用量的增加先下降后趋势渐缓。在低pH值条件下,纤维素和半纤维素水解,起始杨木浆料中的葡聚糖含量下降。随着亚硫酸氢钠用量的增加,pH值增加,纤维素水解速率变慢,因此葡聚糖的相对含量增加。在酸性条件下,半纤维素容易降解,因此木聚糖降低幅度较大,最高降幅约70%。相比较而言,葡聚糖降幅最高为12%左右,说明酸性预处理主要降解半纤维素。
木质素是影响木质纤维原料酶水解的主要因素之一,脱除木质素通常会提高酶水解效率[22]。但是,随着预处理条件的增强,脱除木质素的同时会降解高聚糖,使浆料得率下降。为了提高酶水解糖化效率,需要较高的浆料得率,即脱除木质素的同时减少高聚糖的降解。如图1所示,随着木质素脱除率的增大,杨木浆料预处理得率呈先快速下降再平缓的趋势,说明增加亚硫酸氢钠用量会降低脱木质素选择性。
2.3 酶水解pH值对酸性亚硫酸氢钠预处理杨木浆酶水解性能的影响
不同pH值酶水解体系对酸性亚硫酸氢钠预处理杨木浆酶水解还原糖的转化率如表4所示。相同预处理条件下,葡聚糖和总糖转化率随着酶水解液pH值的增加先增大后趋于平缓,木聚糖转化率变化较小。杨木预处理浆料中葡聚糖的含量远大于木聚糖的含量,酶水解液中的葡萄糖含量也远大于木糖的含量,故葡聚糖转化率的变化规律与总糖相似。

图1 木质素脱除率对预处理固形物得率的影响
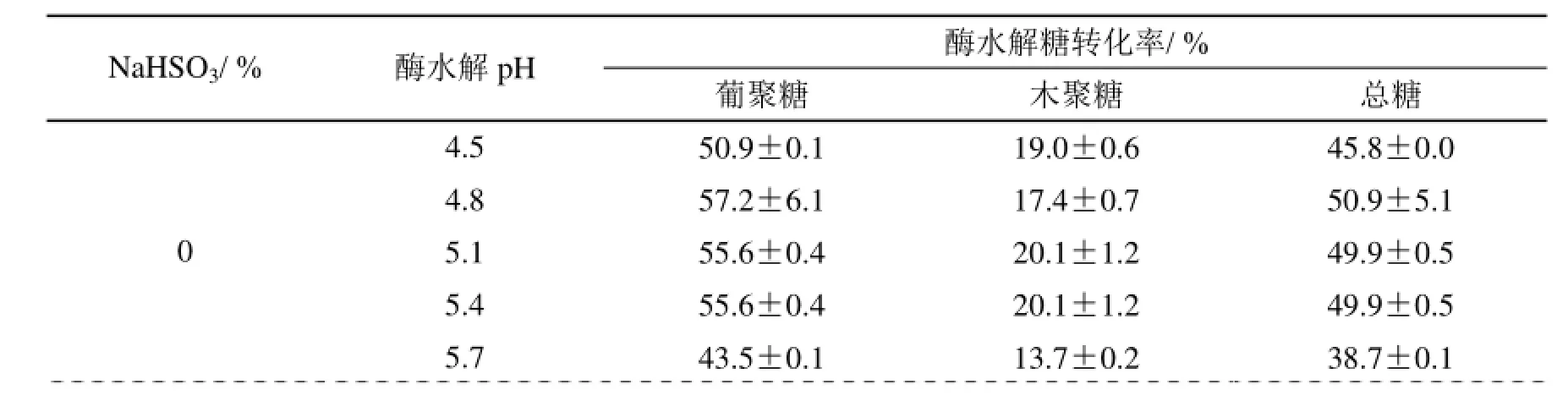
表4 酸性亚硫酸氢钠预处理杨木浆料不同酶水解pH下糖的转化率(以预处理物料为基准)

续表4
由表4可见,酸性亚硫酸氢钠预处理杨木浆料的最佳酶水解糖化作用的缓冲液pH值为4.8~5.4。Wood等[23]研究表明若纤维素酶的催化活性在某一pH值时最大,则此pH值为酶的最适pH值。由表4数据可见,酶水解体系的pH值对酸性亚硫酸氢钠预处理杨木浆的糖转化率具有显著的影响。当pH值由4.5升至4.8时,酶水解中葡聚糖、木聚糖和总糖的转化率均快速递增;pH值继续增至5.7时,酸性亚硫酸氢钠预处理浆的葡聚糖和总糖转化率趋于平缓而后又下降,而木聚糖则是先下降后升高的趋势。因此,酸性亚硫酸氢钠预处理后底物酶水解的最佳pH值范围为4.8~5.4。
木质素脱除率是影响酶水解效率的重要因素,在亚硫酸氢钠用量不同的预处理条件下,酶水解总糖转化率与木质素脱除率的关系如图2所示。对木质纤维生物质预处理,并不需要脱除全部的木质素来达到最高的酶水解效率,一般而言,脱除原料中20%~65%的木质素就可以提高酶对纤维素的可及性[24]。由图2可见,随着木质素脱除率的增加,杨木浆料酶水解总糖转化率增加,当预处理后杨木中木质素脱除率为55%左右时,酶水解总糖转化率就可达到最大值,继续脱除木质素反而会过多地降解碳水化合物,不利于提高总糖转化率。

图2 木质素脱除率对酸性亚硫酸氢钠预处理杨木浆糖转化率的影响
3 结论
1)酸性亚硫酸氢钠预处理对杨木化学成分有显著影响,随着亚硫酸氢钠用量的增加,杨木木质素脱除率上升,碳水化合物加剧降解,其中半纤维素降解程度大于纤维素。预处理后杨木浆料得率先快速下降后趋势渐缓。
2)杨木各聚糖转化率随着亚硫酸氢钠用量的增加先升高后下降。总糖转化率随着木质素脱除率的增加而上升,但当木质素脱除率约为55%时,继续脱除木质素不能有效提高总糖转化率。
3)酸性亚硫酸氢钠预处理杨木浆的酶水解最佳pH值范围为4.8~5.4,经6%亚硫酸氢钠预处理杨木浆在酶水解液pH值 4.8和20 FPU/g下酶水解,葡聚糖和总糖转化率分别达到91.3%和84.3%。
[1] Chundawat S P S, Beckham G T, Himmel M E, et al. Deconstruction of lignocellulosic biomass to fuels and chemicals[J]. Annual Review of Chemical and Biomolecular Engineering, 2011, 2: 121-145.
[2] Klinke H B, Ahring B K, Schmidt A S, et al. Characterization of degradation products from alkaline wet oxidation of wheat straw[J]. Bioresource Technology, 2002, 82(1): 15-26.
[3] Gu F, Yang L F, Jin Y C, et al. Green liquor pretreatment for improving enzymatic hydrolysis of corn stover[J]. Bioresource Technology, 2012, 124: 299-305.
[4] Yang L F, Cao J, Jin Y C, et al. Effects of sodium carbonate pretreatment on the chemical compositions and enzymatic saccharification of rice straw[J]. Bioresource Technology, 2012, 124: 283-291.
[5] Jin Y C, Yang L F, Jameel H, et al. Sodium sulfite-formaldehyde pretreatment of mixed hardwoods and its effect on enzymatic hydrolysis[J]. Bioresource Technology, 2013, 135: 109-115.
[6] Taniguchi M, Takahashi D, Watanabe D, et al. Effect of steam explosion pretreatment on treatment with Pleurotus ostreatus for the enzymatic hydrolysis of rice straw[J]. Journal of Bioscience and Bioengineering, 2010, 110(4): 449-452.
[7] Yang X W, Ma F Y, Zeng Y L, et al. Structure alteration of lignin in corn stover degraded by white-rot fungus Irpex lacteus CD2[J]. International Biodeterioration and Biodegradation. 2010, 64(2): 119-123.
[8] Sues A, Millati R, Edebo L, et al. Ethanol production from hexoses, pentoses, and dilute-acid hydrolyzate by Mucor indicus[J]. FEMS Yeast Research, 2005, 5(6-7): 669-676.
[9] Zhu J Y, Pan X J, Wang G S, et al. Sulfite pretreatment (SPORL) for robust enzymatic saccharification of spruce and red pine[J]. Bioresource Technology, 2009, 100(8): 2411-2418.
[10] Wang G S, Zhu J Y, Pan X J, et al. Sulfite pretreatment to overcome recalcitrance of lignocellulose (SPORL) for robust enzymatic saccharification of hardwoods[J]. Biotechnology Progress, 2009, 25(4): 1086-1093.
[11] Zhu W Y, Zhu J Y, Gleisner R, et al. On energy consumption for size-reduction and yields from subsequent enzymatic saccharification of pretreated lodgepole pine[J]. Bioresource Technology, 2010, 101: 2782-2792.
[12] Shuai L, Yang Q, Zhu J Y, et al. Comparative study of SPORL and dilute-acid pretreatments of spruce for cellulosic ethanol production[J]. Bioresource Technology, 2010, 101: 3106-3114.
[13] Zhang D S, Yang Q, Zhu J Y, et al. Sulfite (SPORL) pretreatment of switchgrass for enzymatic saccharification[J]. Bioresource Technology, 2013, 129: 127-134.
[14] Selig M, Weiss N, Ji Y. Enzymatic saccharification of lignocellulosic biomass. Laboratory Analytical Procedure[S]. UnitedStates: National Renewable Energy Laboratory, 2008.
[15] Wang Z J, Lan T Q, Zhu J Y. Lignosulfonate and elevated pH can enhance enzymatic saccharification of lignocelluloses[J]. Biotechnology for Biofuels, 2013, 6: 9.
[16] Lan T Q, Lou H M, Zhu J Y. Enzymatic saccharication of lignocelluloses should be conducted at elevated pH 5.2~6.2[J]. BioEnergy Research, 2013, 6: 476-485.
[17] Ghose T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 1987, 59(2): 257-268.
[18] 贾之慎. 无机分析化学[M]. 北京: 高等教育出版社, 2008: 110-120.
[19] 石淑兰, 何福望. 制浆造纸分析与检测[M]. 北京: 中国轻工业出版社, 2003: 22-50.
[20] Sluiterl A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytical Procedure[S]. United States: National Renewable Energy Laboratory, 2008.
[21] Linoj K, Richard C, Pablo A C, et al. Can the same steam pretreatment conditions be used for most softwoods to achieve good, enzymatic hydrolysis and sugar yields[J]. Bioresource Technology, 2010, 101(20): 7827-7833.
[22] 李忠正, 孙润仓, 金永灿. 植物纤维资源化学[M]. 北京: 中国轻工业出版社, 2012.
[23] Wood T M, Mccrae S I, Bhat K M. The mechanism of fungal cellulose action. Synergism between enzyme components of Penicillium pinophilum cellulose in solubilizing hydrogen bond-ordered cellulose[J]. Biochemical Journal, 1989, 260(1): 37-43.
[24] Han Y W, Catalano E A, Ciegler A. Treatments to improve the digestibility of crop residues[M]. New York: Academic Press, 1983: 217-238.
Effects of pH on the Enzymatic Saccharification of Acid Sodium Bisulfite Pretreated Poplar
WANG Yan1, ZHU Yang-su1, YONG Qiang2, JIN Yong-can1*
(1. Jiangsu Provincial Key Lab of Pulp and Paper Science and Technology, Nanjing Forestry University, Nanjing 210037, China; 2. Key Laboratory of Forest Genetics and Biotechnology, Nanjing Forestry University, Nanjing 210037, China)
Changing the pH of enzymatic hydrolysis could affect the enzymatic saccharification of lignocellulosic biomass. Acid sodium bisulfite pretreated poplar pulps was used as substrate for exploring the effects of enzymatic hydrolysis pH on the enzymatic saccharification. The results showed that the sugar yield and conversion of enzymatic hydrolysis of pretreated poplar tended to increase, then became gentle with the increase of pH. The range of optimal hydrolysis pH was 4.8~5.4. After hydrolyzed at pH 4.8 and 20 FPU/g, the glucan and total sugar conversion of poplar pretreated with 6% sodium bisulfite reached up to 91.3% and 84.3%, respectively.
pH; pretreatment; acid bisulfite; enzymatic saccharification; sugar conversion
TQ352.62
A
1004-8405(2015)03-0015-07
10.16561/j.cnki.xws.2015.03.03
2015-04-22
“十二五”国家科技支撑计划(2015BAD15B09);高等学校博士学科点专项科研基金(20133204110006);江苏省基础研究计划(自然科学基金)(BK20141473);江苏省高校优势学科建设工程资助项目。
王 琰(1990~),男,硕士研究生;研究方向:生物质资源化学与工程。
* 通讯作者:金永灿(1968~),博士,教授。jinyongcan@njfu.edu.cn
