厄贝沙坦缓释微丸的制备及体外释药特性的考察
2015-12-02叶星辰吕竹芬陈燕忠
叶星辰 吕竹芬 陈燕忠
广东药学院药物研究所 广东省药物新剂型重点实验室,广东广州510006
厄贝沙坦缓释微丸的制备及体外释药特性的考察
叶星辰 吕竹芬 陈燕忠▲
广东药学院药物研究所 广东省药物新剂型重点实验室,广东广州510006
目的 制备厄贝沙坦缓释微丸,并对其体外释放度进行考察。 方法 采用流化床包衣技术,以丙烯酸树脂类Eudragit NE30D和Eudragit L30D-55混合水分散体为包衣材料,制备缓释微丸。考察不同释放介质﹑转速对其体外释药行为的影响。 结果 优化后的包衣处方为Eudragit NE30D/Eudragit L30D-55的比例为4︰1,抗粘剂和致孔剂的用量分别为聚合物干重的75%及20%,增重10%,熟化24h,释放介质的pH值对微丸释药的影响最明显,其体外释药过程符合一级释药模型。 结论 成功制备了厄贝沙坦缓释微丸,经考察其释放度符合要求。
厄贝沙坦;缓释微丸;体外释放
高血压主要表现为体循环动脉血压的增高,可直接导致脑﹑肾脏﹑心脏等多个脏器的并发症。时辰药理学研究表明人类的血压变化存在一定的昼夜节律性,凌晨觉醒前后血压迅速上升,是高血压患者心脑血管事件发生的高峰段[1-2]。厄贝沙坦是新一代的高选择性血管紧张素Ⅱ受体拮抗剂,降压作用平稳而持久,较其他同类药物副作用少,同时也是被欧盟首次批准的高血压﹑2型糖尿病早期及肾病晚期患者的主要降压药[3]。微丸剂可通过不同的处方工艺,使药物达到不同的释药速率,以实现药物的定时﹑定位和定速释放[4]。将厄贝沙坦制成缓释微丸可使药物在体内缓慢释放,产生持续而稳定的降压作用,防止清晨血压骤升[5]。
1 仪器与材料
Aeromatic型流化床(NIRO,德国),ZR-4型智能溶出试验仪(天津大学无线电厂),高效液相色谱仪(Dionex Corp),BS224S型精密分析天平(Sartorius仪器有限公司),CP225D型精密分析天平(北京赛多利斯仪器系统有限公司),GZX-9246MBE型干燥箱(上海博讯实业有限公司医疗设备厂)。
厄贝沙坦含药丸芯(自制),厄贝沙坦对照品(深圳迈瑞尔化学技术有限公司,含量99.75%)Eudragit(NE30D﹑L30D-55,德固赛),聚乙二醇6000(PEG6000,卡乐康辅料公司),滑石粉(广州杰辅),其他试剂均为分析纯。
2 方法与结果
2.1 分析方法的建立
2.1.1 色 谱 条 件[6]色 谱 柱:Diamonsil C18(250mm×4.6mm,5μm);流动相:乙腈︰0.02mol/L磷酸二氢钾水溶液(用磷酸调节pH值至3.0)=45︰55;流速:1mL/min;检测波长:245nm;柱温30℃;进样量:10μL。
2.1.2 标准曲线的建立 精密称取厄贝沙坦对照品适量,加甲醇配制成250μg/mL的储备液。精密吸取储备液0.5,1.0,2.0,4.0,6.0,8.0mL,分别置于10mL容量瓶中,以甲醇定容,用0.45μm滤膜滤过,取续滤液。将制得的系列溶液分别进样测定,并以峰面积A对浓度做线性回归,得回归方程Y=0.380X-0.113(r=0.9993),厄贝沙坦在12.5~200μg/mL范围内线性关系良好。
2.1.3 精密度实验 吸取同一对照品溶液(100μg/mL),按2.1.1项下的色谱条件连续进样5次。结果峰面积A的RSD为0.63%,表明仪器精密度良好。
2.1.4 稳定性试验 取同一对照品溶液(100μg/mL),分别于0﹑2﹑4﹑6﹑8﹑10﹑12﹑24h时各测定峰面积A一次,计算得峰面积的RSD为1.02%,表明样品在24h内稳定。
2.2 体外释放度方法的建立
采用转篮法进行测定。具体方法参考《中国药典》2010 版第二部附录XD中释放度测定法第一法中之操作。开始2h的释放介质采用0.1mol/L HCl溶液,水浴温度为(37±0.5)℃,转速100r/min。2h后取样,并弃去HCl溶液;立即转入pH6.8 磷酸盐(pH6.8 PBS)缓冲溶液作为释放介质,于4﹑6﹑8﹑10﹑12﹑24h各取样5mL,同时补加同温pH6.8 PBS缓冲溶液5mL;样品用0.45μm微孔滤膜过滤,取续滤液稀释至适宜浓度,测定峰面积A,并计算累积释药率。
2.3 厄贝沙坦缓释微丸的制备
2.3.1 包 衣 液 的 配 制 取Eudragit NE30D﹑Eudragit L30D-55及PEG 6000适量,缓慢加入适量纯化水中,搅拌均匀,制得溶液A。将滑石粉边搅拌边加入纯化水中后匀化5min,制得溶液B。将溶液A与溶液B均匀混合后过80目筛,即得包衣液。
2.3.2 缓释微丸的制备 将厄贝沙坦含药丸芯置于流化床中,以底喷方式进行包衣。调整出风温度为22~28℃,喷液速率为1.5~2.0mL/min,喷雾压力为4bar。包衣完成后继续流化干燥10min,结束后置于烘箱中40℃熟化24h。
2.4 处方与工艺因素对释药的影响
2.4.1 包衣增重 按2.3.1项下方法制备包衣液,对同一批含药丸芯包衣,包衣增重分别为5%﹑10%和15%,测定其释放度。结果如图1。由结果可知,当包衣增重为5%时,药物过快释放,于12h时左右已释放约药物总量的90%;当增重15%时,药物释放不完全;当增重为10%时释放效果最佳。所以选择增重10%。2.4.2 Eudragit NE30D 和Eudragit L30D-55的比例 分别以Eudragit NE30D/Eudragit L30D-55=1︰1﹑4︰1﹑ 8︰1,配制三份不同的包衣液,制备缓释微丸,增重10%,测定其释放度。结果见图2。由图可知,当两种材料之比为1︰1及8︰1时,药物释放均较缓慢,释放不够完全,且当配比为1︰1时,包衣液黏度过大,极易造成喷口堵塞。当配比为4︰1时,释放度基本符合要求。因此,选择Eudragit NE30D/ Eudragit L30D-55为4︰1。
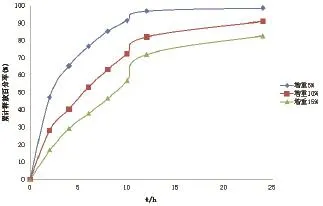
图1 包衣增重对药物释放的影响
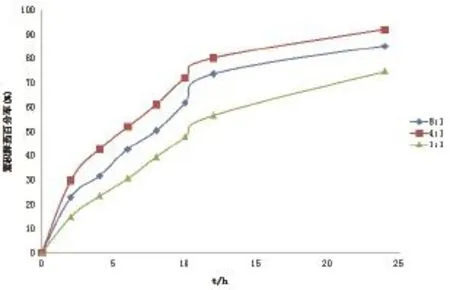
图2 Eudragit NE30D与Eudragit L30D-55之比对微丸释放的影响
2.4.3 抗粘剂用量 在包衣液中加入超细滑石粉作为抗粘剂。分别配制三份不同的包衣液,其中抗粘剂分别占聚合物干重的25%﹑50%﹑75%,制备缓释微丸,测定其释放度。结果见图3。由图可知,当抗粘剂的用量为聚合物干重的50%或75%时对释放度并无显著影响。但当滑石粉的用量为25%时,流化包衣时微丸粘连严重,使包衣无法继续进行;用量为50%时,仍会出现微丸相互粘连的现象;故最终确定滑石粉的用量为75%。
2.4.4 致孔剂用量 选择PEG 6000为作为致孔剂。以致孔剂的用量分别为聚合物干重的10%﹑20%﹑30%,配制成三份不同的包衣液,制备缓释微丸,测定其释放度。结果见图4。由图中可知,PEG6000用量对微丸的释放度影响较大。用量过大或过小都难以使微丸获得理想的缓释效果。根据结果选择致孔剂的用量为聚合物干重的20%。
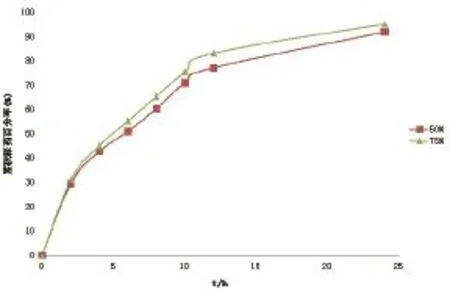
图3 抗粘剂用量对微丸释放的影响
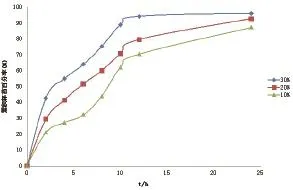
图4 致孔剂用量对微丸释放的影响
2.4.5 熟化时间 包衣完成后,微丸需经过熟化使衣膜才能完全聚结。将同一批微丸置于烘箱中,以40℃进行熟化,熟化时间分别为5﹑10﹑24﹑48h,测定其释放度,结果见图5。由结果可知,微丸的释药速率最初随熟化时间的增加而逐渐降低;而24h和48h微丸的释放曲线并无显著差异,说明当释药速率随熟化时间增加而降低到一定的程度后,熟化时间对药物释放的影响已不显著。考虑缓释效果和时间成本,确定熟化时间为24h。
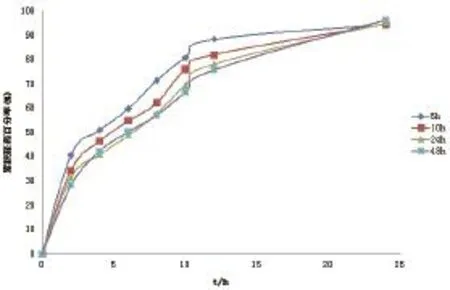
图5 熟化时间对微丸释放的影响
2.4.6 工艺结果验证 按前文中确定的最佳处方制备缓释微丸3批,并分别测定其释放度。结果见图6。由图中可知,所得3批缓释微丸的释放曲线间并无显著性差异,且达到缓释要求,该制备工艺重现性好。
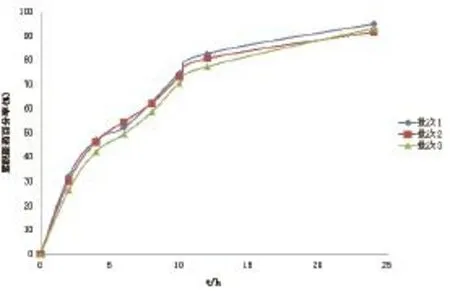
图6 3批微丸样品的释放度考察
2.5 释放度影响因素考察
2.5.1 释放介质 分别选用水﹑0.1mol/L HCl和pH6.8 PBS缓冲液作为释放介质,考察不同释放介质对微丸释放度的影响,结果见图7。发现缓释微丸在3 种介质中的释放度曲线存在明显差别,以水和pH6.8 PBS缓冲液为释放介质时,药物释放缓慢且释放不完全。在0.1mol/L HCl中,药物基本释放完全,且10h药物累积释放超过90%。
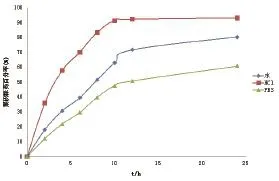
图7 释放介质pH对微丸释放的影响
2.5.2 转速 调整转速为50﹑75﹑100r/min,分别考察不同转速对微丸释放度的影响,结果见图8。由图可知,不同转速对微丸的释放并无明显影响。
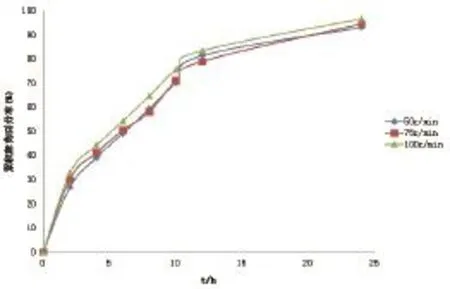
图8 转速对微丸释放的影响
2.6 释药模型的拟合
分别采用几种常用的数学模型对微丸的释放曲线进行线性拟合[7-10]。拟合结果见表1,其中Q为累积释药率,t为取样时间。由表中的拟合方程可知,所得微丸的释放曲线与一级释放模型最为吻合。
3 讨论
厄贝沙坦作为高血压治疗的一线药物,需长期服药,制备成缓释制剂可减少用药次数,维持稳定的血药浓度。微丸剂由多个单元组成,相较于一个单元构成的剂型具有分散均匀,局部刺激性小,生物利用度高,载药范围较宽,释药稳定的特点。可以避免因个别单元的制备失误而对释药行为产生严重影响,使制剂的释药行为重复性良好[11]。
本实验采用喷雾干燥法,以PEG 6000为致孔剂,滑石粉为抗粘剂,采用Eudragit NE30D和Eudragit L30D-55水分散体为包衣材料,制备了厄贝沙坦缓释微丸,通过调整两种包衣材料的比例调节药物释放速率。Eudragit NE30D为pH非依赖型成膜材料,成膜温度低,抗张强度良好,渗透性适中[12],不溶于水和消化液; Eudragit L30D-55是肠溶性的包衣材料,当pH≥5.5时即可溶解[13],加快药物释放;因此通过适当调节两种材料的配比,即可有效控制缓控释制剂的释药速率[14]。水分散体包衣膜须经过熟化,使膜完全愈合[15]。熟化时间过短,衣膜不够致密;时间过长则会使衣膜变脆。结果发现40℃干燥24h能达到较好的缓释效果。
微丸的释药不仅受包衣材料的影响,也受到胃肠道环境因素的影响,本实验考察了不同pH值及转速对药物释放度的影响[16]。通过释放度影响因素考察实验可知,微丸的释药行为受释放介质的pH值影响较大,说明该缓释微丸的释放对外界的pH环境有较大的依赖性。最终确定以转篮法作为释放度的测定方法,转速100r/min,前2h以0.1 mol/L HCl溶液为释放介质,2h后以pH6.8 PBS缓冲溶液为释放介质,以模拟人体内环境。
本实验制备的缓释微丸释药平稳,能降低药物不良反应,提高治疗效果。模型拟合结果表明,药物的整个释放过程表现为一级释药过程。
[1] Millar Craig MW,Bishop CN,Raftery EB. Circatian variation of blood pressure [J]. Lancet,1978,1:795.
[2] William B,White MD.Importance of aggressive blood pressure lowering when it may matter most[J].Am J Cardiol,2007,100(3A):10-16.
[3] 陈盛君,朱家壁.缓控释微丸制剂的研究进展[J].国外医学(药学分册),2004,31(3):177.
[4] Huang JJ,Xie J,Huang CY,et al.Study and research application of membrane control pellets[J].Pharm Clin Res,2011,19(1):42-46.
[5] Gosse P,Schumacher H. Early morning blood pressure surge[J].J Clin Hypertens(greenwich),2006,8(8):584-589.
[6] 熊思敏,吕竹芬,谢青春.高效液相色谱法测定厄贝沙坦缓释片的含量[J].中国药师,2008,11(2):205.
[7] Korsmeyer RW,Gurny R,Doelker E,et al.Mechanisms of solute release from porous hydrophilic polymers [J].Int J Pharm,1983,15(1):25-35.
[8] Schwartz JB,Simonelli AP,Higuchi W I. Drug release from wax matrics I.Analysis of data with first-order kinetics and with diffusioncontrolled model[J].J Pharm Sci,1968,57(2):274-277.
[9] Higuchi T.Mechanism of sustained-action medication. Theoretical analysis of rate of release of solid drugs dispersed in solid matrices[J].J Pharm Sci,1963,52(12):1145-1149.
[10] Peppas NA.Analysis of fickian and non-fickian drug release from polymers[J].Pharm Acta Helv,1985,60(4):110-111.
[11] 陆斌.药物制剂新剂型与新技术[M].北京:人民卫生出版社,2005:448.
[12] Pan X,Liu Y,Xiao YJ,et al.Preparation and quality evaluation of a novel multi-unit dosage form by compaction of enteric pellets[J].Chin J New Drugs,2010,19(4):313-318.
[13] Pan X,Chen M,Han K,et al.Novel compaction techniques with pellet-containing granules[J].Eur J Pharm Biopharm,2010,75(3):436-442.
[14] 黄坚彤,陈玲.影响薄膜包衣的工艺因素[J].广东药学,2001,11(1):25.
[15] Han K,Jiang SP,Chen B,et al.Preparation of doxycycline hyclate modified-release pellets[J].Chin J Antibiot,2009,34(4):241-244.
[16] Xu LS,Lro YF,Jia F,et al.Preparation and in vitroin vivo evaluation of none gastric resident dipyridamole (DIP) sustained-release pellets with enhanced bioavailability[J].Int J Pharm,2012,422(1/2):9-16.
Preparation of irbesartan sustained-release pellets and in vitro drug release investigation
YE Xingchen LV Zhufen CHEN Yanzhong
Institute of Pharmacology, Guangdong Pharmaceutical University,Key Laboratory of New Dosage Forms of Drugs, Guangzhou 510006, China
Objective To prepare irbesartan sustained-release pellets, and to investigate the in vitro release. Methods To prepare irbesartan sustained-release pellets by using of mini-fluidized bed spray coater with the aqueous dispersion coating material combined the acrylic resins of Eudragit NE30D and Eudragit L30D-55. To investigate the influence of different release medium and speed on drug release profile in vitro. Results The proportion of Eudragit NE30D/Eudragit L30D-55 in optimizational formula of coating was 4︰ 1, the amount of antisticking agent and pore-forming agent dry weight of polymer was respectively 75% and 20%, the weight had increased 10% with aging 24h. The pH of release medium has the most significantly influence, the process of in vitro release was accorded with first-order drug release model. Conclusion The preparation of irbesartan sustainedrelease pellets is successful, and the in vitro release of which is meet the requirement.
Irbesartan; Sustained-release pellets; In vitro release
R943
A
2095-0616(2015)16-44-04
2015-05-29)
▲通讯作者
