长江干流浮游植物群落结构的DGGE分析*
2015-12-02米铁柱
孙 静,甄 毓,米铁柱**
(1.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;2.聊城大学生命科学学院,山东 聊城 252000)
长江是中国第一大河,研究长江干流的浮游植物生物多样性具有重要意义。长江三峡水利枢纽工程(三峡工程)是世界上最大的水电水利枢纽工程,它的建成在产生巨大综合效益的同时,也改变了生源要素的时空分布,使得浮游生物的组成和数量发生改变,进而影响整个水生态系统的结构,对库区、下游、乃至近海的生态与环境带来了广泛而深远的影响。
三峡大坝建成以后,长江水体原来的水文环境发生了巨大改变:库内水流变缓,透明度显著升高,水体滞留时间大大延长,加上较高的营养盐浓度更适宜藻类的生长,增加了藻华暴发频率。因而,近年来,有关长江浮游植物分布特征的研究受到了越来越多的生态学家关注。但这些研究多专注于长江口及其临近海域、三峡库区[1-7],而对整个长江干流水域的研究则较少[8-9]。本研究运用变性梯度凝胶电泳技术(Denaturing gradient gel electrophoresis,DGGE),针对浮游植物18SrDNA基因,对2006年4及9月长江干流涪陵以下25个站位的浮游植物多样性进行了研究,对浮游植物的总体分布格局及其与环境因子的关系进行了探讨。
1 材料与方法
1.1 调查区域及样品采集
2006年4 、9 月分别对长江干流的25个站位进行样品采集工作(采样站位见图1)。一部分水样首先用200目的筛绢过滤,然后将过滤后的江水用0.45μm孔径的硝酸纤维素膜过滤,将滤膜转移至2mL离心管中,置于-20℃保存,用于浮游植物群落多样性的分析。另一部分水样用孔径0.45μm的聚醚砜滤膜过滤(滤膜预先在1∶1 000HCl中浸泡48h以上,后用超纯水清洗数遍,45℃烘干,备用),滤液装于2个100mL聚乙烯瓶中(样品瓶预先在1∶5HCl中浸泡48h以上,后用超纯水清洗数遍,然后包上洁净的塑料袋,备用),其中一份-20℃冷冻保存,用于测定硝酸盐(NO3-N)、氨氮(NH4-N)、磷酸盐(PO4-P)浓度;另一份加入1滴氯仿常温避光保存,用于测定硅酸盐(SiO3-Si)浓度。
1.2 DNA的提取
参照Sinha等[10]的方法并进行改进。用500μL TE缓冲液(10mol/L Tris-HCl,1mmol/L EDTA)悬浮藻细胞;加入600μL预热到55℃的抽提缓冲液(3%CTAB,1%Sarkocyl,20mmol/L EDTA,1.4mol/L NaCl,0.1mol/L Tris-HCl,1% α-Mercaptoethanol),55℃处理60min;加入1mL氯仿∶异戊醇(24∶1,V/V),14 000r/min,4℃离心10min;小心取上清液,加入1/10体积的醋酸钠(3mol/L,pH=5.3)和2倍体积的冰冷无水乙醇,放置于-20℃使DNA沉淀2h,14 000r/min,4℃离心10min;70%乙醇洗涤2次;真空抽干,40μL TE缓冲液溶解。
1.3 PCR及琼脂糖电泳检测
PCR扩增所用引物为真核生物通用引物F1427(5’-CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCC-CCGCCCCTCTGTGATGCCCTTAGATGTTCTGGG)和R1616(5’-GCGGTGTGTACAAAGGGCAGGG)[11]。PCR扩增程序为94℃,5min;94℃变性30s,52℃退火1min,72℃延伸90s,30个循环;72℃延伸10min。用1%的琼脂糖凝胶对PCR 产物进行电泳检测。

图1 长江干流2006年4月、9月样品采集站位图Fig.1 Sampling stations
将5μL扩增的产物与1μL上样缓冲液混合后上样,1%琼脂糖凝胶电泳,100V恒压电泳30min,在含0.5μg/mL溴化乙锭的1×TAE缓冲液中染色10~30min,用凝胶成像系统进行拍照。
1.4 DGGE分析
采用Bio-Rad公司DcodeTM的基因突变检测系统对PCR反应产物进行DGGE分析。DGGE电泳条件为:10%的聚丙烯酰胺凝胶,变性剂浓度从30%到55%,150V,1×TAE缓冲液中电泳8h。电泳完毕后,将凝胶置于0.5μg/mL溴化乙锭溶液中震荡染色20min,凝胶成像系统拍照。
1.5 主要理化因子的测定
本研究所用硝酸盐、氨氮、磷酸盐、硅酸盐浓度均利用AAIII型营养盐自动分析仪(德国BRAN+LUEBBE公司)进行测定;悬浮颗粒物(SPM)的含量利用差重法测得。
1.6 图像处理及数据分析方法
使用Quantity One软件对图像进行处理。将图像的背景扣除后,对条带进行自动检测,然后手动进行确认。基于DGGE图谱,采用非加权配对算数平均法(Unweighted Pair Group Method with Arithmetic averages,UPGMA)对各站位间的相似性进行聚类分析。根据各条带的亮度,运用以下公式计算Shannon-Weaver多样性指数(H)

式中:ni为每条带的亮度峰值;N为每个泳道中所有条带亮度峰值的和[12]。
利用Canoco软件(version 4.51)进行典范对应分析(Canonical correspondence analysis,CCA)以揭示物种多样性和环境因子的关系[13]。主要过程为用automated forward selection method去除variance infla-tion factor(VIF)大于20的环境因子,利用 Monte Carlo permutation test(499permutations)选择与物种组成显著相关的环境变量。
2 结果与分析
2.1 PCR产物的琼脂糖电泳检测
PCR扩增产物的大小约为230bp。从图2可以看出,每个站位的DNA提取物经PCR扩增后均得到了一条特异性条带。说明该对引物具有较好的特异性,扩增产物适合用于DGGE分析。
2.2 DGGE分析结果
从DGGE电泳图谱来看(见图3),2006年4、9月份长江干流各观测站均呈现较高的浮游植物多样性:4月份各站位共呈现42条不同的条带,各站位之间无共有条带及特有条带,丰都与镇江浮游植物多样性最低,DGGE条带数为14,而巫山条带数高达27,几乎为丰都及镇江的2倍;9月份各站位共39条不同条带,仅有2条带是各站位的共有条带,浮游植物多样性在各站位间的变化也比较显著,条带数介于11(涪陵)~26(大通)之间(见图4)。除云阳镇、南津关、大通和南京外,其余各采样点4月份与9月份的浮游植物多样性较为相近。
基于Dice相似系数,采用UPGMA聚类分析的方法,对4、9月份DGGE图谱相似性进行分析。从图5可以看出,4月份各站位的聚类结果与9月份极为相似,基于各站位的物种组成聚类的结果很好地反应了它们所属站位的空间分布格局。4月份长江干流各站位聚为3类,3类站位分别位于三峡库区、长江中下游及感潮河段。第一类又分为3个小的分支:涪陵、丰都、忠县和万州这4个站位均位于上游河段;云阳镇、奉节、巫山和巴东4个站位位于三峡库区的尾部;云阳、新滩镇和香溪3个站位聚在一起,组成1个小的分支。第二类中的10个站位也分为3个小的分支:三斗坪(坝下)、南津关、葛洲坝下、荆州和监利5个站位均紧邻三峡大坝;洪湖、汉阳和黄石3个站位均位于洞庭湖的下游附近;城陵矶和安庆分别位于洞庭湖与鄱阳湖的出口。第三类群包括位于鄱阳湖下游的镇江、大通、南京和江阴4个站位,DGGE图谱相似性系数最高,说明这几个站位所揭示的浮游植物多样性最为相似(见图5A)。

图2 长江干流2006年4、9月浮游植物样品PCR扩增产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of phytoplankton samples from the Yangtze River in April and September 2006
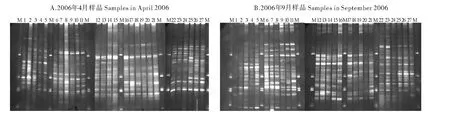
图3 长江干流2006年4、9月浮游植物样品PCR扩增产物的DGGE指纹图谱Fig.3 Denaturing gradient gel electrophoresis(DGGE)fingerprints of phytoplankton samples from the Yangtze River in April and September 2006
9月份各站位共聚为4类,其中4类中的3个类群基本和4月份相同,且各类群间的相似性高于4月份。与4月份所不同的是,涪陵与丰都2个采样点单独聚为一支,与其它各站位的相似性较低(见图5B)。
2.3 CCA分析结果
首先用软件Canoco进行DCA分析,结果表明最大梯度值分别为2.554和2.022(>2.0),且经验证,本研究中所有理化因子的VIF值均<20,因此选择典范对应分析对4、9月份样品进行分析,从而进一步探讨DGGE所揭示的物种多样性和相关环境因子的关系(见图6)。

图4 2006年4月及9月各采样点的DGGE图谱条带数Fig.4 Numbers of DGGE bands for each sampling station in April and September 2006

图5 基于DGGE图谱的UPGMA聚类分析结果Fig.5 Results of UPGMA cluster analysis based on DGGE patterns
第一轴反映的浮游植物组成与环境因子的相关性系数较高(见表1),分别为0.955(4月)和0.899(9月);前两轴的浮游植物组成与理化因子的特征参数累积变化率达到71.7%(4月)和71.9%(9月),说明浮游植物多样性与本研究中所涉及的理化参数具有较好的相关性。表1中还列出了由CCA分析得到的各环境因子与前两轴的相关系数。可以看出,硅酸盐与2个月的浮游植物组成具有较强的相关性,相关系数分别为0.770 2(4月)和0.863 2(9月)。4月份浮游植物组成还与悬浮颗粒物相关性较强,悬浮颗粒物与第一轴的相关系数仅次于硅酸盐,为0.746 7;而氨氮则与9月份浮游植物组成相关性较强,与第一轴相关系数为-0.717 0。此外,磷酸盐和悬浮颗粒物分别在4和9月份的浮游植物组成中也起着重要作用,与第二轴的相关性系数较大。可见,CCA分析能够很好地反映浮游植物多样性与理化因子的关系。
3 讨论
本研究运用DGGE技术对2006年平水期(4月)及丰水期(9月)长江干流的浮游植物多样性进行了研究。结果表明,4与9月各站位的条带数差异并不大,各站位间的共有条带很少,说明整个长江干流浮游植物类群存在较大的差异,浮游植物种类较为丰富。9月份大多数站位的浮游植物种类要多于4月份;位于库区的站位与其它站位相比,浮游植物种类并未呈现明显偏高的趋势。

图6 环境变量与DGGE揭示的物种区域多样性的CCA分析Fig.6 Canonical correspondence analysis biplot of species regional differences revealed by DGGE fingerprints constrained to environmental variables
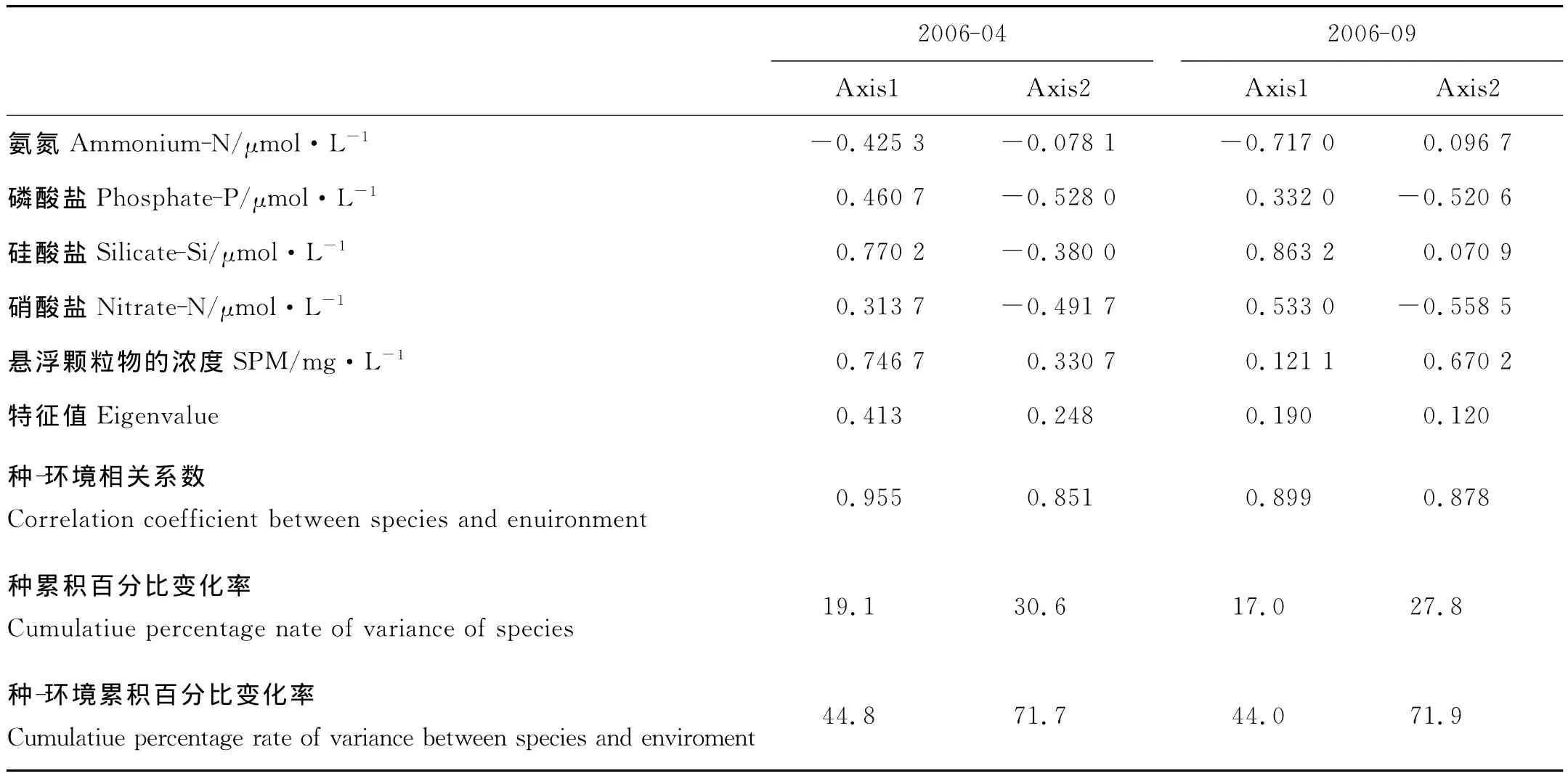
表1 CCA分析结果总结Table 1 Summary results of the canonical correspondence analysis
DGGE技术在对微生物多样性研究中的有效性已经得到了很好的印证[14-16],而利用这一技术对浮游生物时空分布研究尚不多见:Yan等[17]运用DGGE技术对东湖的浮游生物群落多样性进行了研究,Sun等[18]对东黄海浮游植物的分布进行了研究;研究结果均表明浮游生物群落组成的DGGE图谱可以很好地反映其相应的生态环境。在本研究中,基于各站位浮游植物组成进行聚类的结果与它们在长江干流的分布格局基本是一致的(见图5)。4月份,各个站位共聚为3大类,三类站位分别位于三峡库区,长江中下游及感潮河段。其中第一类又分为3个小的分支:涪陵,丰都,忠县和万州均位于上游河段,此处的生态环境更接近于自然江段;云阳镇,奉节,巫山和巴东4个站位位于三峡库区的尾部,由于三峡库区2006年蓄水至156m,此处的水位已有抬高,流速减慢,为浮游植物提供了有利的生长环境;云阳,新滩镇和香溪3个站位处的水位也被抬高,但同时均有小的支流汇入,导致这里的浮游植物群落发生了变化,并且在采样期间发现有水华的发生,所以这3个站位在聚类分析时聚为一支。第二类中的10个站位也分为3个小的分支:三斗坪(坝下),南津关,葛洲坝下,荆州和监利5个站位均位于三峡大坝的下游,经过大坝的截留效应,使这里的水文特征不同于上游河段,具有了自己较为独特的浮游植物组成;洪湖,汉阳和黄石位于洞庭湖的下游,这几个站位的江面比较开阔,流速缓慢,更有利于浮游植物的生长;而城陵矶和安庆分别位于洞庭湖与鄱阳湖的下游,由于与2湖的距离较近,2个站位受2湖的影响较为显著,此处的浮游植物部分来自于2湖,故2个站位具有更多的相似性。而9月份聚类分析的结果与4月份略有不同,涪陵与丰都独自聚为一支,与其它站位的相似性较低,初步推测可能是由于9月份过高的悬浮颗粒物浓度所致(见图7)。对于长江而言,泥沙等悬浮物是影响水体透明度的主要因素,而水体的透明度直接影响了浮游植物的生长。此外,9月份长江处于丰水期,径流量大,此时在4月份受两湖影响比较显著的城陵矶和安庆2个站位在聚类分析时不再聚为一类。由聚类分析的结果表明,DGGE技术可以有效地对长江干流的浮游植物多样性进行研究,各站位的物种组成聚类的结果很好地反映了它们所属站位的空间分布格局。根据2004年7—8月(雨季)和2005年5月(旱季)长江各站点的浮游植物生物量和主要营养盐数据做聚类分析[19],由雨季的聚类分析结果表明,所有站点可以分成2类,中下游从洪湖到江阴为一类,而涪陵到中游的监利为一类,与本研究具有较高的一致性,说明浮游植物基本上是按照其所属环境格局进行分布;而在旱季各站点可以归为3类,没有较为显著的分布特征,与本研究有一定差异。导致这种差异性的主要原因可能是:2研究所采用的方法不同,由于传统的检测生物量的方法与分子生物学方法具有不同的灵敏度,进而会导致实验结果的差异;此外,研究的站位及调查取样的时间不同,也会导致分析结果的偏差。总之,基于DGGE图谱的聚类分析结果得到的浮游植物的区域分布,反映了各类群所属海域的环境特征,PCR-DGG技术在该水域的浮游植物群落区域性分布研究中取得了很好的结果。

图7 2006年4月及9月长江干流悬浮颗粒物的沿程分布Fig.7 The distribution of SPM concentrations in the Yangtze River in April and September 2006
在CCA分析结果的双序图中,清楚地看出各站位浮游植物对于不同生态环境的要求,并且对环境条件要求相近的站位在图中的位置较为接近。环境因子用带有箭头的线段(矢量)表示,箭头连线与排序轴的夹角表示该环境因子与排序轴相关性的大小,箭头所指的方向表示该环境因子的变化趋势[13]。本研究中,CCA分析结果的双序图表明了各环境因子对各站位的影响(见图6A):4月份组Ⅰ主要是受悬浮颗粒物和硅酸盐的影响,组Ⅲ受氨氮的影响比较显著,而组Ⅱ与本研究中所涉及到的理化因子的相关性均较小。从图6B中可明显看出9月份各站位与环境因子的相关性:组Ⅰ与硅酸盐有较强的正相关,组Ⅱ主要受氨氮的影响,与之呈现较强的相关性。此外,2个月份的CCA双序图表明,涪陵,丰都2个站位均受悬浮颗粒物的影响较大。在本次调查期间,2个月份的浮游植物群落组成均与硅酸盐的相关性较强。Yan等[3]运用DGGE技术对2006年4月份位于三峡库区10个站位(香溪河及长江干流各5个)的真核浮游生物的研究,也表明了硅酸盐这一理化因子的重要性。
浮游植物没有或仅有微弱的运动能力,主要是随波漂流。因此,水流对其分布有着重要影响。长江是一个处于动态的水体,水流必然在浮游植物的组成中起着重要作用。但在本研究中,由于缺乏流速的数据,未能将其纳入CCA的分析当中,因而可能会导致分析结果的某些偏差。有关研究表明,长江干流浮游植物的数量及生物量与营养盐无显著的相关性,决定长江干流浮游植物数量及生物量的是水文条件(主要是干流的水动力因素),并且长江干流硅酸盐的含量与水流量有着显著的正相关[19]。因此,悬浮颗粒物、硅酸盐与铵盐有可能是受长江干流的水文条件的影响比较显著,从而与浮游植物表现相似的变化规律,而并非与浮游植物的组成具有直接的因果关系。事实上,这种由于水文条件而决定浮游植物的数量及生物量的现象,在世界其它河流中也有报道[20-21]。
分子生物学方法在研究浮游生物多样性方面具有其它方法无法比拟的灵敏性[17],比起其它生物学方法,更适合用于细菌以及浮游生物等的分析[22],基于18S rDNA的DGGE技术在本研究中亦取得了很好的研究结果。在本次调查期间,硅酸盐、悬浮颗粒物和氨氮对浮游植物组成的影响较为明显,但是由于长江径流量的年际变动,影响浮游植物组成的理化因子也会有所不同。因此,要想获得更加详尽的结果,需要进一步的现场调查及探索。此外,由于不同的方法具有不同的灵敏度,基于形态学特征等的其它研究方法与本研究结果可能会存在一些差异,多种方法相互补充,会取得更加全面的分析结果。
[1]栾青杉,孙军,宋书群,等.2004年秋季长江口及其邻近水域浮游植物群集[J].海洋科学进展,2008,26(3):364-371.
[2]王云龙,袁骐,沈新强.长江口及邻近海域夏季浮游植物分布现状与变化趋势[J].海洋环境科学,2008,27(2):169-172.
[3]Yan Q Y,Yu Y H,Feng W S,et al.Plankton community composition in the Three Gorges Reservoir Region revealed by PCRDGGE and its relationships with environmental factors[J].Journal of Environmental Sciences,2008,20:732-738.
[4]郭沛涌,沈焕庭,刘阿成,等.长江河口中小型浮游动物数量分布、变动及主要影响因素[J].生态学报,2008(8):3517-3526.
[5]孙军,田伟.2009年春季长江口及其邻近水域浮游植物—物种组成与粒级叶绿素a[J].应用生态学报,2011,22(1):235-242.
[6]林军,朱建荣,张经,等.长江口外海区浮游植物生物量分布及其与环境因子的关系[J].水产学报,2011,35(1):74-87.
[7]江志兵,刘晶晶,李宏亮,等.丰水期长江感潮河口段网采浮游植物的分布与长期变化[J].生态学报,2013,33(18):5917-5925.
[8]Zeng H,Song L R,Yu Z G,et al.Post-impoundment biomass and composition of Phytoplankton in the Yangtze River[J].International Review of Hydrobiology,2007,92(3):267-280.
[9]杨浩.三峡水库蓄水对长江干流浮游植物群落物种组成的影响研究[D].重庆:西南大学,2012.
[10]Sinha R P,Dautz M,Hder D-P.A simple and efficient method for the quantitative analysis of thymine dimers in cyanobacteria,phytoplankton and macroalgae[J].Acta Protozool,2001,40:187-195.
[11]Van Hannen E J,Van Agterveld M P,Gons H J,et a1.Revealing genetic diversity of eukaryotic microorganisms in aquatic environments by denaturing gradient gel electrophoresis[J].Journal of Phycology,1998,134:206-213.
[12]Magurran A E.Ecological Diversity and Its Measurement[M].Princeton:Princeton University Press,1988:179.
[13]Ter Braak C J F.Canonical correspondence analysis:a new eigenvector technique for multivariate direct gradient analysis[J].E-cology,1986,67:1167-1179.
[14]Sapp M,Wichels A,Wiltshire K H,et al.Bacterial community dynamics during the winter-spring transition in the North Sea[J].FEMS Microbiol Ecology,2007,59:622-637.
[15]Singh S K,Ramaiah N.Denaturing gradient gel electrophoresis profiling of bacterial communities composition in Arabian Sea[J].Journal of Environmental Biology,2011,32:339-346.
[16]Sun S Y,Guo Z G,Yang R L.Analysis of microbial diversity in tomato paste wastewater through PCR-DGG [J].Biotechnology and Bioprocess Engineering,2013,18:111-118.
[17]Yan Q Y,Yu Y H,Feng W S,et al.Genetic diversity of plankton community as depicted by PCR-DGGE fingerprinting and its relation to morphological composition and environmental factors in Lake Donghu[J].Microbial Ecology,2007,54:290-297.
[18]Sun J,Yu Z G,Gao Y H,et al.Phytoplankton diversity in the East China Sea and Yellow Sea measured by PCR-DGGE and its relationships with enviromental factors[J].Chinese Journal of O-ceanology and Limnology,2010,28(2):315-322.
[19]曾辉.长江和三峡库区浮游植物季节变动及其与营养盐和水文条件关系研究 [D].武汉:中国科学院水生生物研究所,2006.
[20]Huszar V L M,Reynolds C S.Phytoplankton periodicity and sequences of dominance in an Amazonian flood-plain lake (Lago Batata,Pará,Brasil):responses to gradual environmental change[J].Hydrobiologia,1997,346(1-3):169-181.
[21]Luigi N F.Phytoplankton assemblages in twenty-one Sicilian resevroirs:relationships between species composition and environmental factors[J].Hydrobiologia,2000,424:l-11.
[22]Savin M C,Martin J L,LeGresley M,et al.Plankton Diversity in the Bay of Fundy as measured by morphological and molecular methods[J].Microbiol Ecology,2004,48:51-65.
