海带多糖对黄嘌呤氧化酶的抑制作用及对小鼠高尿酸血症的调节*
2015-12-02焉翠蔚田友昊
焉翠蔚,李 晶,姜 柳,田友昊,常 宝
(中国海洋大学1.海洋生命学院;2.食品科学与工程学院,山东 青岛 266003)
近年来,中国高尿酸血症患病率明显上升,患者的发病年龄提前,呈年轻化趋势。高尿酸血症是一种因体内嘌呤代谢紊乱引起的代谢性疾病,其发病原因主要是由于机体内尿酸生成过多,排泄减少,或者二者同时作用[1]。高尿酸血症是痛风的生化特征,据统计,大约有5%~12%的高尿酸血症最终会发展成为痛风[2]。持续性的高尿酸血症会引起高血压、高血脂、心血管疾病、慢性肾病等并发症的发生[3-5]。
目前用于高尿酸血症临床治疗的药物主要有2类:(1)降尿酸药物,代表药物为别嘌呤醇,主要通过抑制嘌呤代谢关键酶黄嘌呤氧化酶(XOD)的活性,降低体内尿酸的含量;(2)促尿酸排泄药物,此类药物主要有丙磺舒、苯磺唑酮、溴苯马隆,能够帮助肾脏排出体内多余的尿酸[6]。别嘌呤醇是XOD的竞争性抑制剂,一直被作为一线药物用于临床高尿酸血症和痛风的治疗。在临床上,别嘌呤醇存在一些严重的毒副作用,在一定程度上限制了其安全使用。目前,利用化学合成与微生物发酵的方法得到的XOD抑制剂虽然在体外对XOD具有良好的抑制作用,但都未能成功应用于高尿酸血症的临床治疗。因此,从天然生物材料中寻找新型无毒高效的抗高尿酸血症药物已经成为目前抗高尿酸血症药物研究的热点问题。
海带多糖具有调节免疫、抗肿瘤、抗凝血、降血脂、降血糖、抗辐射、抗突变、抗体内氧化和耐缺氧等多种生物学活性[7],但有关其调节体内XOD活性,降低血清尿酸水平的报道较少。本实验研究了海带多糖体外对XOD的抑制作用,并通过腹腔注射氧嗪酸钾建立小鼠高尿酸血症模型,研究海带多糖对高尿酸血症小鼠的降尿酸效果。
1 材料与方法
1.1 材料
新鲜海带采购于青岛市齐东路水产品市场,将清洗后的海带用蒸馏水反复冲洗,烘干至恒重,粉碎,过60目筛,放入密封袋内贮存备用。
雄性昆明种小鼠60只,体重(33.0±2.2)g,购于青岛市药品检验检疫所。
1.2 试剂和仪器
DEAE-52纤维素凝胶、Sephadex G-200葡聚糖凝胶为天津博迪化工股份有限公司产品;黄嘌呤(Xanthine)、黄嘌呤氧化酶(Xanthine Oxidase,X1875)为Sigma公司产品;别嘌呤醇(Allopurinol)为上海宝曼生物科技有限公司产品;氧嗪酸钾(Potassium Oxonate)、羧甲基纤维素钠(CMC-Na)为北京华迈科生物技术有限公司产品;其它实验试剂均采用国产分析纯。
电子天平(FA1004型);集热式磁力搅拌机(DF-101S型);高速冷冻离心机(HC-3018R型);旋转蒸发仪(N-1100型);FT-IR红外光谱仪(Nexus-470型);紫外可见分光光度计(UV-2800型);全自动血液生化分析仪(BS-200型)。
1.3 方法
1.3.1 海带多糖的制备[8]称取海带干粉10g,以1∶40的料液比加入蒸馏水,70℃水浴浸提4.5h,离心,取上清;将上清液用旋转蒸发仪真空减压浓缩,Sevag法除去蛋白质[9],加入95%乙醇4℃,静置过夜,离心收集沉淀,分别用无水乙醇、丙酮反复洗涤沉淀,真空抽滤,冷冻干燥,得海带粗多糖。采用DEAE-52纤维素离子交换柱和Sephadex G-200凝胶柱层析对海带多糖进行分离纯化[10],收集最大洗脱峰,冷冻干燥得纯品,所得海带多糖为淡黄色粉末,易溶于水,不溶于如乙醇、丙酮等有机溶剂,苯酚-硫酸法[11]测定纯化后海带多糖的总糖含量为91.8%。参照文献[1]方法,测得该多糖的相对分子量约为9.2×104。多糖酸性水解物经纸层析检查[13],发现多糖中含有岩藻糖、葡萄糖、半乳糖和木糖。
1.3.2 海带多糖红外光谱测定[14]取纯化后的多糖样品5mg,KBr研磨压片后,在4 000~500cm-1的波数范围内测定海带多糖的红外光谱图。
1.3.3 体外海带多糖对XOD活力的影响 XOD酶活力的测定原理是XOD能够催化底物黄嘌呤产生尿酸,尿酸在波长294nm处有特征吸收峰。参照文献[15]的方法,反应体系总体积为5mL,在试管中依次加入2.0mL底物黄嘌呤溶液,2.6mL磷酸缓冲液(0.2mol/L,pH=7.5)和0.2mL海带多糖溶液(浓度分别是0.2、0.4、0.6、0.8、1.0、1.2mg/mL),25 ℃水浴10min,再加入25℃预温的酶液(4μg/mL)0.2mL,充分混匀,反应1min,用紫外分光光度计测定OD294值,每个样品平行操作3次。以公式I(%)=(1-B/A)×100%计算不同浓度海带多糖对XOD的相对抑制率(I)。其中,A为不加抑制剂(海带多糖)的XOD的活力,B为加入抑制剂后的XOD的活力。将海带多糖浓度与抑制率进行线性回归得回归方程,计算抑制率为50%的海带多糖浓度,即半抑制浓度(IC50)。
1.3.4 海带多糖与别嘌呤醇对XOD的联合抑制作用采用等毒法[16],将海带多糖与别嘌呤醇单独使用时对XOD的抑制率分别达到25%时所需的剂量混合,测定二者的混合物对XOD联合抑制率的大小(实测抑制率),预期抑制率为50%,根据下面的公式求出共毒系数,评价海带多糖与别嘌呤醇的混合物对XOD的联合抑制作用。
共毒系数=(实测抑制率(预期抑制率)/预期抑制率)×100。
1.3.5 小鼠实验分组和给药[17]实验小鼠购回之后于动物房中进行适应性喂养,室温(23±2)℃,12∶12h明暗交替。小鼠自由摄食和饮水,7d后,将60只小鼠随机分为6组,分别为正常组、模型对照组、别嘌呤醇组、海带多糖高剂量组、海带多糖中剂量组和海带多糖低剂量组。
小鼠每天下午14:00灌胃给药一次,正常组和模型对照组分别给等剂量的0.5%CMC-Na;别嘌呤醇作为阳性对照组按10mg/kg·d给药;海带多糖高、中、低剂量组分别按照1 000、500、250mg/kg·d的剂量给药,连续给药7d。末次给药1h前,除正常组外,其余各组小鼠按照300mg/kg的剂量腹腔注射氧嗪酸钾,抑制尿酸酶的活性,提高小鼠的血清尿酸水平,建立高尿酸血症模型。给药1h后,各组小鼠摘眼球取血,血液在室温凝结0.5h,2 500g离心10min,分离血清,4℃保存待测。
1.3.6 血清尿酸水平的测定 取血清,由中国海洋大学校医院采用全自动血液生化分析仪测定各组小鼠的血尿酸值,对结果数据进行组间差异性比较。
1.3.7 肝脏XOD活性测定[18]解剖小鼠,取肝脏低温冷冻,加入5倍体积80mmol/L冰冷的焦磷酸缓冲液(pH=7.4)进行组织匀浆。肝组织匀浆3 000g离心10min,去除脂层,剩余组织液继续10 000g离心1h。取上清液用于检测肝组织的XOD活力。
采用总体积为5.5mL的反应体系,加入3.6mL浓度为50mmol/L的磷酸缓冲液、100μL肝脏提取液、100μL浓度为1mmol/L的氧嗪酸钾,37℃下反应15min。再加入1.2mL浓度为250μmol/L的黄嘌呤溶液,准确反应10min,最后加入0.5mL 0.58mol/L HCl溶液终止反应。将反应液3 000g离心5min,取上清液,在294nm下测定OD值。
1.4 数据处理
实验数据采用SPSS 19.0软件进行数据处理和统计分析,结果以平均值±标准偏差(珡X±S)表示。采用单因素方差分析进行各组样本平均数的比较,P<0.05说明组间差异显著,具有统计学意义;P<0.01说明差异极显著,具有统计学意义。
2 结果及分析
2.1 海带多糖红外光谱测定结果
海带多糖的红外扫描图谱见图1,图谱显示海带多糖具有多糖物质的特征吸收峰,其中3 288cm-1是—OH的伸缩振动,2 938cm-1是C—H 伸缩振动,1 320~1 372cm-1是C—H变角振动,1 261cm-1处是SO振动引起的,表明多糖中存在硫酸基[19],1 196cm-1为糖环内C—O的伸缩振动,1 019和1 082 cm-1是醇羟基—OH 的变角振动[20],883和927cm-1为β-吡喃环C—H变角振动[21],表明多糖中含有β-糖苷键。
2.2 体外海带多糖对XOD活力的影响
不同浓度海带多糖对XOD活力的影响结果见图2,当海带多糖浓度处于0~0.6mg/mL范围内时,海带多糖对XOD的抑制率随着浓度的增大而迅速升高;而当海带多糖浓度≥0.6mg/mL时,随着海带多糖浓度的升高,抑制率的增长趋于平缓。经过计算,海带多糖的半抑制浓度IC50为0.88mg/mL。

图1 海带多糖的红外光谱图Fig.1 FT-IR spectroscopy of Laminaria japonica polysaccharides
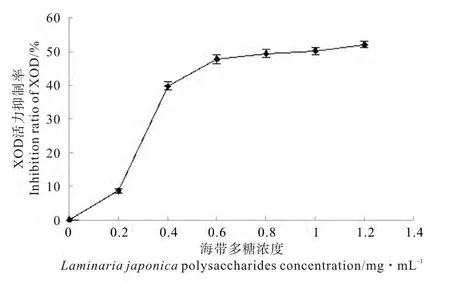
图2 不同浓度海带多糖对XOD活力的影响Fig.2 Effects of Laminaria japonica polysaccharides on the activity of XOD
2.3 海带多糖与别嘌呤醇对XOD的联合抑制作用
将海带多糖与别嘌呤醇单独使用时对XOD抑制率分别达到25%时的剂量进行混合。联合抑制作用结果显示,海带多糖与别嘌呤醇的混合物对XOD的实测抑制率为(63.11±1.54)%,明显高于预期抑制率(50%),其共毒系数为26.22±3.08,大于20,根据共毒系数理论,海带多糖与别嘌呤醇的二元混合物对抑制XOD活性具有协同作用,说明二者的联合使用可以有效提高对XOD的抑制率。
2.4 海带多糖对高尿酸血症小鼠血清尿酸水平的影响
不同剂量海带多糖和别嘌呤醇灌胃7d后对高尿酸血症小鼠血清尿酸水平的影响结果见表1。氧嗪酸钾腹腔注射小鼠预处理后,与正常组小鼠相比,模型对照组小鼠的血清尿酸水平显著提高,达极显著水平(P<0.01),说明高尿酸血症小鼠建模成功。别嘌呤醇组血尿酸值比模型对照组低65.65%,比正常组低36.68%,均达极显著水平(P<0.01),证明别嘌呤醇具有明显的降尿酸效果。海带多糖高、中、低剂量组小鼠血尿酸值与模型对照组相比分别降低了43.03%、35.89%和27.72%,其中高、中剂量组降尿酸效果达极显著水平(P<0.01),可见,实验剂量的海带多糖均可降低高尿酸血症小鼠的血尿酸水平,并且呈现良好的剂量依赖关系。海带多糖高、中剂量组的血尿酸值虽然仍高于正常组,但差异不显著(P>0.05),说明海带多糖对氧嗪酸钾所致的高尿酸血症具有明显的改善作用。
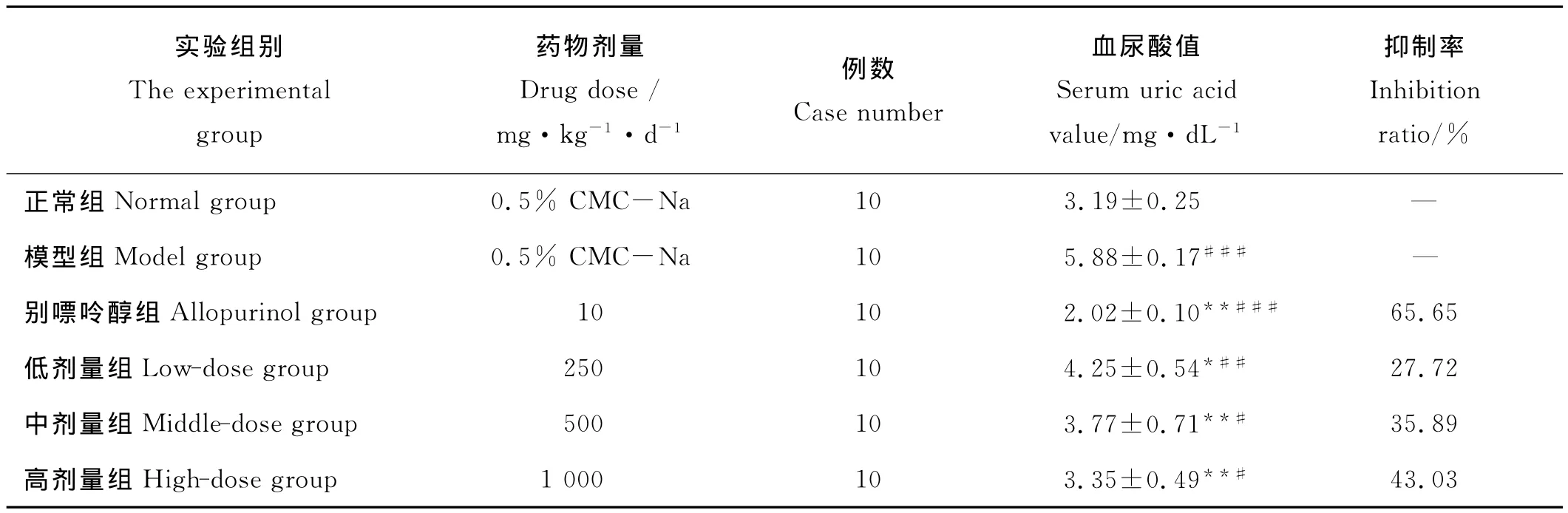
表1 海带多糖对高尿酸血症小鼠血清尿酸水平的影响Table 1 Effects of Laminaria japonica polysaccharides on serum urate levels in hyperuricemic mice
2.5 海带多糖对小鼠肝脏XOD活力的影响
由表2可见,模型对照组小鼠腹腔注射氧嗪酸钾后肝脏中XOD的活性显著高于正常组(P<0.01)。别嘌呤醇对高尿酸血症小鼠肝脏中的XOD具有极强的抑制作用(P<0.01),XOD活性降低了46.15%,已经低于正常组小鼠酶活水平。经过不同剂量海带多糖灌胃的高尿酸血症小鼠肝脏中XOD的活性比模型对照组降低了8.73%~17.46%,其中海带多糖高、中剂量组能够显著降低高尿酸血症小鼠肝脏中XOD的活性(P<0.05),并且与正常组小鼠相比差异不显著(P>0.05)。可见,不同剂量的海带多糖与别嘌呤醇对高尿酸血症小鼠肝脏中XOD的活性都存在抑制作用,但海带多糖的抑制作用比别嘌呤醇温和,可使高尿酸血症小鼠肝脏中XOD的活性基本恢复正常。
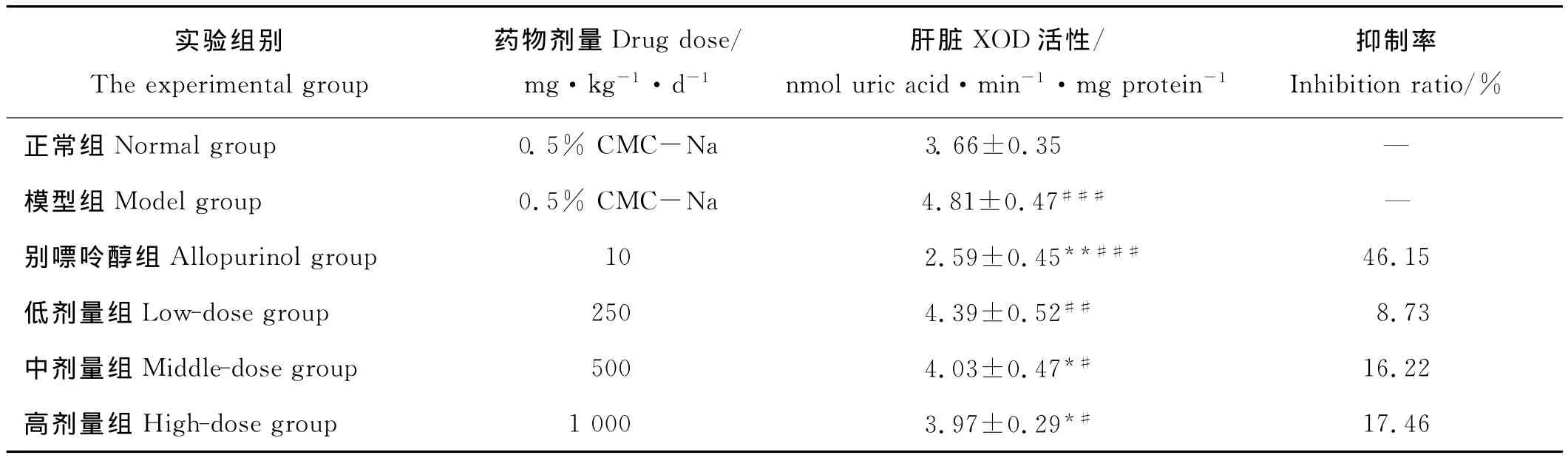
表2 海带多糖与别嘌呤醇对高尿酸血症小鼠肝脏中XOD活性的抑制作用Table 2 Inhibition of XOD activities in hyperuricaemic mice by administration of Laminaria japonica polysaccharides and allopurinol
3 讨论
XOD是嘌呤代谢过程中的关键酶,主要分布在肝脏与小肠中,能够催化机体内的次黄嘌呤生成黄嘌呤,并进一步氧化生成尿酸,体内XOD活性的升高,与高尿酸血症的形成有密切的联系[22]。黄嘌呤氧化酶抑制剂可抑制XOD的活性,阻碍机体内尿酸的合成,起到降尿酸的效果,用于治疗高尿酸血症。目前,已经上市应用最为广泛的一类黄嘌呤氧化酶抑制剂是别嘌呤醇,别嘌呤醇是XOD的一种自杀性底物,与底物竞争性结合XOD的活性位点Mo-pt,使XOD丧失催化活性,对XOD有极强的抑制作用,但在临床治疗中会产生很多毒副作用,如发热、过敏性皮疹、腹泻、肝功能损害、白细胞和血小板减少等副作用,限制了该药的广泛使用[23]。本实验结果表明海带多糖在体外对XOD具有明显的抑制作用,其抑制率随着海带多糖浓度的增大而升高,二者呈现一定的剂量依赖关系,虽然对XOD的抑制作用比别嘌呤醇弱,但海带多糖与别嘌呤醇对XOD表现为协同联合抑制作用,其共毒系数>20,说明二者在对XOD的抑制作用过程中起到互相增强的效果,联合使用海带多糖和别嘌呤醇优于二者单独使用。
海带多糖与别嘌呤醇对高尿酸血症小鼠血清尿酸水平的影响研究结果表明,别嘌呤醇能有效降低高尿酸血症小鼠血清尿酸水平,但其过强的药效使得血尿酸值低于正常水平。尿酸水平不仅是体内嘌呤代谢稳定的标识,还可能具有其他的生物化学功能。Burkhardt[24]发现,尿酸具有抗氧化的作用,Singhet[25]发现,尿酸具有防止DNA损伤的功能。因此,过度降低体内的尿酸水平可能会适得其反,造成机体的其他不良反应,本实验中观察到别嘌呤醇组多数小鼠毛色发暗,精神比较萎靡,尿量明显增多。海带多糖各实验剂量组与模型对照组相比都起到有效的降尿酸效果,并且呈现良好的剂量依赖效应。其中海带多糖高、中剂量组血清尿酸值与正常组小鼠相比无显著差异,基本恢复至正常水平。实验过程中海带多糖各剂量组小鼠生长状况、精神状态良好,与正常组小鼠相比均无明显差异,体重增长稳定,无死亡现象,证明海带多糖在饲喂过程中对小鼠的正常生长未产生影响,海带多糖在作为抗高尿酸血症药物方面是安全可靠的。同时,海带多糖高、中剂量组能够有效降低高尿酸血症小鼠肝脏中XOD的活性,使其基本恢复至正常水平,说明海带多糖可能通过抑制肝脏内XOD的活性起到降尿酸的效果,其具体作用机制还需进一步研究。
4 结语
本研究发现,海带多糖在体外对XOD具有明显的抑制作用,海带多糖与别嘌呤醇对XOD表现为协同联合抑制作用,尽管海带多糖对XOD的抑制作用比别嘌呤醇弱,但海带多糖对氧嗪酸钾所致的小鼠高尿酸血症有明显的降尿酸效果,并对小鼠肝脏中XOD抑制作用显著,同时安全无毒副作用,有望为今后抗高尿酸血症药物的开发提供新的材料。
[1]臧路平,刘志刚,吴新荣.高尿酸血症发病机制及其药物治疗研究进展[J].医药导报,2011,30(1):69-73.
[2]Rott K T,Agudelo C A.Gout[J].Journal of the American Medical Association[J].2003,289(21):2857-2860.
[3]Niskanen L K,Laaksonen D E,Nyyssonen K,et al.Uric acid level as a risk factor for cardiovascular and all cause mortality in middle-Aged men:aprospective cohort study[J].Archives of Internal Medicine,2004,164(14):1546-1551.
[4]Baker J F,Krishnan E,Chen L,et al.Serum uric acid and cardiovascular disease:recent developments,anywhere do they leave us?[J].The American Journey of Medicine,2005,118(8):816-826.
[5]Sundstrom J,Sullivan L,Agostino R B,et al.Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence[J].Hypertension,2005,45(1):28-33.
[6]刘佳,李玲.高尿酸血症的发病机制与药物治疗研究进展[J].国际药学研究杂志,2010,37(1):24-28.
[7]赖晓芳,沈善瑞.海带多糖生物活性的研究进展[J].生物技术通讯,2003,14(5):436-438.
[8]蔡彬新,周逢芳,姚玲灵.海带多糖的提取工艺[J].食品研究与开发,2012,33(9):80-82.
[9]李知敏,王伯初,周菁,等.植物多糖提取液的几种脱蛋白方法的比较分析[J].重庆大学学报,2004,27(8):57-59.
[10]张慧玲.海带多糖的分离纯化及化学结构的初步研究[D].哈尔滨:哈尔滨工业大学,2007.
[11]罗毅,潘细贵.苯酚-硫酸法测定多糖含量显色方法的优选[J].中国中医药信息杂志,2005,12(1):45-46.
[12]贾彦明,闵伟红.海带多糖的分离纯化及体外抗氧化作用的研究[J].农产品加工,2010,8:26-35.
[13]邢杰,刘守涛,高君,等.海带多糖的提取及组份LI的分离与鉴定[J].抚顺石油学院学报,1998,18(1):8-11.
[14]赵文竹,殷涌光,于志鹏,等.玉米须多糖微波提取工艺及其红外光谱结构分析[J].吉林大学学报,2012,42(2):515-520.
[15]焉翠蔚,赵庆娅,张珞,等.海带提取物对黄嘌呤氧化酶的抑制作用[J].中国海洋大学学报(自然科学版),2013,43(12):36-40.
[16]Mansour N A,Eldefrawi M E,Toppozada A,et al.Toxicological studies on the Egyptian cotton leafworm,Prodenia litura.VI.Potentiation and antagonism of organophosohorus and carbamateinsecticdes[J].Journal of Economic Entomology,1966,59(2):307-311.
[17]喻志峰,杨澄,仇熙,等.瑞香苷对高尿酸血症小鼠的影响[J].中国药科大学学报,2002,33(2):142-145.
[18]Ying Wang,Ji Xiao Zhu,Ling Dong Kong,et al.Administration ofProcyanidinsfrom grape seeds reduces serum uric acid levels and decreases hepatic xanthine dehydrogenase/oxidase activities in oxonate-treated mice[J].Basic &Clinical Pharmacology & Toxicology,2004,94(5):232-237.
[19]彭臻菲,方哲翔,刘敏,等.海带多糖纯化及清除自由基活性研究[J].食品工业科技,2013,34(15):80-83.
[20]夏朝红,戴奇,房韦,等.几种多糖的红外光谱研究[J].武汉理工大学学报,2007,29(1):45-47.
[21]张赛金,李文权,邓永智,等.海洋微藻多糖的红外光谱分析初探[J].厦门大学学报(自然科学版),2005,44:212-214.
[22]孔悦,张冰,刘小青,等.黄嘌呤氧化酶活性在高尿酸血症动物模型中的变化[J].北京中医药大学学报,2004,27(6):38-40.
[23]Sorbera LA ,Revel L,Rabasseda X,et al.Treatment of gout and hyper uricemia xanthine oxidase inhibitor[J].Drugs Future,2001,26(1):32-38.
[24]Burkhardt S,Reiter R J,Tan D X R,et al.DNA oxidatively damaged by chromium(III)and H(2)O(2)is protected by the antioxidants melatonin, N(1)-acetyl-N(2)-formyl-5-methoxykynuramine,resveratrol and uric acid[J].The International Journal of Biochemistry &Cell Biology,2001,33(8):775-783.
[25]Singh S,Farhan Asad,Hadi S M.Uric acid inhibits LDOPA-CU(II)mediated DNA cleavage[J].Neuroscience Letter,1998,258(2):69-72.
