根治性胃癌切除术中不同吻合术式对胃癌合并2型糖尿病患者术后血糖的影响
2015-12-02熊竹娟唐令超肖硕萌陈小东唐晓丽
周 祥,熊竹娟,唐令超,赵 平,丁 志,肖硕萌,陈小东,唐晓丽,周 进
(1.四川省肿瘤医院胃肠外科,成都610041;2.四川省肿瘤医院肿瘤内科,成都610041)
在我国恶性肿瘤的发病率和死亡率排序中,胃癌均居前列。以手术为主的综合治疗是治愈胃癌的唯一方式。随着我国生活水平的提高和人均寿命的增加,2型糖尿病亦成为危害身体健康的主要慢性疾病之一。胃癌合并2型糖尿病的患者人数也逐年增加,自1992年Pories等发现胃旁路手术可以使2型糖尿病的患者手术后血糖恢复正常,外科手术开始尝试应用于治疗2型糖尿病。远侧胃癌根治性术与此胃旁路手术有类似之处。本研究回顾性分析我院64例因胃癌行根治性远侧胃切除三种不同吻合方式的2型糖尿病患者术后空腹血糖的变化情况。
1 资料与方法
1.1 一般资料
选取2009年5月至2014年6月因胃癌在我院行根治性远侧胃切除术的714例胃癌患者中,合并2型糖尿病患者64例,均具有完整的临床病例资料。术前均经胃镜病理检查明确诊断为胃癌,无远处转移,且符合2006美国糖尿病协会(ADA)2型糖尿病的诊断标准[1]:空腹血糖 >7.0 mmol/L或糖尿病症状+随机血糖>11.1 mmol/L。男34例,女30例;年龄26~74岁;糖尿病史1~20年;64例胃癌合并2型糖尿病患者按吻合方式不同,分为3组,毕Ⅰ式吻合22例(A组),毕Ⅱ式+空肠侧侧吻合20例(B组),Roux-en-Y吻合22例(C组)。A组男14例,女8例,平均年龄59岁;B组男13例,女7例,平均年龄62岁;C组男15例,女7例,平均年龄60岁。3 组病例的性别构成(χ2=1.6441,P=0.4281)、平均年龄(F=0.95,P=0.392 7)和肿瘤TNM 分期(χ2=0.8629,P=0.9176)等相比差异均无统计学意义(P>0.05),3组具有可比性。
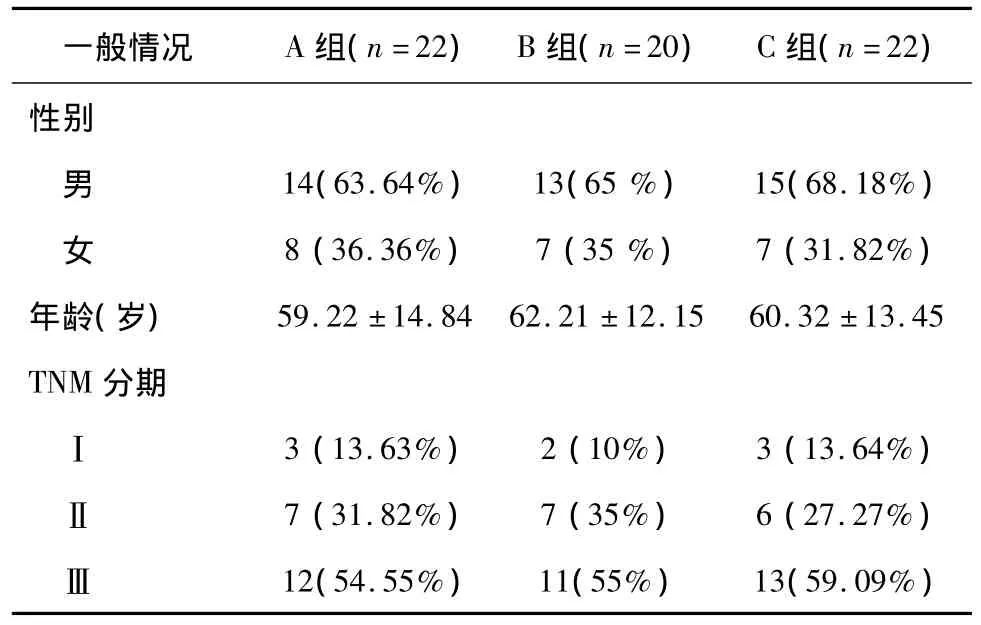
表1 3组64例患者一般情况比较(n,%)
1.2 方法
所有患者均行根治性远侧胃切除+D2淋巴结清扫,按残胃与小肠吻合不同方式非随机分为3组。A组22例行毕Ⅰ式吻合术,将残胃与十二指肠吻合;B组20例行毕Ⅱ式吻合+空肠侧侧吻合组,吻合方式为结肠前空肠近端与残胃大弯侧吻合,并加做输入袢与输出袢的侧侧吻合。
C组22例行Roux-en-y吻合术,缝合十二指肠残端后,于Treitz韧带远端约20 cm处将空肠切断,于结肠前将远端空肠与残胃吻合,于吻合口25cm处将近侧空肠断端与远侧空肠吻合。所有Ⅰ期患者手术后均不行化疗;所有Ⅱ、Ⅲ期患者手术后均行6周期化疗,具体化疗方案为 FOLFOX4。术前需停用长效降血糖药物1周及短效降血糖药物3 d,记录患者的空腹血糖(fasting plasma glucose,FPG)、餐后2h血糖(2-hour postprandial blood glucose,2hPBG)。完成数据采集后改为胰岛素强化治疗方案,术前将FPG控制在10 mmol/L左右即可。术后1周内根据血糖水平应用降血糖药物,1周后停用常规药物,仅进行饮食治疗及体育锻炼。若 FPG≥7.0mmol/L或 2 h PBG≥10.0 mmol/L,则给予短效胰岛素处理。术后1周、1个月、6个月复查,观察比较3组患者FPG、2hPBG情况。2型糖尿病疗效判定标准依据美国ADA糖尿病疗效判断标准:治愈:正常FPG,正常糖化血红蛋白(HbAlc),并且不需要药物治疗;改善:血糖下降>1.39 mmol/L,HbAlc下降>1%及药物治疗量减少;无效:FPG和HbAlc均未下降,药物治疗量未减少。有效=治愈+改善。
1.3 统计学处理
使用SPSS 19.0软件包对数据进行分析,用单因素方差分析比较吻合方式不同的患者术前、术后1周、1个月、6个月血糖变化情况。用四格表卡方检验法分析3种消化道重建方式与糖尿病转归的关系。P<0.05为差异有统计学意义。
2 结果
2.1 各组术后并发症情况
所有患者术中术后均未出现严重并发症(3组均无吻合口漏和严重的倾倒综合征,B组有3例轻-中等程度返流未影响进食与休息,A、C组均未出现返流),顺利出院,且随访1年以上。化疗及随访期间并未出现患者死亡及肿瘤的复发转移情况。
2.2 各组手术前后血糖结果比较
3组患者手术前后血糖值比较:与手术前相比,A组、B组、C组患者手术后1周、术后1个月、术后6个月的FPG、2hPBG均降低,3组术后FPG、2hPBG较术前FPG、2hPBG差异有统计学意义(P<0.05);B组和 C组术后 1个月、术后 6个月的 FPG、2hPBG,与 A组相比,差异有统计学意义(P<0.05)。术后1周、术后1个月、术后6个月的FPG、2hPBG在B组和C组间差异无统计学意义(P>0.05),见表2、表 3。
表2 3组患者术前术后FPG值比较(±s)mmol/l
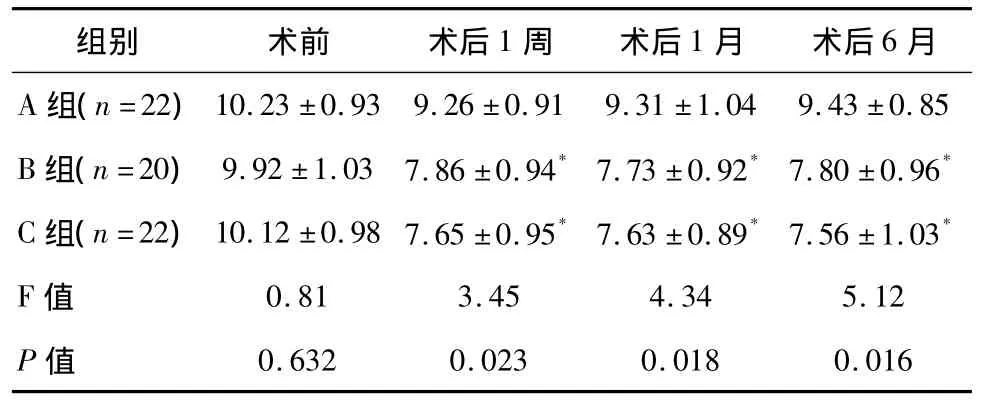
表2 3组患者术前术后FPG值比较(±s)mmol/l
* 与A 组比较,P<0.05
组别 术前 术后1周 术后1月 术后6月A组(n=22)10.23 ±0.93 9.26 ±0.91 9.31 ±1.04 9.43 ±0.85 B 组(n=20)9.92 ±1.03 7.86 ±0.94*7.73 ±0.92*7.80 ±0.96*C 组(n=22)10.12 ±0.98 7.65 ±0.95*7.63 ±0.89*7.56 ±1.03*F 值 0.81 3.45 4.34 5.12 P值0.632 0.023 0.018 0.016
表3 3组患者术前术后2hPBG值比较(±s)mmol/l
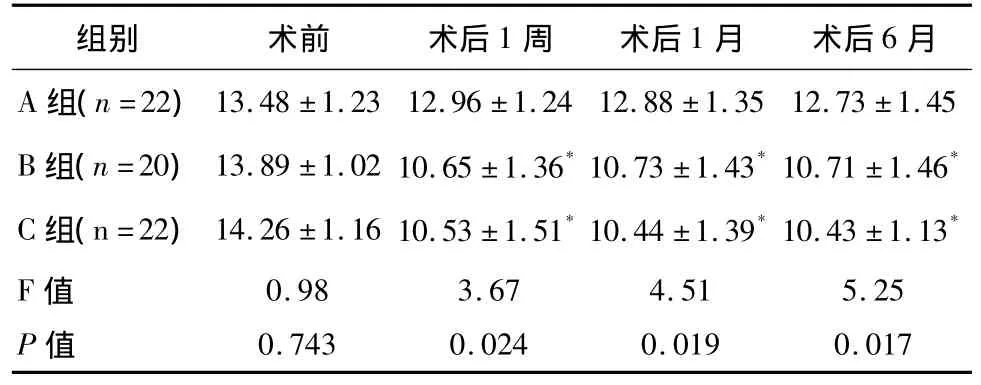
表3 3组患者术前术后2hPBG值比较(±s)mmol/l
* 与A 组比较,P<0.05
组别 术前 术后1周 术后1月 术后6月A 组(n=22)13.48 ±1.23 12.96 ±1.24 12.88 ±1.3512.73 ±1.45 B 组(n=20)13.89 ±1.02 10.65 ±1.36*10.73 ±1.43*10.71 ±1.46*C 组(n=22)14.26 ±1.16 10.53 ±1.51*10.44 ±1.39*10.43 ±1.13*F值P值5.25 0.017 0.98 0.743 3.67 0.024 4.51 0.019
2.3 术后6个月糖尿病疗效比较
与A组相比,B组和C组中糖尿病治愈比例高于A组,无效率低于A组,差异有统计学意义(P<0.05)。治愈率、改善率、无效率在B组和C组间差异无统计学意义(P>0.05),见表4。
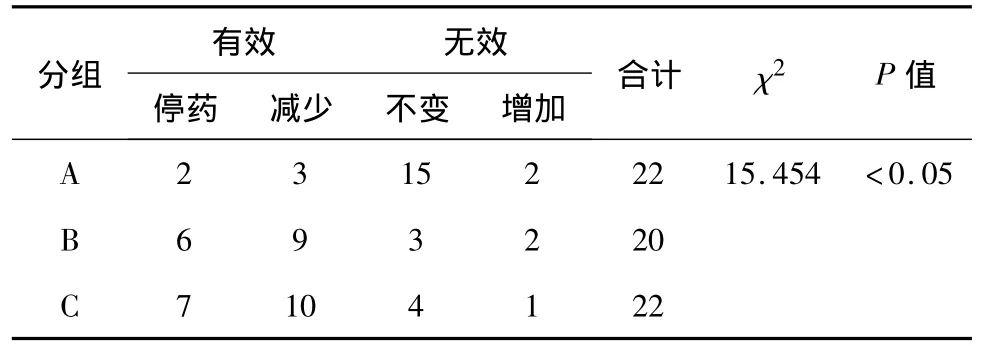
表4 3组术后6月糖尿病控制情况
3 讨论
随着生活水平的提高和不良生活习惯的增加,2型糖尿病的发病率逐年增高,胃癌合并2型糖尿病的病例亦越来越常见,在以手术为主的综合治疗手段治疗胃癌的同时,希望采取同一手术同时治疗胃癌和2型糖尿病。有研究表明,胃旁路手术(胃肠道的重建)可降低糖尿病患者的血糖水平,减少胰岛素和降糖药物的使用[2],目前利用手术方式治疗糖尿病的患者越来越多,该手术方式和胃癌手术后胃肠道重建有着相似的机制,而不同的消化道吻合方式对术后患者的血糖的影响也存在差别[3]。本研究发现,胃癌合并糖尿病的3组患者行根治性远侧胃切除术后分别行毕Ⅰ式吻合术(本组患者的肿瘤位于胃窦部并且体积较小<2cm,外侵浆膜不明显,该吻合方式不改变食物和消化液在消化道的运行途径,符合人体自身的生理状态,但对肿瘤的分期、残胃和十二指肠球部长度的要求较高,因此该吻合方式在胃癌手术上使用较少,本研究为回顾性的病例研究入选该组患者大多数为早期胃癌)、行毕Ⅱ式+空肠侧侧吻合、行Roux-en-Y吻合术后检测其血糖有不同的变化,结果显示根治性胃远端大部切除术后不同吻合方式均有效降低该类患者的血糖水平。
欧美国家早在上世纪中期就有文献报道通过切除胃大部采用毕Ⅱ式吻合治愈糖尿病的现象,Friedman等[4]报道过因十二指肠球部溃疡行毕 II式胃大部切除术后合并的糖尿病得到治愈,Forgacs等[5]也观察到了这个现象,糖尿病患者通过行胃手术改善了糖尿病,减少了药物和胰岛素使用量。在本世纪欧美国家在对以胃转流为主的减肥手术进行术后随访、观察时发现,手术不但减轻了患者的肥胖,还使其中合并有糖尿病的大部分患者的糖代谢紊乱得到了治疗[6],Cummings等[7]报道了多例接受胃转流手术的肥胖患者,其中合并2型糖尿病患者的糖尿病完全缓解率达到82%~98%,糖耐量减低患者的完全缓解率100%。外科手术治疗2型糖尿病的机制目前尚不清楚,本研究的结果显示远侧胃癌切除术后不同吻合方式可导致患者术后血糖水平的降低,结合相关文献报道,我们分析其机制可能为:术后食物的吸收减少使糖代谢负荷减轻,患者的体重减轻使肌肉内胰岛素受体表达增加和脂联素水平升高。脂联素可以增加胰岛素敏感性,从而缓解高血糖状态,减轻了高血糖对胰腺β细胞的糖毒性,改善β细胞功能[8-9]。有研究者提出了“肠-胰岛素轴”学说(包括“前肠学说”和“后肠学说”)。近端空肠和十二指肠受食物刺激产生“胰岛素抵抗因子”而术后食物不经过十二指肠,减少了“胰岛素抵抗因子”的释放,导致2型糖尿病的胰岛素拮抗作用减轻甚至消失,从而起到改善或治疗糖尿病的作用[10],非肥胖2型糖尿病小鼠模型研究中发现[11],与对照组相比,手术组在体重减轻之前就有餐后血糖的显著降低。这表明,胃肠外科手术控制糖尿病的机制不仅仅局限于减少摄入及减轻体重[12]。后肠学说提出,术后肠道末端对营养物质加速分解,使葡萄糖的代谢得到了改善[13]。本研究结果显示:与毕Ⅰ式吻合术组相比,毕Ⅱ式+空肠侧侧吻合组和Roux-en-Y吻合组术后1个月、术后6个月的FPG、2hPBG均有效降低,毕Ⅱ式+空肠侧侧吻合组、Roux-en-Y吻合组术后FPG、2hPG水平与毕Ⅰ式吻合术组比较差异有统计学意义(P<0.05),只有毕Ⅰ式吻合术组患者的食物能直接刺激十二指肠,可产生“胰岛素抵抗因子”,而毕Ⅱ式+空肠侧侧吻合组、Roux-en-Y吻合组患者术后进食,食物是不经过十二指肠,减少了“胰岛素抵抗因子”的释放,导致2型糖尿病的胰岛素拮抗作用减轻甚至消失,从而起到改善或治疗糖尿病的作用。
目前不同消化道吻合式对血糖影响的研究大部分将部分胃切除和全胃切除同时列为研究对象,这忽略了不同残留胃容积对血糖的影响。而本研究只选择行远端胃大部切除的患者,尽可能地避免术后因为残留胃容积不同导致的进食、能量减少等因素而造成对术后血糖结果的影响,本研究结果显示:与手术前相比,毕Ⅰ式吻合术组、毕Ⅱ式+空肠侧侧吻合组、Roux-en-Y吻合组患者手术后1周、术后1个月、术后6个月的 FPG、2hPBG均降低,3组术后FPG、2hPBG与术前FPG、2hPBG比较差异有统计学意义(P<0.05);毕Ⅱ式+空肠侧侧吻合组和Rouxen-Y吻合组术后1个月、术后6个月的 FPG、2hPBG,与毕Ⅰ式吻合术组相比,差异有统计学意义(P<0.05)。术后1周、术后1个月、术后6个月的FPG、2hPBG在毕Ⅱ式+空肠侧侧吻合组和Rouxen-Y吻合组间差异无统计学意义(P>0.05)。根治性远端胃大部切除术后,行毕Ⅱ式+空肠侧侧吻合组和行Roux-en-Y吻合组对血糖控制均比毕I式吻合组有效,可改善2型糖尿病胃癌患者血糖代谢,这与大多数文献报告相符,且并未影响患者的营养状况,同时也达到治疗胃癌的目的,提示根治性远端胃切除毕Ⅱ式+空肠侧侧吻合与Roux-en-Y重建可能是治疗2型糖尿病胃癌患者的一种有效治疗手段。Roux-en-Y重建控制血糖的有效率较高,同时能有效减少术后返流,但手术操作相对复杂;毕Ⅱ式+空肠侧侧吻合重建手术操作相对简单,但术后并发症,尤其是返流较为多见,个别患者术后主观返流症状较重。因此,针对合并2型糖尿病的胃癌患者,更倾向在患者一般情况及手术条件允许的情况下应用Roux-en-Y重建。
本研究尚有一定的局限性,如未能测定患者血清胰高糖素样肽-1(GLP-1)、酪酪肽(PYY)等激素的含量,比较不同消化道吻合方式对激素分泌的影响;未分析不同化疗方案对患者营养状况及血糖的影响等。同时,这也为今后进一步的研究提供了指导方向和思路。对于胃癌合并2型糖尿病患者,此手术方式明显改善了糖代谢及胰岛β细胞功能,近期临床疗效确切,但远期疗效还需进一步观察,今后还需积累更多的样本量进行更深入的基础和临床研究。
[1] American Diabetes Association.Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2007,30(Supp l 1):S42-S47.
[2] Shah S,Shah P,Todkar J,et al.Prospective controlled study of effect of laparoscopic sleeve gastrectomy on small bowel transit time and gastric emptying half-time in morbidly obese patients with type 2 diabetes mellitus[J].Surg Obes Relat Dis,2010,6(2):152-157.
[3] Wang HF,Ye G,Wang Y,et al.46 Retrospective study of the influence of alimentary tract reconstruction after gastrectomy on the blood glucose level in gastric cancer patients complicated with type 2 diabetes mellitus[J].Transl Gastrointest Cancer,2012,15(3):19-21.
[4] Friedman MN,Saneetta AJ,Magovem GJ.The amelioration of diabetes mellitus following subtotal gastrectomy[J].Surg Gynecol Obstet,1955,100(2):201-204.
[5] Forgacs S,Halmos T.Improvement of glucose tolerance in diabetics following gastrectomy[J].Z Gastroenterol,1973,11(4):293-296.
[6] Rubino F,Kaplan LM,Schauer PR,et al.The diabetes surgery summit consensus conference:recommendations for the evaluation and use of gastrointestinal surgery to treat type 2 diabetes mellitus[J].Ann Surg,2010,251(3):399-405.
[7] Cummings DE,Overduin J,Foster-Schubert KE.Gastric bypass for obesity:mechanisrns of weight loss and diabetes resolution[J].J Clin Endocrinol Metab,2004,89(6):2608-2615.
[8] Dixon JB,O’Brien PE,Playfair J,et al.Adjustable gastric banding and conventional therapy for type 2 diabetes:a ranrandomized controlled trial[J].JAMA,2008,299(3):316-323.
[9] Hanley AJ,Bowden D,Wagenknecht LE,et al.Associations of adiponectin with body fat distribution and insulin sensitivity in nondiabetic Hispanics and African-American[J].J Clin Endocrinol Metab,2007,92(7):2665-2671.
[10] Rubino F,Forgione A,Cummings DE,et al.The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes[J].Ann surg,2006,244(5):741-749.
[11] Rubino F,Marescaux J.Effect of duodental-jejunal exclusion in a non-obese animal model of type 2 diabetes:a new perspective for an old disease[J].Ann surg,2004,239(1):1-11.
[12] Cummings DE,Overduin J,Foster-schubert KE,et al.Role of the bypassed proximal intestine in the anti-diabetic effects of bariatric surgery[J].Surg Obes Relat Dis,2007,3(2):109-115.
[13] Lee W,Ahn SH,Lee JH,et al.Comparative study of diabetes mellitus resolution according to reconstruction type after gastrectomy in gastric cancer patients with diabetes mellitus[J].Obesity surgery,2012,22(8):1238-1243.
