感染标志物对住院肿瘤患者感染性发热的诊断价值
2015-12-02屈进文王友硕
谢 华,程 凯,屈进文,王友硕,周 进,赵 新
(1.四川省肿瘤医院,成都610041;2.宜宾肿瘤医院,四川 宜宾644002)
发热是提示可能存在全身性感染或脓毒症的重要指标。此外,自身免疫性疾病、肿瘤、缺血或血栓性病变、内分泌紊乱及医源性因素等亦常导致非感染性发热。有研究显示,非感染性因素发热占肿瘤患者发热病例的23%以上[1]。鉴于肿瘤患者病情复杂、合并症多且基础免疫功能低下、血液学指标干扰因素大,医务人员在处理肿瘤患者发热时必须及时准确地进行抗感染治疗的决策。由于血培养耗时长,白细胞计数和分类等则诊断灵敏度特异度均较差,上述方法无法满足临床快速准确地鉴别复杂状态下感染性疾病的需求。超敏C反应蛋白(hs-CRP)、降钙素原(PCT)作为感染标志物已广泛用于临床。本研究评价了hs-CRP、PCT及常规血液学指标对于鉴别非粒缺性发热的住院肿瘤患者是否感染的应用价值。
1 资料与方法
1.1 研究对象
2013年10月~2015年4月于我科病房住院期间出现发热(指单次腋下温度测定≥38.5℃,或24小时内两次体温≥38.0℃)的非粒细胞缺乏的肿瘤患者,病原学阳性或临床诊断的细菌/真菌性感染患者为感染性发热组,无细菌性或真菌性感染相关的临床症状体征和实验室、影像学证据的发热患者为非感染性发热组(两组诊断标准参照文献[1])。感染的确认及死因判定由三名副高以上职称医师完成。体温正常且抗生素停用超过14天的再次发热的患者,计入统计病例。
排除标准:小细胞癌、神经内分泌肿瘤、甲状腺肿瘤/疾病(均可能导致PCT的升高);出现首次发热时已诊断感染或使用抗生素的患者;入院前或入院后48小时以内出现的发热患者;粒细胞计数≤0.5 ×109/L。
符合上述标准的病例共计144例,其中非小细胞肺癌63例,乳腺癌11例,食管癌10例,淋巴瘤7例,多发性骨髓瘤6例,其他实体肿瘤47例。男性81例,女性63例。中位年龄57岁(32~78岁)。
感染性发热组113例:微生物培养阳性者23例(20.4%),其中血培养或PICC导管培养阳性14例(12.4%),痰培养阳性8例,尿培养阳性5例,分泌物培养阳性4例;90例患者培养阴性但临床或症状体征或影像学证据支持感染。非感染性发热组31例:药物相关发热13例,输液反应5例,介入性操作相关发热7例,单纯病毒性感染6例。
两组患者在是否化疗期、性别、年龄、肿瘤分期、ECOG评分等临床基线特征的构成比上差异无统计学意义(P >0.05),见表1。
1.2 方法
发热1小时内抽取血标本送检血培养、血PCT、hs-CRP、血常规,24小时内对可疑体液或分泌物取样培养,或PICC导管培养。Nephstar Plus特定蛋白分析仪进行hs-CRP测定,Thermo胶体金试剂盒检测PCT。迈瑞6800血细胞分析仪进行血常规检测。我院Hs-CRP的正常参考值为0~10mg/L,PCT以<0.2ng/ml为阴性。记录白细胞总数(WBC)、中性粒细胞数(Neu)、淋巴细胞数(Lym)、中性粒细胞比例(Neu%)、淋巴细胞比例(Lym%),计算中性粒细胞/淋巴细胞比(NLR)。本研究中NLR以7为界值进行分类。
所有病例随访14天。纳入观察的临床特征包括:性别、年龄、肿瘤类型、分期、ECOG评分、是否化疗期、是否死亡等。
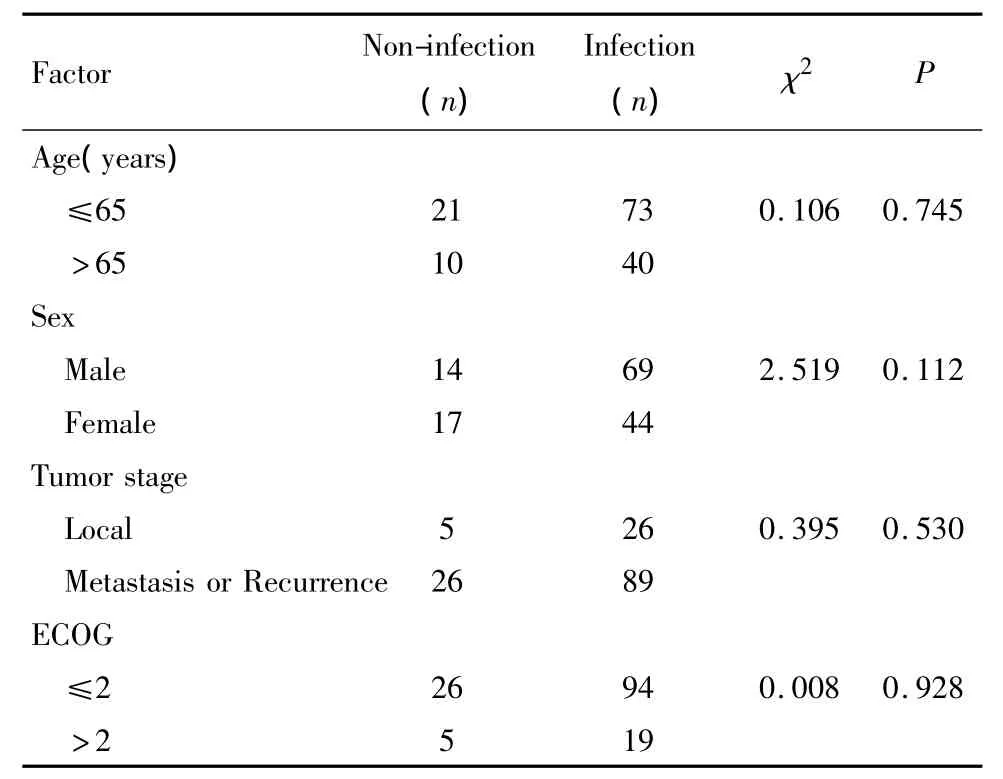
表1 两组主要临床特征构成比较Table 1 Main clinic features in two groups
1.3 统计学处理
采用SPSS19.0软件包处理数据并绘制ROC曲线,计量资料行正态性检验后再行t检验。分类资料应用Pearson卡方检验;1<理论频数<5时,应用连续校正的卡方检验;理论频数<1时,应用Fisher精确概率法检验。多因素分析采用Logistic二项回归模型分析。ROC的最佳分界值(cut off)以约登指数(敏感度+特异性-1)最大者选取。以P<0.05为差异具有统计学意义。
2 结果
2.1 两组感染标志物及血液学指标比较
感染性发热组与非感染性发热组比较,hs-CRP值明显升高,PCT≥0.5ng/ml的患者占比增加,两组间差异有统计学意义(P<0.05)。见表2、表3。
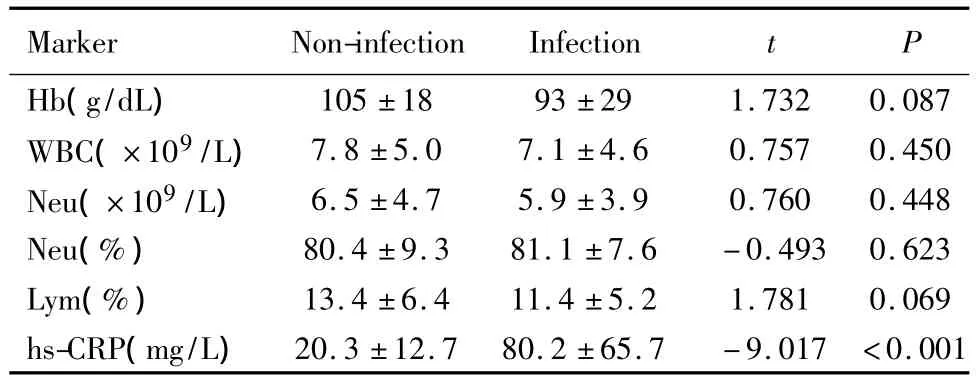
表2 两组的血液学指标和hs-CRP值比较Table 2 Blood indexes and hs-CRP in two groups
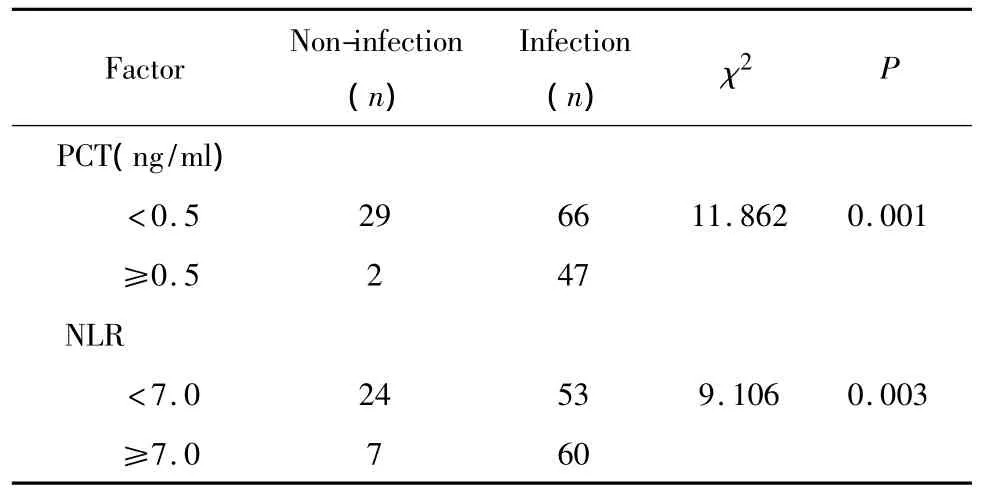
表3 两组的PCT和NLR值比较Table 3 PCT and NLR in two groups
2.2 CRP对于感染性发热的诊断效能的 ROC曲线
hs-CRP 的 ROC 曲线 AUC=0.823,P <0.001,见图1。从ROC曲线拟合中hs-CRP各设定值的诊断效能分析,28.0~31.5mg/L的分界值具有相对较好的敏感度和特异性,以31.5mg/L为分界值的约登指数最大,见表4。
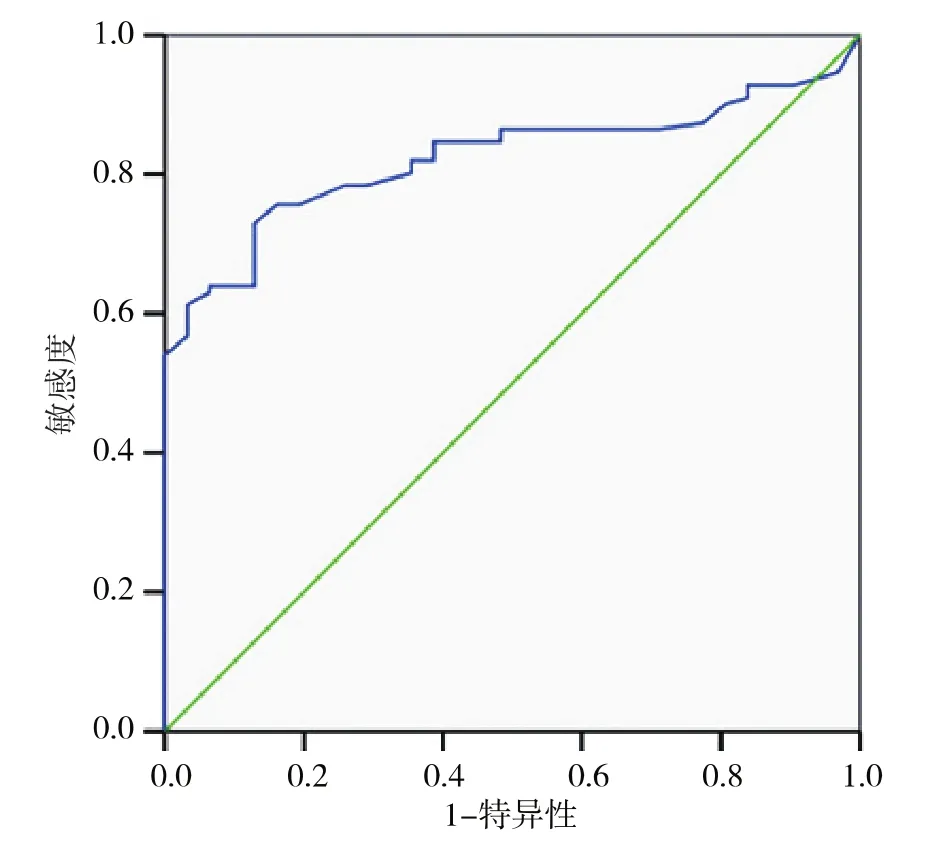
图1 hs-CRP对于感染性发热的诊断ROC曲线Figure1 ROC curve of hs-CRP for differentiating infection from noninfection.
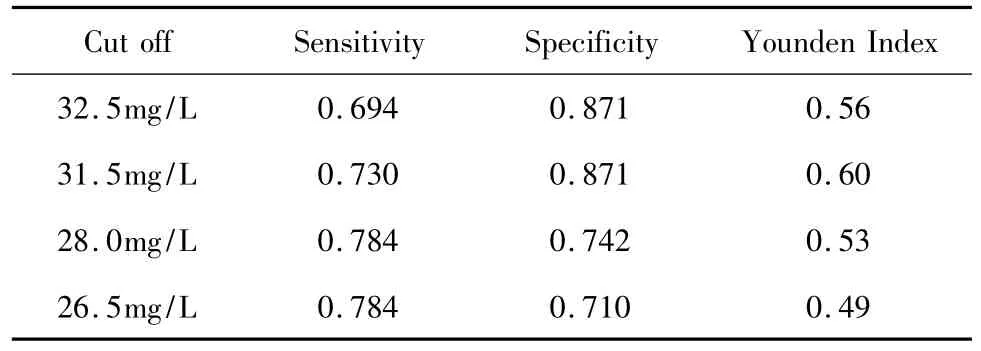
表4 hs-CRP对于感染性发热诊断的不同分界值Table 4 Discrimination of hs-CRP level to infection in febrile patients
2.3 感染性发热的多因素分析
将PCT、hs-CRP、淋巴细胞比例、NLR纳入回归分析,结果显示,hs-CRP、PCT、NLR能独立鉴别感染性发热与非感染性发热。见表5。
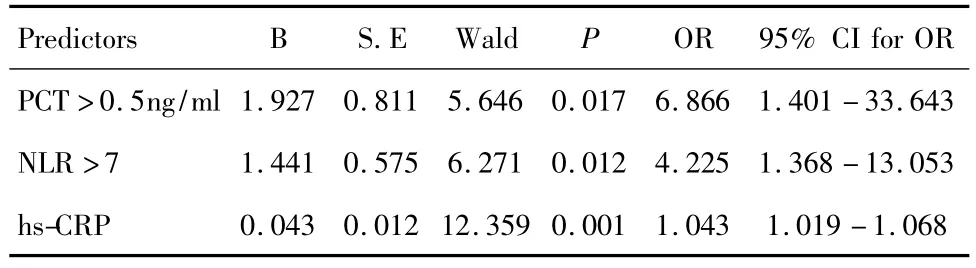
表5 感染性发热因素的Logstic回归分析Table 5 Logistic regression of risk factors for infection
2.4 感染相关性死亡
感染性发热组中,中位抗生素使用时间9天。非感染性发热组中,8例(25.8%)患者使用了小于3天的抗生素治疗。
在14天的观察及随访期内,感染性发热组发生感染相关性死亡8例。单因素分析显示,在发热时的基线指标中,仅有PCT≥2.0ng/ml的比例在感染相关死亡患者与非死亡患者之间差异有统计学意义(P=0.008),见表6。其他各项指标水平或分布在死亡与非死亡患者之间差异无统计学意义(P>0.05)。
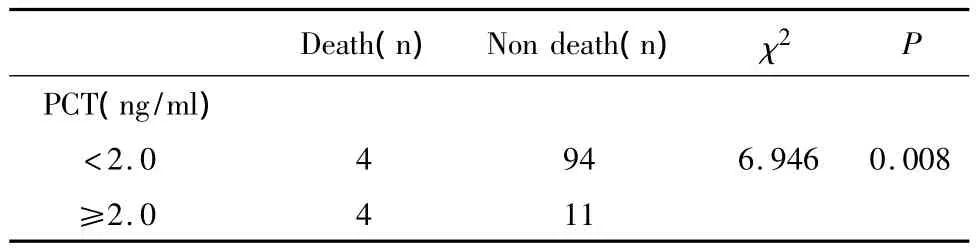
表6 死亡与非死亡组的PCT构成Table 6 PCT in death and non death groups
3 讨论
有研究显示,肿瘤性发热占肿瘤患者发热的3%~6%[1-2],17%肿瘤患者发热则由非感染性因素如药物、侵袭性操作等导致。而在肿瘤患者的感染性发热病例中,30天内的感染相关死亡率可高达9.5%[1];一旦发生脓毒症,肿瘤患者的短期死亡率则可达72%[3]。在本研究中,我们的结果与既往报道高度接近:非感染性因素占住院肿瘤患者发热病例的21.5%,而短期(2周)内发热患者的感染相关性死亡率7.1%。因此,对于发热的肿瘤患者,快速鉴别发热原因并给予及时准确的干预是影响预后的首要措施。而常规培养特异性高,但阳性率低、周期长;血液学常规指标虽然操作简单成本低廉,却经常受到肿瘤患者接受皮质激素或化疗药物、骨髓状态等因素影响,灵敏度特异度均差。因此,二者均不能提供快速准确的预测价值。
C反应蛋白(C-reactive protein,CRP)是一种肝细胞产生的急性时相反应蛋白。在急性组织损伤或炎症刺激发生4~6小时后 CRP浓度升高[4]。广泛用于感染、自身免疫性疾病、心脑血管疾病、内分泌疾病的早期识别及预后判断。但既往研究显示,CRP对于细菌感染的灵敏度为68%~92%,特异度为40%~67%,由于特异度较低,降低了其在感染性疾病早期诊断中的应用价值[5],一般认为其对于感染的诊断价值低于降钙素原[6-7]。超敏C反应蛋白(hypersensitive-CRP,hs-CRP)实际上与CRP系同一种蛋白,仅因其测定方法更敏感而得名。近年来免疫比浊法、免疫发光法等新技术使CRP的检测灵敏度得到了较大提高。
PCT由116个氨基酸组成,是降钙素的前体多肽。感染状态下,PCT由体内的单个核细胞大量合成分泌。其在体内生物半衰期是22~26 h,长于CRP[2]。近年来 PCT作为感染指标已被广泛应用[8-9]。被认为在对细菌感染诊断的灵敏度和特异度上优于 CRP[6]。中性粒细胞/淋巴细胞比(NLR)作为极其简便且无实际花费的指标,近年来亦广泛用于感染性疾病诊断研究。有研究[10]显示,NLR对于细菌感染的预测作用优于白细胞计数、CRP。Terradas R等的研究显示,NLR对于菌血症患者具有良好的预后作用,是预测死亡的独立危险因素[11]。
本文多因素回归分析显示,hs-CRP、PCT、NLR均能独立地鉴别肿瘤患者的感染性发热与非感染性发热。其他血常规指标无法提供鉴别作用。hs-CRP截值为31.5mg/L时,约登指数最大,诊断性能最好。考虑到晚期肿瘤患者常合并免疫功能缺陷且同时接受免疫抑制治疗,为保证更高的诊断灵敏度,hs-CRP取28~31.5mg/L也许更为合适。在本研究中,有25.8%(8/31)的非感染组患者接受了短暂的抗生素治疗。因此,如果能通过hs-CRP进行发热早期筛查以排除非感染性发热来指导抗生素使用,对于减少不必要的抗生素使用、降低医疗成本定会有所裨益。遗憾的是,由于我们研究中PCT检测下限为0.2ng/ml,未能对PCT以计量资料方式进行单因素分析和多因素回归分析,故无法进行PCT与hs-CRP诊断性能的直接比较。
尽管本研究中死亡病例较少,但PCT仍然显示了对于肿瘤患者致命性感染的早期预警作用。当PCT>2ng/ml时,脓毒症的发生率明显升高,应及时采取积极的抗感染治疗策略,控制危及脏器功能的严重感染。
我们的研究显示,非粒缺状态下的发热的肿瘤患者中,医源性发热因素不可忽视,由此可能导致抗生素的“滥用”。同时,出现感染相关性发热的肿瘤患者短期内死亡率高。hs-CRP对于早期感染具有较好的诊断价值,而PCT明显升高则能提供预后作用。hs-CRP、PCT、NLR三者的联合,对于肿瘤患者感染性发热的预测收益值得进一步研究。
[1] Toussaint E,Bahel-Ball E,Vekemans M,et al.Causes of fever in cancer patients(prospective study over 477 episodes)[J].Support Care Cancer,2006,14(7):763-769.
[2] Limper M,de Kruif MD,Duits AJ,et al.The diagnostic role of procalcitonin and other biomarkers in discriminating infectious from non-infectious fever[J].J Infect,2010,60(6):409-416.
[3] Rosolem MM,Rabello LS,Lisboa T,et al.Critically ill patients with cancer and sepsis:clinical course and prognostic factors[J].J Crit Care,2012,27(3):301-307.
[4] Windgassen EB,Funtowicz L,Lunsford TN,et al.C-reactive protein and high-sensitivity C-reactive protein:an update for clinicians[J].Postgrad Med,2011,123(1):114-119.
[5] Sung-Yeon Cho,Jung-Hyun Choi.Biomarkers of Sepsis[J].Infect Chemother,2014,46(1):1-12.
[6] Yu CW,Juan LI,Hsu SC,et al.Role of procalcitonin in the diagnosis of infective endocarditis:a meta-analysis[J].Am J Emerg Med,2013,31(6):935-941.
[7] Henriquez-Camacho C,Losa J.Biomarkers for sepsis[J].Biomed Res Int,2014,2014:547818.doi:10.1155/2014/547818
[8] Schuetz P,Christ-Crain M,Thomann R,et al.Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections:the ProHOSP randomized controlled trial[J].JAMA,2009,302(10):1059-1066.
[9] Bouadma L,Luyt CE,Tubach F,et al.Use of procalcitonin to reduce patients’exposure to antibiotics in intensive care units(PRORATA trial):a multicentre randomised controlled trial[J].Lancet,2010,375(9713):463-474.
[10] de Jager CP,van Wijk PT,Mathoera RB,et al.Lymphocytopenia and neutrophil-lymphocyte count ratio predict bacteremia better than conventional infection markers in an emergency care unit[J].Crit Care,2010,14(5):R192.doi:10.1186/cc9309
[11] Terradas R,Grau S,Blanch J,el at.Eosinophil count and neutrophil-lymphocyte count ratio as prognostic markers in patients with bacteremia:a retrospective cohort study.[J].PLoS One,2012,7(8):e42860.doi:10.1371/journal.pone.0042860.
