补肾助孕方对米非司酮构建的LPD模型大鼠性腺轴形态学的影响
2015-12-02杨丽娟周伯如戴佳轩周惠芳
杨丽娟,周伯如,戴佳轩,周惠芳
0 引 言
补肾助孕方是国医大师、白求恩奖章获得者、南京中医药大学夏桂成教授根据数十年临床应用总结得出的有效方剂,该方对黄体功能不全(luteal phase defect,LPD)所致的不孕症、月经不调、流产等均具有良好的治疗效果。本研究用米非司酮构建LPD大鼠模型[1],用补肾助孕方进行干预,通过比较大鼠性腺轴中的下丘脑-垂体-卵巢-子宫部位的形态学变化,来探讨补肾助孕方对LPD大鼠模型性腺轴各部位形态结构的改善作用。
1 材料与方法
1.1 实验材料 SPF级雌性 SD大鼠40只,8周龄,体重(200±20)g,由南京中医药大学实验动物中心提供,实验动物许可证号:SCXK(沪)2012-0006,饲养于南京中医药大学实验动物中心SPF环境,分笼饲养,实验期间大鼠自由摄食、饮水,室内温度控制在22~25℃,相对湿度约40% ~70%,各12 h的光照和黑暗交替进行,保持安静饲养环境。补肾助孕方由淮山药15 g、山茱萸10 g、炒白芍10 g、醋炒柴胡6 g、菟丝子15 g、鹿角片10 g等中药组成,中药饮片购自南京中医药大学百草堂,采用传统水煎浓缩至每mL含生药2 g,4℃保存备用。米非司酮(上海新华联制药有限公司生产,25 mg/片,批号:060702)配置成浓度为1 mg/mL的均一混悬液,4℃保存备用,给药前复温至25~28℃。HE染色试剂4%甲醛、电镜染色试剂,4%的戊二醛,均由南京中医药大学病理教研室提供。
1.2 实验方法
1.2.1 造模及给药 将大鼠分为空白组、模型组以及中药低、高剂量组共4组,每组10只,空白组给予等渗盐水1mL/100g,模型组给予米非司酮1mL/100g,中药低、高剂量组分别予中药 0.4、1.2 mL/100 g。每天阴道涂片,发现动情期即确定为D1,开始给药,重复2个性周期。在周期结束当天16∶00统一处死[2-3]。以上2种药液均按《人和动物间按体表面积折算的等效剂量比值表》换算[4]。实验过程中中药低剂量组死亡1只,中药高剂量组死亡2只,原因可能为灌胃操作不当所致。
1.2.2 标本取材方法 10%水合氯醛按 0.35 mL/100 g行腹腔麻醉,麻醉成功后采血,断头处死后迅速取出下丘脑及垂体,肉眼及解剖显微镜下观察下丘脑、垂体、卵巢及子宫形态,滤纸吸净血液后,电子天平称重。标本用4%多聚甲醛固定,常温放置,行HE染色病理检查,各组随机选3只大鼠的垂体行透射电镜检查,先预冷器械,在冰上操作,用刀片将垂体前叶修成1 mm×2 mm×1 mm大小,做好标记,各组所取位置一致,立即量入4%戊二醛固定,4℃保存备测电镜。
1.2.3 测量指标 大鼠处死后取下丘脑、垂体、子宫、卵巢,常规脱水、透明、浸蜡、包埋、切片(厚5 μm)及常规HE染色,奥林巴斯BX40光学显微镜观察下丘脑、垂体、卵巢及子宫组织形态学改变,并采用体视学计数卵巢中卵泡数及黄体数。其中每组各选3只大鼠,透射电镜观察下丘脑及垂体性腺细胞中的超微结构及细胞器的改变。
1.3 统计学分析 采用SPSS 16.0软件进行统计分析,定量资料采用均数±标准差(±s)表示。当数据满足正态分布及方差齐性的条件下,各组间均数的比较采用单因素方差分析,组间两两比较采用LSD检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 下丘脑的形态学改变
2.1.1 下丘脑肉眼观 将脑区分离翻转底部,以灰结节和视交叉之间的中心点做为中心确定下丘脑组织,前界为视交叉前缘,后界为乳头体后缘,两侧为颞侧沟,整个下丘脑长、宽约4mm,深约2mm。各组间下丘脑形态外观未见明显差异。
2.1.2 下丘脑HE染色光镜检查结果 各组下丘脑细胞大小一致,形态规则,细胞间界限清楚,细胞质少,神经细胞无变性、坏死,胶质细胞无增生。见图1。
2.1.3 透射电镜观察下丘脑细胞形态 空白组可见内质网及发达的高尔基复合体,核膜完整,有丰富的分泌颗粒和溶酶体;模型组中线粒体嵴断裂空泡化;粗面内质网脱颗粒,并形成髓样小体,核不规则,核膜溶解,可见少量的分泌颗粒。中药低、高剂量组核膜部分溶解,以低剂量组更为明显,核旁高尔基体及内质网结构形态正常,无明显肿胀,可见少量的分泌颗粒。见图2。

图1 光镜下观察大鼠下丘脑细胞形态(HE×200)Figure 1 Morphology of the hypothalamus cells in different groups of rats observed under the light microscope(HE×200)

图2 透射电镜观察大鼠下丘脑细胞形态(×2000)Figure 2 Morphology of the hypothalamus cells in different groups of rats observed under the transmission electron microscope(×2000)
2.2 垂体的形态学改变
2.2.1 垂体的肉眼观 神经垂体和腺垂体界限明显,神经垂体位于腺垂体中间部分的后上方,腺垂体的前、后方薄,两侧方大致呈三棱锥体形,尖端向前。各组间垂体肉眼观无明显差异。
2.2.2 垂体HE染色 光镜检查结果大鼠脑垂体可区分嗜酸性细胞、嗜碱性细胞及嫌色细胞,分界清楚,各组间各类细胞比例正常,但模型组脑垂体细胞分布密度稍稀,部分细胞核固缩,细胞质出现空泡化。其余3组垂体各类细胞无变性、坏死,未出现去势细胞。见图3。

图3 光镜下观察大鼠垂体细胞形态(HE×200)Figure 3 Morphology of the pituitary cells in different groups of rats observed under the light microscope(HE×200)
2.2.3 透射电镜观察垂体形态 空白组垂体细胞核形态正常,细胞质内含有明显的核旁高尔基复合体,有丰富的线粒体及分泌颗粒;模型组中细胞核明显皱缩变形,核染色质凝聚,细胞器排列紊乱,线粒体内腔肿胀,扩张形成空泡状。中药低、高剂量组均表现为细胞核形态规则,核旁高尔基体及内质网结构形态正常,无明显肿胀,可见部分分泌颗粒。见图4。
2.3 卵巢的形态学改变
2.3.1 卵巢结构肉眼观 中药低、高剂量组卵巢较空白组和模型组明显增大,质地疏松,解剖显微镜下可见明显增多的黄体;而模型组卵巢体积稍小,质地较韧。
2.3.2 HE染色光镜检查结果 显微镜下计数生长卵泡、黄体和闭锁卵泡数。4组间比较空白组生长卵泡数量较多,黄体细胞发育好,体积大,颗粒细胞层较厚(多为5~6层);模型组卵巢内闭锁卵泡数量较多,颗粒细胞较少,颗粒细胞层次减少(多为2~3层),排列松散,卵母细胞放射冠消失;中药低剂量组卵巢内黄体数量较模型组增多,发育好,体积大,卵巢闭锁卵泡数量减少;中药高剂量组卵巢内生长卵泡数量多,卵泡颗粒细胞层较厚(多为6~7层),颗粒细胞丰富,黄体数量多,发育好。见图5。
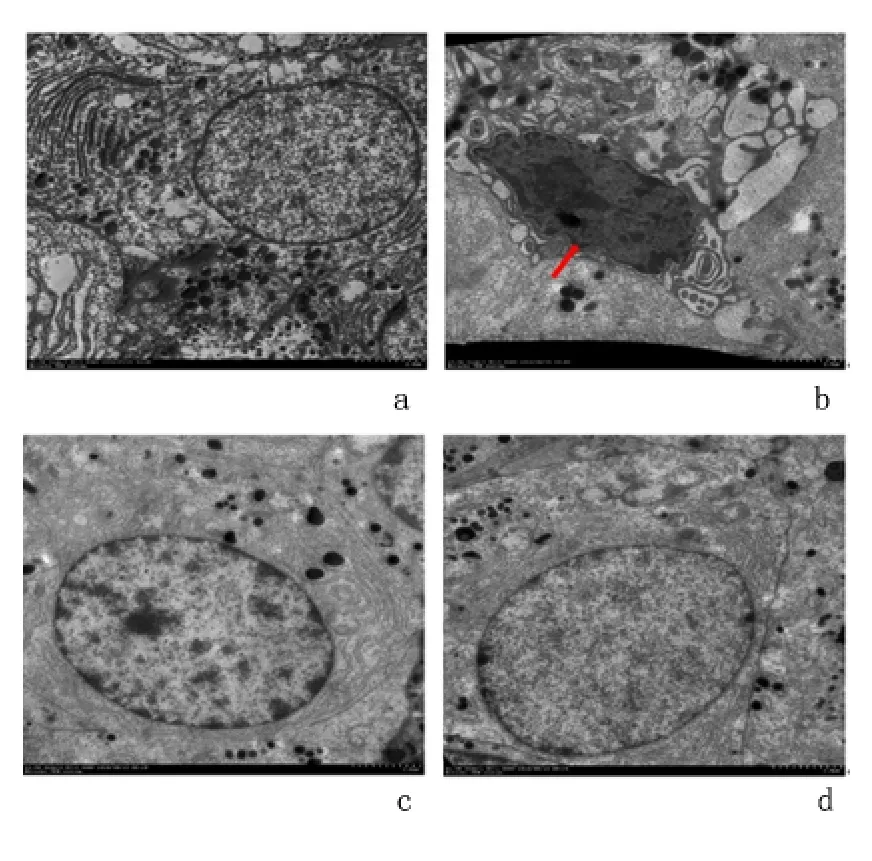
图4 透射电镜观察大鼠垂体形态(×1500)Figure 4 Morphology of the pituitary cells in different groups of rats observed under the transmission electron microscope(×1500)

图5 光镜下观察大鼠卵巢细胞形态(HE×200)Figure 5 Morphology of the ovarian cells in different groups of rats observed under the light microscope(HE×200)
2.3.3 各组卵巢卵泡及黄体个数的比较 模型组各级卵泡数及黄体数目明显减少,中药低、高剂量组均能增加卵泡数及黄体数,见表1。
2.4 子宫的形态学改变 子宫由内膜、肌层及外膜组成,外观各组未见明显差异。HE染色光镜检查见空白组子宫固有层组织疏松,间质细胞肥大,可见多量子宫腺体,间质血管丰富;模型组子宫内膜层较空白组变薄,管壁子宫腺体数量减少,腺腔较空白组小,间质胶原纤维增多;中药低剂量组子宫内膜厚度和模型组接近,管壁子宫腺体数量较模型组略多,腺腔增大;中药高剂量组内膜厚度较低剂量组厚,管壁子宫腺体数量较模型组增多,腺腔增大,肌层间血管数量多、扩张充血,浆膜层无异常。见图6。
表1 各组大鼠卵泡数目及黄体数目的比较(±s)Table 1 Numbers of follicles and corpora lutea in different groups of rats(±s)

表1 各组大鼠卵泡数目及黄体数目的比较(±s)Table 1 Numbers of follicles and corpora lutea in different groups of rats(±s)
与模型组比较,*P <0.05
组别 n 各级卵泡数(个) 黄体数(个)空白组 10 32.30 ±2.63* 25.30 ±2.67*模型组 10 23.70 ±2.31 16.40 ±2.20中药低剂量组 9 25.33 ±2.35 23.07 ±2.50*中药高剂量组 8 31.87 ±2.23* 22.37 ±1.93*

图6 光镜下观察大鼠子宫形态(HE×200)Figure 6 Uterine morphology in different groups of rats under the light microscope(HE×200)
3 讨 论
LPD系指排卵后黄体发育不良、黄体过早退化、孕激素分泌不足和子宫内膜分泌反应性降低;临床上以分泌期子宫内膜发育延迟,内膜发育与孕卵发育不同步为主要特征,其临床特点为不孕和反复的早期流产[5]。该病在育龄女性中的自然患病率为5%左右,在不孕女性中占10%,在习惯性流产女性中最高可达60%左右,对女性的身心健康造成严重的威胁[6]。国外研究也证实:在自然月经周期,育龄期女性LPD发病率为3% ~10%;在超促排卵周期,LPD的发生率几乎100%[7]。黄体是排卵后卵泡形成的富有血管的暂时性内分泌腺,是甾体激素的主要来源[8],黄体实质内的黄体细胞主要合成孕激素[9]。引起 LPD 的原因涉及下丘脑-垂体-卵巢-子宫轴的各个环节,该轴功能的紊乱引起子宫内膜组织时相和性激素分泌时相失去同步化[10]。前期研究已证实补肾助孕方对于改善卵巢的内分泌功能具有良好的功效,且能改善黄体的功能,提高子宫内膜的容受性[11-12]。米非司酮是19一去甲类固醇炔诺酮的衍生物,它能与孕激素受体和糖皮质激素受体相结合而发挥药理作用,具有抗孕激素及抗糖皮质激素和微量的抗雄激素作用,可以直接或间接作用于下丘脑-垂体-卵巢轴,延迟、抑制卵泡发育和排卵[13-14]。国外研究表明,米非司酮对子宫内膜的影响要大于下丘脑和垂体[15],而国内有研究者报道:给大鼠使用小剂量米非司酮后,垂体促性腺细胞与对照组相比,体积减小,细胞质变少且形状欠规则,细胞质内液泡减少或消失,可见细胞质突起似树突状细胞[16]。米非司酮引起的内分泌失衡状态是否系性腺轴各环节的超微结构改变影响到细胞合成、分泌蛋白质的功能所致?本研究用米非司酮构建LPD大鼠模型,从形态学角度观察下丘脑-垂体-卵巢-子宫轴各部位的形态学变化,且进一步观察补肾助孕方对性腺轴的形态结构改变是否具有改善作用。
研究结果提示米非司酮对LPD模型大鼠的下丘脑-垂体-卵巢-子宫各个环节均产生了不良影响,光镜下下丘脑和垂体各组间差异不明显,但电镜下下丘脑及垂体的超微结构出现了改变,各组间细胞器的结构、外形均有明显差异,经中药干预后,上述情况有所改善,据此可以推测:短期使用米非司酮不仅会影响性腺轴的内分泌功能,同时还能对下丘脑及垂体的超微结构造成影响,但此种影响是可逆的,可通过药物干预得以纠正;米非司酮对卵巢及子宫形态结构的影响较为明显,抑制卵泡的生长,使卵泡数量减少,同时由于米非司酮的溶黄体作用,可观察到模型组大鼠卵巢中黄体数量减少,中药组黄体数量明显增多;模型组子宫腺体数量减少,腺腔变小,间质胶原纤维增多,中药高剂量组子宫内膜厚度增加,腺体数量增多,腺腔增大,肌层间血管数量多,这与课题组的前期研究结果是一致的[17-18]。由此可以推测:补肾助孕方除能改善性腺轴的内分泌功能外,尚能对LPD大鼠的下丘脑-垂体-卵巢轴各部位形态结构起到改善的作用。
[1] 罗颂平,梁国珍,张玉珍,等.助孕3号方防治大鼠自然流产的机理研究[J].中国中西医结合杂志,2003,23(7):522-525.
[2] Sánchez-Criado JE,Bellido C,Galiot F,et al.A possible dual mechanism of the anovulatory action of antiprogesterone RU486 in the rat[J].Reprod Biol,1990,42(3):877-886.
[3] 刘昱磊,罗颂平,梁国珍,等.助孕3号方及拆方防治肾虚黄体抑制动物流产模型的实验研究[J].生殖与避孕,2003,23(1):17-20.
[4] 贺石林,王 建,王净净.中医药科研方法与统计学[M].长沙:湖南科学技术出版社,2000,48.
[5] 艾继辉,朱桂金.黄体功能不全的诊断及对策[J].中国实用妇科与产科杂志,2010,26(10):748-750.
[6] 万怡婷,张 敏.黄体功能不全性不孕症的中西医临床研究进展[J].四川中医,2013,31(5):156-158.
[7] Fatemi HM.The luteal phase after 3 decades of IVF:what do we know?[J]Reprod Biomed Online,2009,19(4):4331.
[8] Devoto L,Fuentes A,Kohen P,et al.The human corpus luteum:life cycle and function in natural cycles[J].Fertil Steril,2009,92(3):1067-1079.
[9] 叶 虹,孙 赟,刘 平.黄体支持与孕激素补充共识[J].生殖与避孕,2015,35(1):1-7.
[10] 李继俊.妇产科内分泌治疗学[M].第3版.北京:人民军医出版社,2014:12-15.
[11] 周惠芳,谈 勇,周建伟.补肾助孕剂治疗黄体功能不全性不孕症的分子机制研究探讨[J].中医药学刊,2005,23(12):2227-2228.
[12] 周惠芳,李爱萍,谈 勇.补肾助孕方对大鼠胚胎着床期子宫内膜ER、PR及整合素a5、β3蛋白表达的影响[J].中国中西医结合杂志,2009,29(7):628-631.
[13] Sitruk-Ware R,Spitz IM.Pharmacological properties of mifepristone:toxicology and safety in animal and human studies[J].Contraception,2003,68(6):409-420.
[14] Theron KE,Penny CB,Hosie MJ.Postcoital administration of RU486 induces a hormonally under-stimulated rat endometrium[J].Reprod Biol,2014,14(3):224-233.
[15] Sarkar NN.Mifepristone:bioavailability,pharmacokinetics and use-effectiveness[J].Eur J Obstet Gynecol Reprod Biol,2002,101(2):113-120.
[16] 于祖茹,章明放,孙洪范,等.米非司酮对子宫内膜异位症大鼠腺垂体促性腺细胞形态结构影响[J].生殖医学杂志,2005,4(14):220-223.
[17] 顿文亮,方泰惠,周惠芳.补肾助孕方对妊娠大鼠子宫内膜的影响[J].南京中医药大学学报,2008,24(3):190-191.
[18] 周惠芳,蒋凤荣,顿文亮,等.补肾助孕方对大鼠胚胎着床期子宫内膜及卵巢形态学的影响[J].陕西中医,2009,30(1):117-118.
