牦牛肠黏膜浆细胞、肥大细胞与杯状细胞的比较观察
2015-11-29杨学军方梅左愈臻李栋赵兴绪贾宁
杨学军方梅左愈臻李栋赵兴绪贾宁*
(1,甘肃农业大学动物医学院 730070;2,中国农业科学院兰州兽医研究所 730046)
牦牛肠黏膜浆细胞、肥大细胞与杯状细胞的比较观察
杨学军1,2方梅1左愈臻1李栋1赵兴绪1贾宁1*
(1,甘肃农业大学动物医学院 730070;2,中国农业科学院兰州兽医研究所 730046)
为了揭示牦牛肠道黏膜浆细胞、肥大细胞与杯状细胞的分布特点与规律,本研究采用组织学及透射电镜等技术,对牦牛十二指肠、空肠、回肠、盲肠、结肠和直肠黏膜浆细胞、肥大细胞与杯状细胞的分布进行了比较研究。结果显示,牦牛肠黏膜有多量浆细胞、肥大细胞与杯状细胞分布,且分布不均匀。浆细胞在整个肠道以盲肠黏膜最丰富;肥大细胞在十二指肠黏膜分布最多;杯状细胞在直肠黏膜分布最多。超微结构显示,浆细胞呈圆形或椭圆形,染色质沿核膜排列,胞浆中有丰富的内质网;杯状细胞呈高脚杯状,细胞顶端含有大量的分泌颗粒而膨大;肥大细胞呈椭圆形,胞质内充满高电子密度的大小不等的膜包颗粒。研究证明,牦牛肠道各段有规律的分布了丰富的浆细胞、肥大细胞与杯状细胞,显示牦牛肠道黏膜具有很强的黏膜免疫屏障功能。
牦牛;肠道黏膜;上皮内淋巴细胞;电镜;分布特点;比较研究
牦牛(yak)是青藏高原特有的珍稀畜种,其对高寒、缺氧、低压、强紫外线照射等多种环境刺激具有极强的适应性[1]。因此,牦牛消化道黏膜免疫特性应具有独特的适应基础。家畜肠道不仅具有对营养物质消化和吸收的功能,同时也具有免疫屏障功能[2]。已有学者对相关动物肠道黏膜上皮内淋巴细胞的分布和数量进行了研究[3,4]。到目前为止,有关牦牛肠道黏膜浆细胞、肥大细胞与杯状细胞的分布特点和比较变化规律,尚未见系统报道。本研究对牦牛肠道黏膜浆细胞、肥大细胞与杯状细胞的分布进行了比较观察,探讨牦牛肠道黏膜的屏障特性。
1 材料与方法
1.1 动物及样品处理
16例牦牛(10♂6♀)均来自青海某屠宰场。经颈动脉放血处死后,迅速切取十二指肠、空肠、回肠、结肠、盲肠和直肠数段。每例牦牛十二指肠、空肠、回肠、盲肠与直肠每隔10cm取一块(约5cm),分别取4块。牦牛结肠较长,每例结肠每隔80cm取一块(约5cm),共取8块。样品置于4%多聚甲醛磷酸缓冲液中固定。同时,在牦牛放血处死后30min内切取肠道各段黏膜(1mm3)数块电镜样品,于2%多聚甲醛–2.5%戊二醛溶液中固定,4℃冰箱保存。
1.2 石蜡切片与染色
固定后的样品,常规石蜡包埋,制备连续切片。HE染色、Masson三色染色、PAS(高碘酸–Schiff氏)染色、MGP(甲基绿派洛宁,Methyl green-Pyronin)染色及MTB(甲苯胺蓝)染色,光镜观察。
1.3 透射电镜观察
对所取电镜材料采用2%多聚甲醛-2.5%戊二醛溶液预固定后,再经1%锇酸PBS溶液后固定,丙酮乙醇梯度脱水,Epon812环氧树脂包埋,超薄切片机切片,醋酸铀与硝酸铅双重染色,透射电子显微镜观察、照相。
1.4 测量与数据处理
采用光镜对牦牛肠道各段连续切片进行观察、拍照,以及测量、统计(采用Image-Pro Plus软件)。每段肠道做连续切片,每隔十张取一张,共取5张。选取肠道各段黏膜上皮细胞排列整齐连续的切片,统计每150个上皮细胞间的淋巴细胞数量。对数据进行单因素方差分析和比较(采用SPSS 17.0软件)。
2 结果
研究结果表明,牦牛肠道浆细胞主要分布于肠黏膜固有层的肠腺之间,胞核位于细胞中央或一端。在整个肠道中浆细胞数量在盲肠分布最丰富(图1)。小肠从十二指肠、空肠到回肠浆细胞逐渐增多且差异显著(P<0.05),盲肠达到最多,从盲肠、结肠至直肠依次减小(表1)。杯状细胞散在于肠黏膜上皮细胞和肠腺柱状细胞之间,细胞顶部因含有糖原颗粒而膨大,底部纤细,呈典型的高脚杯状(图1)。杯状细胞在直肠数量最多(表1)(图2),在盲肠最少,两者差异显著(P<0.05),结肠与直肠之间差异不显著,结肠与盲肠之间差异显著(P<0.05)(表1)。直肠因杯状细胞分泌大量黏液,使黏膜表面覆有厚层黏性薄膜。在小肠杯状细胞由十二指肠到回肠也是逐渐减少且差异显著(P<0.05)(表1)。肥大细胞大多分布于肠黏膜固有层肠腺及小血管和小淋巴管周围,黏膜下层、肌层和浆膜有少量分布。肥大细胞数量在十二指肠黏膜分布最多(图3),由十二指肠到回肠逐渐减少且差异显著(P<0.05)(表1)。大肠肥大细胞与小肠比较相对较少,且结肠和盲肠差异不显著,直肠分布最少(表1)。
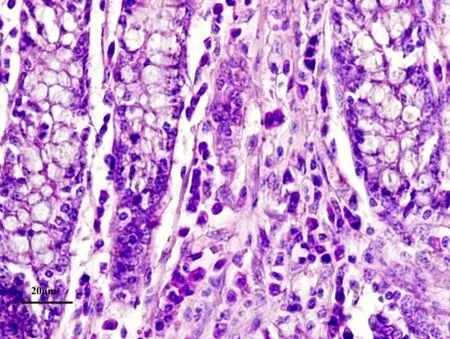
图1 牦牛盲肠黏膜丰富的浆细胞,HE染色×400
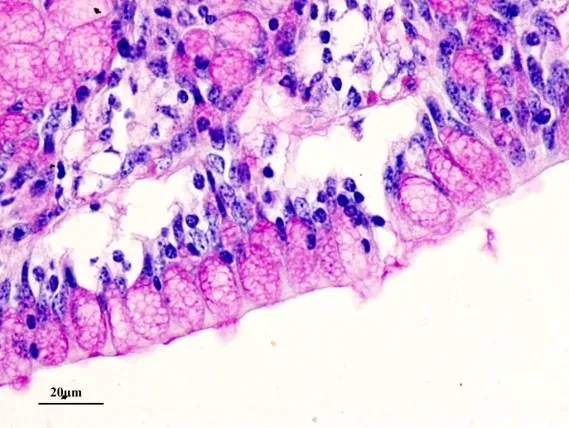
图2 牦牛直肠黏膜丰富的杯状细胞,PAS染色×400
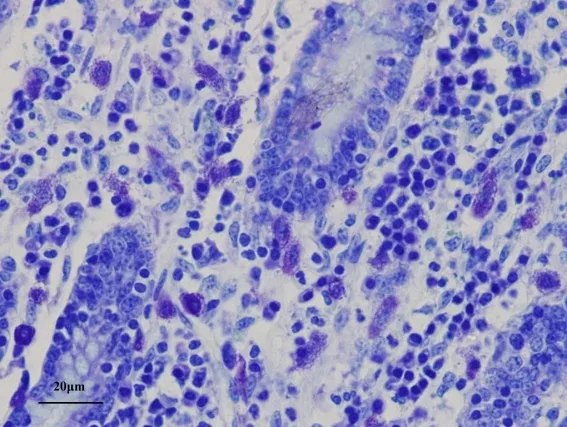
图3 牦牛十二指肠黏膜丰富的肥大细胞,甲苯胺蓝染色×400

表1 牦牛肠道黏膜浆细胞、肥大细胞与杯状细胞分布变化(n=150)
电镜下,浆细胞呈椭圆形,核膜清晰,胞质中除少量线粒体外,几乎充满粗糙型内质网(图4)。杯状细胞顶端呈不规则游离面,散在于柱状细胞之间,细胞间界限轮廓清晰,顶部侧面与相邻细胞以中间连接和桥粒相连,胞质中充满着黏液颗粒,有些颗粒相互融合,成为较大的分泌泡。肥大细胞呈椭圆形,细胞核较大,核膜清晰可见,胞质内有高电子密度的大小不等的圆形颗粒聚集(图5)。
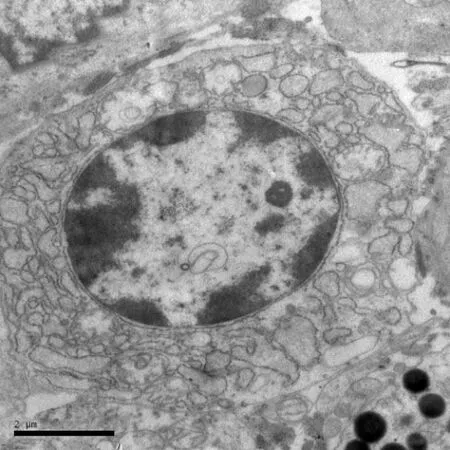
图4 牦牛肠道黏膜浆细胞,×12000
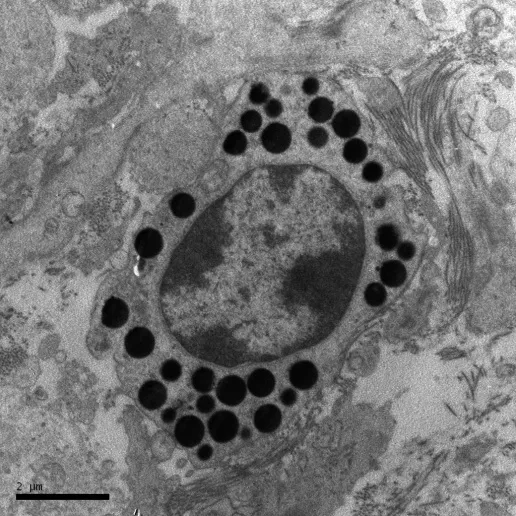
图5 牦牛肠道黏膜肥大细胞,×12000
3 讨论
肠道不仅是消化、吸收营养物质的场所,而且具有重要的免疫屏障功能[5]。黏膜的防御功能与黏膜的各种免疫相关细胞的数量和分布密切相关。浆细胞、肥大细胞与杯状细胞在肠黏膜免疫屏障中扮演着重要的角色。肠黏膜浆细胞、肥大细胞与杯状细胞作为肠道相关淋巴组织中的一个特殊组分,是机体免疫系统中与外来抗原以及微生物发生接触的重要免疫细胞,同时也是产生免疫应答反应的重要细胞[6,7],可诱导产生一系列黏膜免疫应答。因此,肠道黏膜浆细胞、肥大细胞与杯状细胞的数量可以反映肠道局部黏膜免疫屏障的完整及免疫防御功能的完善程度。本研究表明,牦牛肠道浆细胞主要分布于肠黏膜固有层的肠腺之间,胞核位于细胞中央或一端。在整个肠道中浆细胞数量在盲肠分布最丰富。而浆细胞是B淋巴细胞发育的最终阶段,主要参与体液免疫[8,9]。大量IgA可通过分泌片段的介导进入肠黏膜表面,中和抗原物质(如细菌、毒素等),起到清除外来抗原和保护机体的作用[10]。
本研究也表明,牦牛肠道杯状细胞散在于肠黏膜上皮细胞和肠腺柱状细胞之间,细胞顶部因含有糖原颗粒而膨大,底部纤细,呈典型的高脚杯状。杯状细胞在直肠数量最多。直肠因杯状细胞分泌大量黏液,使黏膜表面覆有厚层黏性薄膜。而分泌黏蛋白是杯状细胞的主要功能之一。黏蛋白可对机体肠黏膜起到机械性保护作用,是肠道机械屏障的组成之一[9-11]。
牦牛肠道肥大细胞大多分布于肠黏膜固有层肠腺及小血管和小淋巴管周围,黏膜下层、肌层和浆膜有少量分布。肥大细胞数量在十二指肠黏膜分布最多。而肥大细胞源于骨髓造血干细胞,其增殖分化成熟中随血流迁移至结缔组织。一方面,在动物机体天然免疫中肥大细胞发挥着重要的作用;另一方面,肥大细胞还能产生多种生物活性物质,通过这些生物活性物质参与机体获得性免疫[11,12]。
总之,牦牛肠道黏膜具有丰富的浆细胞、肥大细胞和杯状细胞,其分布并不均匀,它们在牦牛对环境适应及黏膜免疫屏障保护中具有十分重要的作用。
[1]郭文场,刘志宏,杨柏明,等.高原之舟—中国牦牛[J].经济动物,1998(5):4-5.
[2]Gaskins H R.The intestinal immune system:gut reaction and growth of the pig[J].A nim Sci,1996,74(Suppl1):169.
[3]Turck D,Feste A S,Lifschitz C H.Age and diet affect the composition of porcine colonic mucins[J].Pediatric Research,1993,33(66):564-567.
[4]左愈臻,高世杰,邵建华,等.成年牦牛小肠结构及黏膜免疫相关细胞数量变化研究[J].畜牧兽医学报,2011,42(12):1776-1781.
[5]鲁延刚,高世杰,方梅,等.牦牛皱胃组织结构及黏膜免疫相关细胞研究.畜牧兽医学报,2012,43(3):469-475.
[6]宋恩亮,陈耀星,王子旭,等.利杂犊牛小肠各段长度与黏膜结构的发育学变化[J].动物医学进展,2006,27(5):66-70.
[7]宋恩亮,陈耀星,王子旭,等.肉犊牛小肠黏膜免疫相关细胞的数量变化研究[J].畜牧兽医学报,2007,38(10):1109-1114.
[8]Bauer E,Williams B A,Smidt H.Influence of the gastrointestinal microbiota on development of the immune system in young animals.Curr Issues Intest Microbiol,2006,7(2):35-51.
[9]Bauer E,Williams B A,Smidt H.Influence of the gastrointestinal microbiota on development of the immune system in young animals.Curr Issues Intest Microbiol,2006,7(2):35-51.
[10]Owens D,Mcgee M,Boland T.Effect of grass regrowth interval on intake,rumen digestion and nutrient flow to the omasum in beef cattle[J].Animal Feed Science and Technology Vol ume,2008,9(15):21-41.
[11]Metz M,Siebenhaar F,Maurer M.Mast cell functions in the innate skin immune system[J].Immunobiology,2008,213(3):251-260.
[12]姜楠,胡易,陈耀星,等.肥大细胞在动物肠道黏膜免疫屏障中的作用[J].中国畜牧兽医,2011,38(4):167-170.
甘肃省自然科学基金项目,编号:1308RJZA220。
杨学军(1968-),男,硕士,副研究员,主要从事预防兽医学研究。
⋆通讯作者:贾宁,教授,主要从事基础兽医学研究。
