程序死亡性因子配体1蛋白表达与肺癌预后关联性的Meta分析
2015-11-28李时孟潘宝香
李时孟,潘宝香,李 佟,谢 风,王 海
(1.吉林大学中日联谊医院检验科,吉林 长春 130033;2.吉林大学南湖校区医院口腔科,吉林 长春 130012;3.吉林大学中日联谊医院放射线科,吉林 长春 130021)
肺癌是恶性肿瘤致死的首要病因。近年来针对不同肿瘤细胞类型的分子靶向治疗显示出较好的疗效,但肺癌患者的预后情况仍然较差[1-2]。在肿瘤组织中,免疫系统具有抑制和促进肿瘤生长的双向作用[3]。程序死亡性因子 1 (PD-1)/PD-1配体(PD-L1)信号通路的激活可使肿瘤细胞逃避机体免疫监视和杀伤,故阻断PD-1/PD-L1信号通路可以逆转肿瘤免疫微环境,增强内源性抗肿瘤免疫效应[4]。
国内外研究显示:PD-L1的蛋白表达程度与肿瘤预后有一定关联,但并未得出确切结论。Mu等[5]研究显示:PD-L1的高表达提示不良预后,而Boland等[6]的研究表明:PD-L1高表达组与低表达组患者的预后生存期长短并无明显差异。本研究采用Meta分析法评价PD-L1蛋白表达在肺癌预后评估中的价值。
1 资料与方法
1.1 检索策略 计算机检索PubMed、CNKI和万方数据库。检索时间从建库至2014年11月。以“lung cancer”或 “lung carcinoma”和 “PD-L1”或 “B7H1”为检索词在PubMed中检索,检索语种为英文。以中文关键词 “肺癌”、 “PD-L1”、“B7H1”或 “程序死亡性因子配体1”和 “预后”在万方数据库和CNKI中文数据库中检索公开发表的文献。
1.2 文献纳入标准 研究设计方案:队列研究;研究对象:肺癌手术切除后石蜡标本;暴露因素:研究组为PD-L1阳性,对照组为PD-L1阴性,划分依据采用原始文献中的临界值定义;PD-L1蛋白表达水平检测方法:免疫组织化学法和免疫荧光法等;结局指标:风险比 (risk ratio,HR)及其95%可信区间 (95%CI)。
1.3 文献排除标准 ① 动物研究或肺癌细胞系的研究、摘要或综述;② 纳入患者手术前接受过放化疗治疗的文献;③ 检测PD-L1表达物质非蛋白质的文献;④ 原始文献数据不全或未给出K-m生存曲线,无法获得HR数据的文献;⑤ 对重复发表的文章,取资料最完整、最近发表的文献。
1.4 资料提取和质量评价 2名评价者按纳入和排除标准分别筛选文献,如有异议,讨论解决。HR及其95%CI的计算方法:若文献提供HR值及其95%CI或采用Cox模型计算得出了相对危险度 (relative risk,RR)值及其95%CI,直接合并应用;对于给出 K-M 生存曲线的文章,应用Engauge Digitizer 4.1软件对生存曲线进行密集取点后估算 HR值及95%CI[7];排除仅给出PD-L1蛋白表达阴性组和阳性组点生存率的数据。
1.5 统计学分析 采用Stata 11.0统计软件进行数据分析。对多个独立研究的HR进行异质性检验,各研究间具有较好的同质性,用固定效应模型进行合并分析;反之采用随机效应模型进行合并分析[8]。以α=0.05为检验水准。
2 结 果
2.1 文献检索结果及纳入研究的基本特征 在PubMed中按照检索策略所示的关键词检索出106篇文章,初步筛查后纳入11篇文章,根据纳入及排除标准,评估者通过阅读文献全文,最终有7篇文献符合纳入标准。在CNKI中文数据库和万方数据库中按上述检索方案进行检索,共查找到19篇文献,经筛选纳入1篇文献进行研究,最终共纳入8篇文章 (含9个研究),总计1306例患者。研究实验标本均为手术切除的石蜡切片,7个研究采用免疫组织化学法,2个研究采用免疫荧光法来测定组织中PD-L1蛋白的表达水平,每个研究的阳性标准判断不同。纳入研究基本特征见表1。
2.2 纳入研究的方法学质量评价 参考NOS队列分析量表对纳入研究进行质量评估,从队列研究的选择、可比性和结果测量3方面进行质量评价,多数研究未对混杂因素进行校正,纳入文献质量较好。见表1。
2.3 Meta分析结果 各研究结果间存在异质性(P=0.000,I2=84.3%),采用随机效应模型进行Meta分析结果表明:PD-L1蛋白的高表达与肺癌预后无明显关联 (HR=1.267,95%CI:0.780~2.078),见图1。针对患者来源进行亚组分析,其中5个研究患者来源是中国,各研究无统计学异质性 (P=0.723,I2=0.0%)。采用固定效应模型进行Meta分析的结果表明:在中国人群中,高PD-L1蛋白表达水平肺癌患者死亡危险性更高(HR=2.310,95%CI:1.73-3.10),见图 2。4个研究来源是非中国患者,各研究结果之间存在统计学异质性 (P=0.000,I2=83.6%)。非中国人群中,PD-L1蛋白表达水平的高低与肺癌的预后死亡风险尚无关联性 (HR=0.730,95%CI:0.41-1.30)。
表1 纳入研究的基本特征Tab.1 General characteristics of selected studies ()

表1 纳入研究的基本特征Tab.1 General characteristics of selected studies ()
Study Area Year Sample size(High expression/Low expression)Survival time ative 6 Yang[9] China Taiwan 2014 163(65/98) IHC 1.320 (0.07-23.87) NS 7 evaluation Mu[5] China 2010 109(58/51) IHC 1.860 (1.18-2.96) Neg Detection method HR/RR 95%CI PrognosisQuality Velcheti[10] America 2014 155(56/99) IFC 0.610 (0.39-0.95) Positive 7 Greece 2014 303(75/228) IFC 0.630 (0.40-0.98) Positive 7 Zhang[11] China 2014 143(70/73) IHC 2.210 (1.01-4.91) Negative 6 Azuma[12] Japan 2014 164(82/82) IHC 1.602 (1.078-2.380)Negative 5 Ishii[13] Japan 2014 102(73/29) IHC 0.435 (0.241-0.803) Positive 6 Ma[14] China 2011 47(23/24) IHC 2.770 (1.06-7.26) Negative 5 Chen[15] China 2010 120(58/51) IHC 2.946 (1.625-4.382)Negative 7
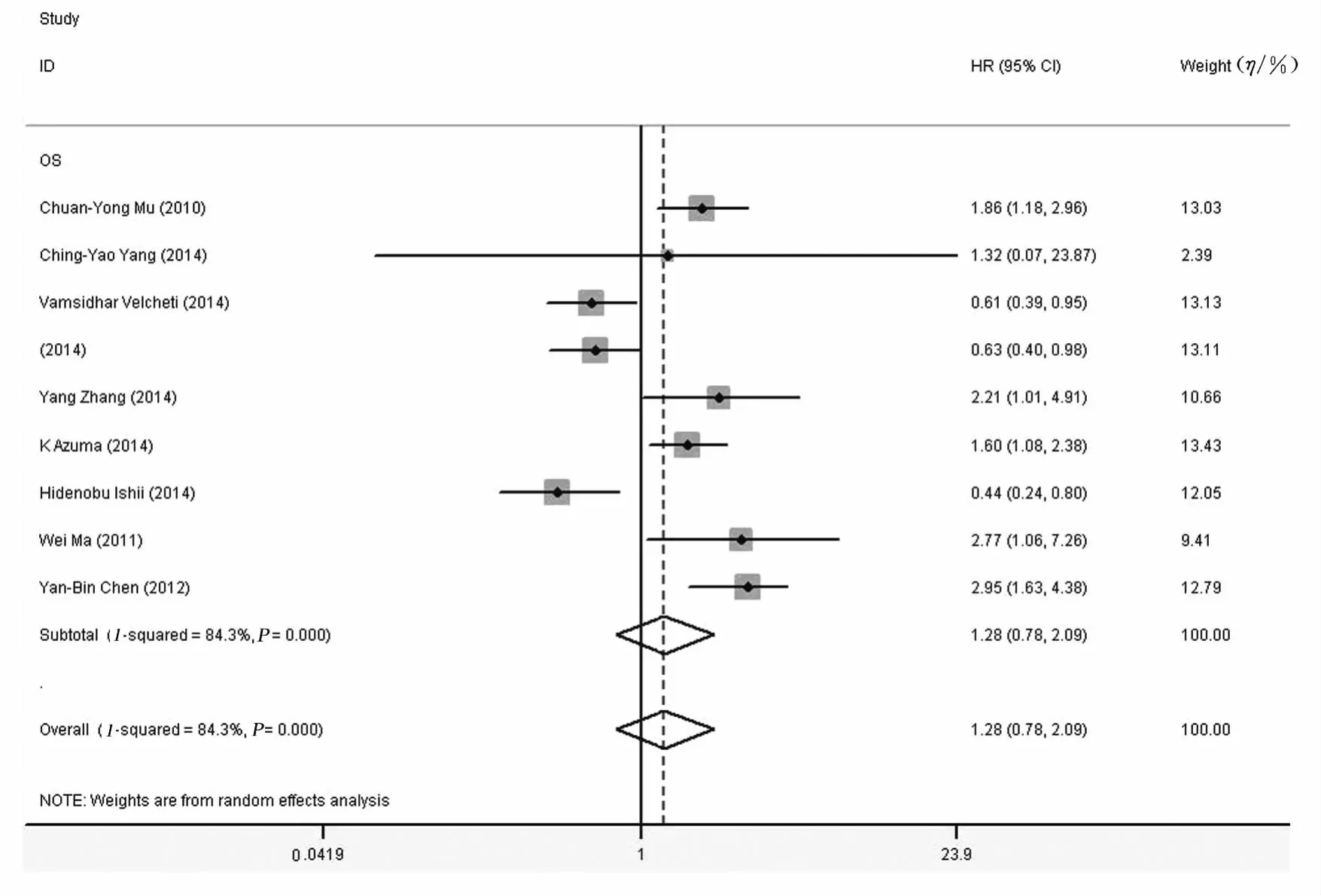
图1 PD-L1蛋白表达水平与肺癌预后风险关联性的Meta分析Fig.1 Meta-analysis on relationship between PD-L1protein expression and risk of prognosis of lung cancer
2.4 发表偏倚和漏斗图分析 由于纳入文章数量有限,经Begger’s漏斗图和Egger’s检验结果显示:文章存在一定的发表偏倚。见图3。

图2 中国人群PD-L1蛋白表达水平与肺癌预后关联性的Meta分析Fig.2 Meta-analysis on relationship between PD-L1protein expression and risk of prognosis of lung cancer in Chinese

图3 PD-L1蛋白表达水平与肺癌预后死亡风险关联性的漏斗图Fig.3 Begger’s funnel plot on relationship between PD-L1 protein expression and risk of prognosis of lung cancer
3 讨 论
PD-1和PD-L1属于抑制性共刺激分子,能够在免疫反应中起负调节作用。PD-1多在外周组织发挥作用,T细胞会在这些组织中受到PD-1抑制性配体的免疫调控[16-17]。故阻断 PD-1和 PD-L1之间的联系,在体外实验中可以增强T细胞反应活性,增强其抗肿瘤效应[18-19]。
PD-L1蛋白广泛表达于多种肿瘤细胞的表面。PD-L1高表达是否为肿瘤患者预后的有利因素一直存在争议。本Meta分析共纳入了8篇文献,提取了9组数据,对1306例肺癌患者进行分析。为了提高HR估算的准确性,排除了仅给出点生存率的研究。本研究结果表明:PD-L1蛋白表达水平的高低与肺癌预后尚未发现明显关联;根据患者来源进行亚组分析,在中国患者中PD-L1蛋白的高表达是肺癌预后的危险因素。
影响肺癌预后因素很多,如肿瘤类型和分期、是否有淋巴转移及治疗方式等。本研究数据仅从原始文献中获得,故不能以临床分期、淋巴转移情况等混杂因素作为分层因素来研究PD-L1蛋白的表达与肿瘤预后的关联性。因此,临床上还需要针对这一问题开展更多高质量的研究。Meta分析是在前人研究结果的基础上进行量化分析的方法,受前人的研究资料质量影响很大,存在一定局限性:①根据研究纳入与排除标准本次Meta分析的研究对象是肿瘤组织冰冻石蜡切片,排除了血液中PDL1蛋白表达水平的分析,故血液标本中PD-L1蛋白表达水平是否对预后有提示作用还有待进一步研究探讨;②纳入研究中仅有1篇是关于小细胞肺癌的研究,需要更多针对小细胞肺癌的研究来证明PD-L1蛋白表达与其预后的关联性;③ 在文献检索过程中,检索语种仅为英文和中文,未包括日语及德语等其他语种资料,可能对研究的全面性有所影响;④各研究间存在较大的异质性,可能与各研究的随访时间不尽相同有关联,本研究针对患者来源进行的亚组分析发现:异质性来源于非中国患者,提示人种亦可能为异质性来源之一;⑤纳入研究数量较少,分析过程中存在一定的发表偏倚;对于部分未提供足够信息准确估算HR及未提供详细统计学数据的无统计学意义文献的删除可能造成一定的选择偏倚;本研究纳入资料多采用免疫组织化学实验技术,然而该方法为半定量技术,也可能导致一定程度上的技术偏倚。
总之,本研究采用经典的Meta分析方法对相关文献进行统计学分析,仅在中国人群中得到阳性结论,原因可能为纳入文献数量较少以及各种偏倚的存在,还需要更多设计严谨、细致的流行病学研究加以证实,以期得到更有说服力的结果。
[1]Mok TS,Wu YL,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma [J].N Engl J Med,2009,361 (10):947-957.
[2]Schiller JH,Harrington D,Belani CP,et al.Comparison of four chemotherapy regimens foradvanced non-small-cell lung cancer [J].N Engl J Med,2002,346 (2):92-98.
[3]Ascierto PA,Addeo R,Cartenì G,et al.The role of immunotherapy in solid tumors:report from the Campania Society of Oncology Immunotherapy (SCITO) meeting,Naples 2014 [J].J Transl Med,2014,12:291.
[4]林 城,陈 雄,刘静南,等.PD-1/PD-L1信号通路在非小细胞肺癌免疫逃逸及其治疗中的研究进展 [J].中国肺癌杂志,2014,17 (10):734-740.
[5]Mu CY,Huang JA,Chen Y,et al.High expression of PDL1in lung cancer may contribute to poor prognosis and tumor cells immune escape through suppressing tumor infiltrating dendritic cells maturation [J].Med Oncol,2011,3 (28):682-688.
[6]Boland JM,Kwon ED,Harrington SM,et al.Tumor B7-H1and B7-H3expression in squamouscell carcinoma of the lung [J].Clin Lung Cancer,2013,14 (2):157-163.
[7]周支瑞,张天嵩,李 博,等.生存曲线中Meta分析适宜数据的提取与转换 [J].中国循证心血管医学杂志,2014,6 (3):243-247.
[8]Tierney JF,Stewart LA,Ghersi D,et al.Practical methods for incorporating summary time-to-event data into meta-analysis[J].Trials,2007,8 (16).doi:10.1186/1745-6215-8-16.
[9]Yang CY,Lin MW,Chang YL,et al.Programmed cell death-ligand 1expression in surgically resected stage Ⅰpulmonary adenocarcinoma and its correlation with driver mutations and clinical outcomes [J].Eur J Cancer,2014(50):1361-1369.
[10]Velchetii V,Schalper KA,Carvajal DE,et al.Programmed death ligand-1expression in non-small cell lung cancer [J].Lab Invest,2014,94 (1):107-116.
[11]Zhang Y,Wang L,Li Y,et al.Protein expression of programmed death 1ligand 1and ligand 2independently predict poor prognosis in surgically resected lung adenocarcinoma[J].Oncol Targets Ther,2014 (7):567-573.
[12]Azuma K,Ota K,Kawahara A,et al.Association of PDL1overexpression with activating EGFR mutations in surgically resected nonsmall-cell lung cancer [J].Ann Oncol,2014 (25):1935-1940.
[13]Ishii H,Azuma K.Significance of programmed cell deathligand 1expression and its association with survival in patients with small cell lung cancer[J].J Thorac Oncol,2015,doi:10.1097/JTO.0000000000000414.
[14]马 薇,罗殿中,陈 源,等.PD-L1和PD-1在非小细胞肺癌中的表达及其临床意义 [J].实用医学杂志,2011,27 (9):1551-1554.
[15]Chen YB,Mu CY, Huang JA.Clinical significance of programmed death-1ligand-1expression in patients with nonsmall cell lung cancer:a 5-year-follow-up study [J].Tumor,2012,98 (6):751-755.
[16]Freeman GJ,Long AJ,Iwai Y,et al.Engagement of the PD-1immunoinhibitory receptor by a novel B7familymember leadstonegativeregulationof lymphocyteactivation [J].J Exp Med,2000,192 (7):1027-1034.
[17]Dong H,Strome SE,Salomao DR,et al.Tumor-associated B7-H1promotes T-ell apoptosis:apotential mechanism of immune evasion [J].Nat Med,2002,8 (8):793-800.
[18]Topalian SL,Drake CG,Pardoll DM.Targeting the PD-1/B7-H1 (PD-L1 ) pathway to activate anti-tumor immunity [J].Curr Opin Immunol,2012,24 (2):207-212.
[19]Iwai Y,Ishida M,Tanaka Y,et al.Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1blockade [J].Proc Natl Acad Sci U S A,2002,99 (19):12293-12297.
