干扰素α-2b联合利巴韦林治疗后慢性丙型肝炎患者外周血细胞数量的变化及其临床意义
2015-11-28马琳媛孔文丽杨以良李玉香
马琳媛,张 鹏,陈 倩,孔文丽,杨以良,李玉香,潘 煜
(1.吉林大学第一医院肝胆胰内科,吉林 长春 130021;2.吉林大学第一医院感染症科,吉林 长春 130021)
丙型肝炎 (丙肝)是由丙肝病毒 (hepatitis C virus,HCV)引起,以肝脏损害为主的一组全身性感染性疾病,人对HCV普遍易感,我国北方地区HCV以1b和2a型所占比例较高[1]。目前全球HCV感染率约为3%,可引起慢性肝炎、肝纤维化和肝癌[2]。研究[3-5]显示:干扰素联合利巴韦林是目前治疗慢性丙型肝炎的标准方案,且治疗后肝纤维化程度可改善,肝癌发生率明显降低。因此,慢性丙型肝炎抗病毒治疗尤为重要。但抗病毒治疗存在诸多不良反应,尤其是外周血细胞数量减少常可导致干扰素或利巴韦林药物减量,严重者需要提前撤出治疗,因此对治疗效果产生极大的不良影响[6]。本研究将对普通干扰素α2b (IFN-α2b)联合利巴韦林抗病毒治疗的慢性丙型肝炎患者外周血细胞数量变化情况进行探讨,归纳中性粒细胞、血红蛋白和血小板变化规律,阐明基线病毒及宿主因素对外周血细胞数量变化的影响。
1 资料与方法
1.1 研究对象 选择2009—2010年吉林大学第一医院肝胆胰内科在吉林省扶余县更新乡和德胜镇进行的流行病学调查中发现的慢性丙型肝炎患者343例,均为初治,诊断标准参照 《2010丙型肝炎防治指南》,排除标准:①失代偿期肝硬化患者(符合腹水、出血性静脉曲张、肝性脑病其中之一者);②同时并发慢性乙型肝炎、自身免疫性肝病和酒精性肝病的患者;③怀孕、甲状腺功能紊乱、应用放射性药物、存在心血管疾病、肿瘤等基础疾病者;④外周血细胞水平过低不符合抗病毒治疗指征者。其中男性246例,女性97例,患者平均年龄(49.8±7.8)岁,体质量指数(BMI)为(23.4±2.9)kg·m-2。肝纤维化分期:F1期129例 (48.1%),F2期90例 (33.6%),F3期28例 (10.4%),F4期21例 (7.8%),另外75例患者基线肝纤维化数据缺失。
1.2 主要试剂和仪器 血常规试剂盒由美国Beckman Coulter公司提供,肝功试剂盒由美国强生公司提供,HCV抗体试剂盒由英科新创 (厦门)有限公司提供,HCV核酸检测试剂盒由德国罗氏诊断有限公司提供,HCV RNA基因分型多色荧光PCR试剂盒由北京巴奥瑞欣生物技术有限公司提供。COULTER Ac.T 5diff AL血液分析仪 (美国Beckman Coulter公司);VITROS 350生化分析仪 (美国强生公司),Thermo SCIENTIFIC MULTISKAN分析仪 (中国赛默飞世尔科技有限公司,COBAS AmpliPrep/COBAS TaqMan HCV Test仪 (德国罗氏公司),7500Real-Time PCR System (北京巴奥瑞欣生物技术有限公司)。
1.3 检测方法 通过细胞化学光吸收和体积分析技术检测血常规;全干化学生化分析仪检测肝功;应用酶联免疫标记法检测HCV抗体;应用荧光定量PCR法检测丙型肝炎病毒核酸,检测限度15IU·mL-1;利用荧光定量PCR分型检测HCV RNA基因分型。
1.4 治疗方法 INF-α2b500万U、隔日1次、皮下注射,利巴韦林15mg·kg-1·d-1口服;疗程48周;在基线、第2周、12周、24周、36周和48周时对患者进行血常规、HCV RNA定量等检测,治疗结束后60、72和96周进行随访。当中性粒细胞、血红蛋白及血小板降至规定值以下时依据 《2010丙型肝炎防治指南》进行减量或停药处理,并长期随访观察。
1.5 统计学分析 应用SPSS 18.0统计软件进行数据处理。患者性别、肝纤维化分期、HCV基因型等计数资料多组间比较采用卡方检验,组间两两比较采用Fisher精确检验;年龄和BMI以表示,组间比较采用方差分析 (Anova);血常规、肝功等其他计量资料多组间比较采用Kruskal-Wallis检验,两两组间比较采用 Mann-Whitney U检验。
2 结 果
2.1 药物诱导的外周血细胞数量减少发病率 治疗过程中外周血细胞数量发生改变,其中中性粒细胞减少症139例 (40.5%),贫血166 例(48.4%),血小板减少症137例(39.9%)。此外,治疗结束后仍有患者出现外周血细胞改变,60周时中性粒细胞减少症2例 (1.0%),血小板减少症3例(1.6%);72周时出现血小板减少症1例(0.4%);96周出现贫血1例 (0.6%),血小板减少症3例 (1.9%)。
2.2 治疗过程中外周血细胞数量变化趋势 治疗2周时中性粒细胞即有明显下降,至第12周时降到最低值,平均降低1.2×109L-1,12周后出现缓慢上升,治疗结束时 (48周)虽较12周恢复明显,但仍明显低于治疗前水平。停止治疗后即48~60周中性粒细胞水平仍有明显恢复,60周后趋于平稳,但仍稍低于治疗前水平;而血红蛋白(hemoglobin,Hgb)同中性粒细胞变化相似,治疗2周时即有明显下降,持续下降至12周时降到最低值,平均降低2.2g·dL-1,12~24周出现小幅度上升,但24~36周再次降至约12周时Hgb水平,36周后血红蛋白呈现持续上升趋势,治疗结束时 (48周)仍远低于治疗前水平。停止治疗后即48~72周Hgb水平仍有明显恢复,72周后趋于平稳,与治疗前基本持平;血小板计数在治疗开始即有明显下降,2~4周时稍有缓解,但仍明显低于治疗前水平,4周后再次下降,至12周时降至最低,平均下降25.7×109L-1,12周后持续上升至72周,略高于治疗前水平。见表1。
表1 不同时间外周血细胞数量Tab.1 Number of cells in peripheral blood at different time ()

表1 不同时间外周血细胞数量Tab.1 Number of cells in peripheral blood at different time ()
3.5±1.4 2.3±0.9 2.3±0.9 2.3±0.9 2.4±1.1 HGB(g·dL-1) 15.4±2.4 14.0±2.4 13.5±2.3 13.3±2.1 13.8±1.9 PLT(×109L-1) 174.0±68.0 150.0±57.0 159.0±66.0 150.0±61.0 152.0±61.0 Variable 36weeks 48weeks 60weeks 72weeks 96w Variable 0week 2weeks 4weeks 12weeks 24weeks ANC(×109L-1)2.5±1.2 2.9±1.2 3.3±1.2 3.3±1.2 3.3±1.2 HGB(g·dL-1) 13.3±2.0 13.6±1.9 14.9±1.7 15.2±1.8 15.3±1.7 PLT(×109L-1) 156.0±62.0 164.0±61.0 171.0±62.0 183.0±74.eeks ANC(×109L-1)0 177.0±53.0
2.3 慢性丙型肝炎患者抗病毒治疗过程中发生外周血细胞数量减少的影响因素 基线中性粒细胞绝对值、血小板计数、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶 (ALT)和肝纤维化程度与中性粒细胞减少症的发生及严重程度有关联(P<0.05)。性别与贫血的发生有关联 (P<0.05),基线Hgb水平与贫血的发生及严重程度均有关联 (P<0.05)。性别、基线中性粒细胞绝对值、血小板计数、AST、ALT、γ-谷氨酰转肽酶(γ-GT)和肝纤维化程度与血小板减少症的发生有关联 (P<0.05)。见表2~4。
3 讨 论
干扰素联合利巴韦林方案是目前公认的治疗慢性丙型肝炎的标准方案,但存在诸多不良反应,其中外周血细胞数量减少是导致药物减量或提前撤出治疗的最常见原因之一,进而严重影响持续病毒学应答 (SVR)的实现[6]。

表2 基线因素对中性粒细胞数量减少的影响Tab.2 Influence of baseline factors in decline of number of neutrophils
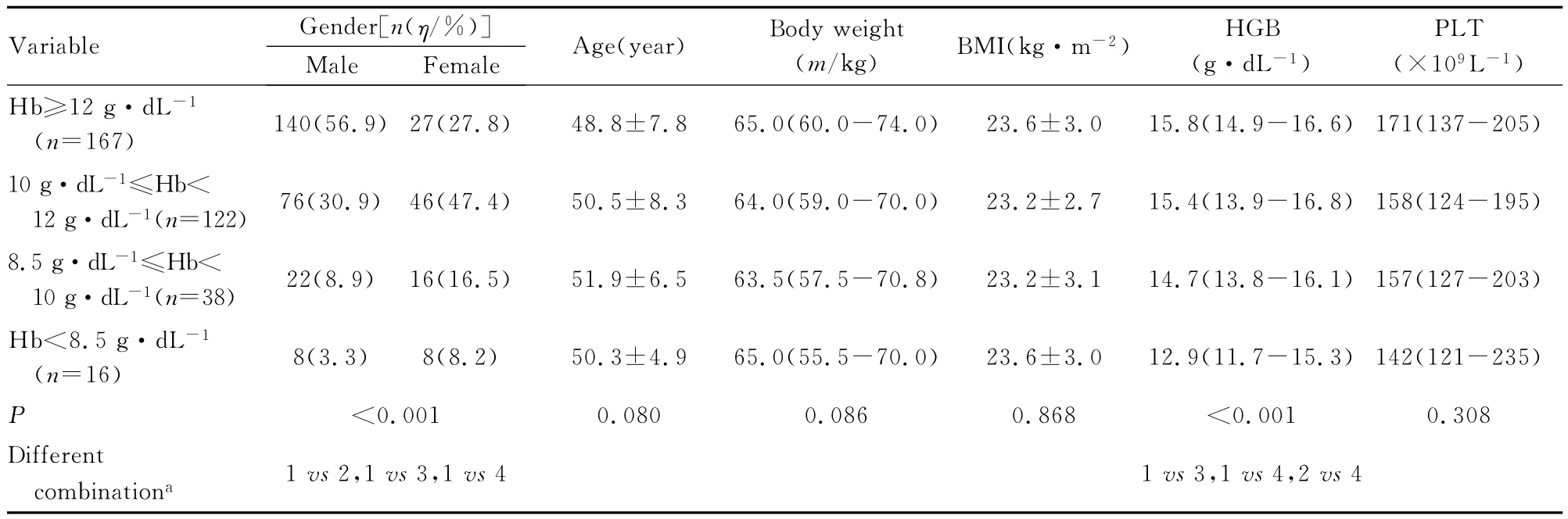
表3 基线因素对血红蛋白数量减少的影响Tab.3 Influence of baseline factors in decline of number of hemoglobin

续表3
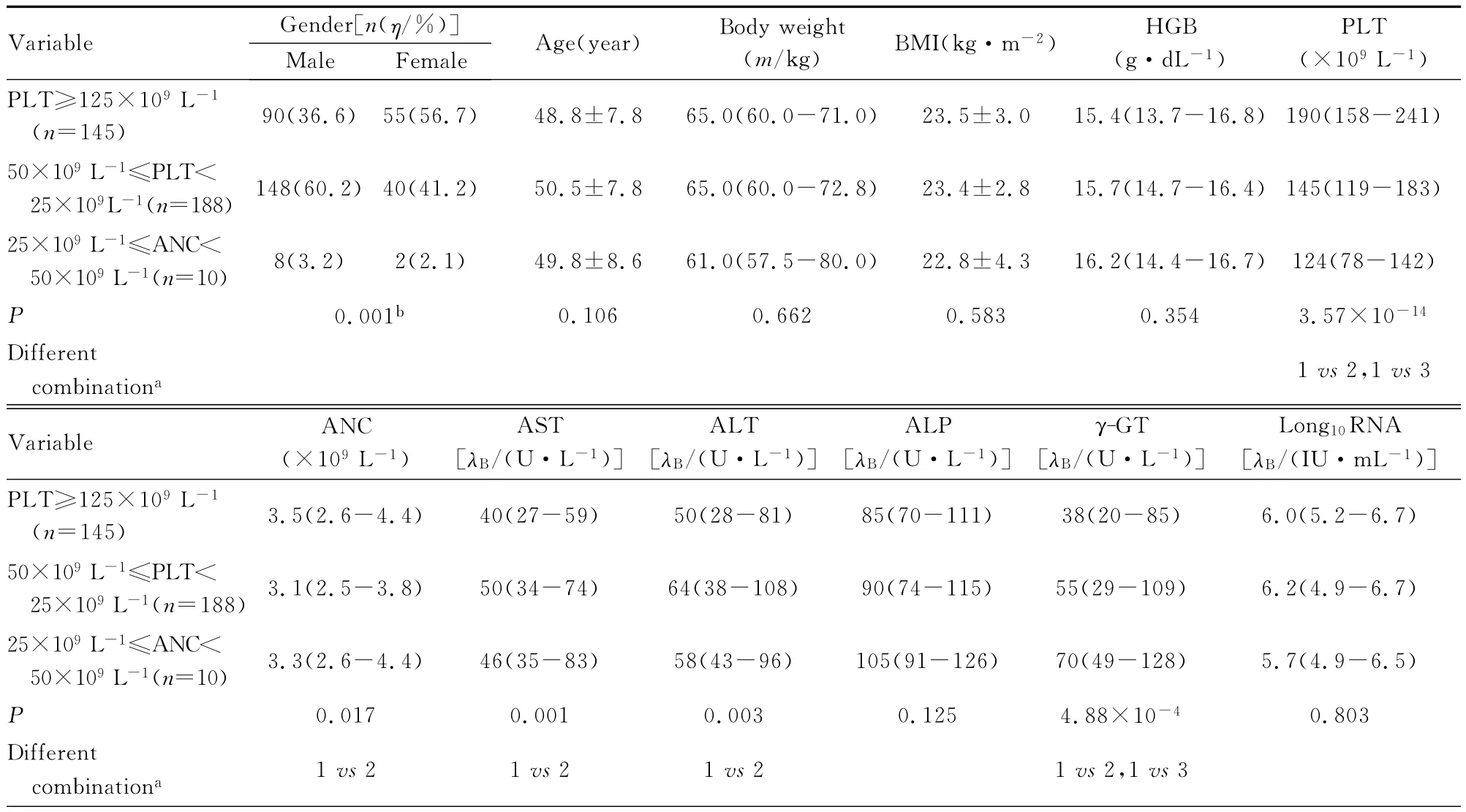
表4 基线因素对血小板计数减少的影响Tab.4 Influence of baseline factors in decline of number of plateletsin

续表4
慢性丙型肝炎抗病毒治疗过程中引发粒细胞减少症及血小板计数降低的发生机制目前尚未完全明确,可能与干扰素治疗过程中引发的一过性外周血细胞异常分布有关[7]。过去认为粒细胞减少还可能与INF-α对骨髓祖细胞增殖的直接抑制有关联[8]。而近年几项研究对此观点提出了质疑,张永宏等[9]认为:粒细胞减少可能与粒细胞集落刺激因子或巨噬细胞粒细胞集落刺激因子分泌下降有关联。此外,INF-α所致中性粒细胞计数下降可能与患者基因多态性即INF-α信号通路基因的单核苷酸多态性 (SNPs)有关联,故表现为个体差异[10]。而血红蛋白降低与干扰素及利巴韦林均有关联,但利巴韦林对Hgb破坏作用更为显著。利巴韦林通过细胞表面ES-核苷载体进入细胞发挥抗病毒作用,而这种载体也存在于红细胞表面[11],因此利巴韦林在发挥抗病毒作用的同时也破坏了红细胞,且多数学者认为利巴韦林相关性贫血具有药物剂量依赖效应。
在本研究中,中性粒细胞减少症发病率为40.5%,贫血发病率为48.4%,血小板减少症发病率为 39.9%, 与 其 他 类 似 研 究[9,12-13]的 结 果 相符,但贫血的发病率明显高于D’Avolio等[14-15]的两项研究。但本研究中外周血细胞数量减少绝大多数为轻度,且未出现一例重度中性粒细胞减少或血小板减少患者,这与其他研究结果均不相同,考虑与本研究随访时间密集、临床观察细致,经临床综合评估后及时进行药物减量有关联。这一结果说明可以通过密切随访和临床及时干预避免因为重度外周血细胞数量减少而导致停药的现象。
本研究结果显示:外周血细胞减少在第2周发病率最高,集中发病在2~14周,这与现有的相关研究[16-19]结果不符,这一结果需来自不同种族及不同地区的大样本研究进行验证,同时也提醒临床医生在抗病毒治疗的前3个月更应密切监测外周血细胞数量变化并及时给予临床干预,从而避免因外周血细胞数量减少而导致的药物减量甚至停药。
在对慢性丙型肝炎抗病毒治疗过程中影响外周血细胞数量减少因素分析中本文作者发现:影响血小板减少的基线因素同影响中性粒细胞减少的因素相似,即基线中粒细胞绝对值及血小板水平越低、肝纤维化程度越重、基线AST和ALT越高,越易出现中性粒细胞及血小板减少。但二者不同的是性别对血小板降低有影响,而对中性粒细胞减少无影响,女性血小板降低发病率显著低于男性,这一观点在相关研究中并未发现,雌激素对血小板减少是否具有保护作用还需进一步研究。Lashin等[19]认为:中性粒细胞减少严重程度与性别有关联,女性较男性更易发生中、重度中性粒细胞减少,这一现象在本研究中并未发现。本研究结果显示:女性比男性贫血发生率高,基线Hgb水平越低,治疗过程中越易发生贫血。且近年来性别对贫血的影响已引起较高重视,Scherzer等[20]认为:第4周男性Hgb水平下降较女性更明显,而绝经后女性和男性相比4周Hgb水平下降程度并无明显差异。本组研究对象平均年龄约50岁,女性贫血发病率明显高于男性 (女性72.2%,男性43.1%),因此认为雌激素可能与利巴韦林相关溶血性贫血存在一定关联,而相关机制目前仍在探讨中。
[1]Su YY,Liu HX,Wang N.Hepatitis C virus genotypes in China:a systematic review [J].Zhonghua Liu Xing Bing Xue Za Zhi,2013,34 (1):80-84.
[2]Naderi M,Gholiopour N,Zolfaqhari MR,et al.Hepatitis C virus and vaccine development [J].Int J Mol Cell Med,2014,3 (4):207-215.
[3]Aqnesod D,De Nicolo A,Simiele M,et al.Development and validation of a useful UPLC-MS/MS method for quantification of total and phosphorylatedribavirin in peripheral blood mononuclear cells of HCV+patients [J].Pharm Biomed Anal,2014,90 (5):119-126.
[4]Hirakawa M, Ikeda K, Arase Y, et al.Hepatocarcinogenesis following HCV RNA eradication by interferon in chronic hepatitis patients [J].Int Med(Tokyo,Japan),2007,47 (19):1637-1643.
[5]Fernández-Rodríguez CM,Alonso S,Martinez SM,et al.Peginterferon plus ribavirin and sustained virological response in HCV-related cirrhosis:outcomes and factors predicting response [J].Ame J Gastroenterol,2010,105 (10):2164-2172.
[6]Oze T,Hiramatsu N,Yakushijin T,et al.Pegylated interferon alpha-2b (Peg-IFN α-2b)affects early virologic response dose-dependently in patients with chronic hepatitis C genotype 1during treatment with Peg-IFN α-2bplus ribavirin [J].Viral Hepatitis,2009,16 (8):578-585.
[7]白金锡,白贞子,郑 艳.36例慢性丙型肝炎抗病毒副作用及对策 [J].中国实验诊断学,2013,17 (2):346-347.
[8]Ganser A,Carlo-Stella C, Greher J,et al. Effect of recombinant interferons alpha and gamma on human bone marrow-derived megakaryocytic progenitor cells [J].Blood,1987,70 (4):1173-1179.
[9]Liu YL,Du XF,Chen XY,et al.Bone marrow suppression or active proliferation?An analysis of neutropenia after pegylated interferon treatment of patients with chronic hepatitis C [J].Scand J Infect Dis,2013,45 (12):939-943.
[10]Wada M,Marusawa H,Yamada R,et al.Association of genetic polymorphisms with interferon-induced haematologic adverse effects in chronic hepatitis C patients [J].J Viral Hepatitis,2009,16 (6):388-396.
[11]Khakoo S,Glue P, Grellier L,et al. Ribavirin and interferon alfa2bin chronic hepatitisC;assessment of possible pharmacokinetic and pharmacodynamic interactions [J].J Pharmacol,1998,46 (6):563-570.
[12]Hadziyannis SJ,Sette Jr H,Morgan TR,et al.PEGASYS International Study Group: Peginterferon-alpha2aand ribavirin combination therapy in chronic hepatitis C:a randomized study of treatment duration and ribavirin dose [J].Ann Intern Med,2004,140 (5):346-355.
[13]Manns MP, McHutchison JG, Gordon SC, et al.Peginterferon alfa-2bplus ribavirin compared with interferon alfa-2bplus ribavirin for initial treatment of chronic hepatitis C:a randomised trial [J].Lancet,2001,358 (9286):958-965.
[14]D’Avolio A,De NicolòA,Cusato J,et al.Association of ITPA polymorphisms rs6051702/rs1127354instead of rs7270101/rs1127354as predictor of ribavirin-associated anemia in chronic hepatitis C treated patients [J].Antiviral Res,2013,100 (1):114-119.
[15]D’Avolio A,Ciancio A,Siccardi M,et al.Inosine triphosphatase polymorphisms and ribavirin pharmacokinetics as determinants of ribavirin-associate anemia in patients receiving standard anti-HCV treatment [J].Ther Drug Moni,2012,34 (2):165-170.
[16]Rotman Y,Katz L,Cohen M,et al.Low weight predicts neutropenia and peginterferon alfa-2adose reductions during treatment for chronic hepatitis C [J].J Viral Hepatitis,2009,16 (5):340-345.
[17]Roomer R,Hansen BE,Janssen HLA,et al.Risk factors for infection during treatment with peginterferon alfa and ribavirin for chronic hepatitis C [J].Hepatology,2010,52 (4):1225-1231.
[18]Roomer R, Hansen BE, Janssen HLA, et al.Thrombocytopenia and the risk of bleeding during treatment with peginterferon alfa and ribavirin for chronic hepatitis C [J].J Hepatol,2010,53 (3):455-459.
[19]Lashin AH,Shaheen YA,Metwally MA,et al.Incidence and predictors of hematological side effects in chronic HCV Egyptian patients treated with pegylated interferon and ribavirin [J].Indian J Gastroenterol,2013,32 (5):316-323.
[20]Scherzer TM,Stättermayer AF,Stauber R,et al.Effect of gender and ITPA polymorphisms on ribavirin-induced anemia in chronic hepatitis C patients [J].J Hepatol,2013,59 (5):964-971.
