高渗葡萄糖局部注射治疗膝骨关节炎疗效的Meta分析
2015-11-28叶冬梅林紫薇徐义明白跃宏
叶冬梅,陈 琛,林紫薇,徐义明,白跃宏
(1.上海交通大学附属第六人民医院康复医学科,上海 200233;2.大连大学医学院解剖学教研室,辽宁 大连 116021;3.上海市第十人民医院内分泌与代谢科,上海 200072)
膝骨关节炎 (knee osteoarthritis,KOA)是一种常见的慢性退行性疾病。据统计,55岁以上的中老年人每4人中就有1人出现膝关节疼痛或更严重症状的患者[1]。虽然KOA引起膝关节疼痛的病因学尚无定论,但一般认为疼痛源于包括关节囊、滑膜、骨、半月板及关节囊周围支持韧带和肌腱等膝关节及周围结构[2]。KOA发病率高,可不同程度地影响患者的膝关节活动及行走能力,给患者带来极大的痛苦,至今尚缺乏有效的治疗方法和药物。对于KOA的标准治疗一般包括物理疗法、抗炎治疗、口服或关节内注射高分子多糖体 (玻璃酸钠)补充治疗及手术治疗等。增生疗法是用注射法治疗慢性肌肉骨骼疼痛的补充替代疗法,其原理是在疼痛局部注射趋化药物,引起局部炎症反应,促进纤维母细胞增生。该方法常用的注射药物分为3类,即渗透剂、刺激剂及趋化药物。在3类药物中,最常使用的是渗透剂,如高渗右旋葡萄糖 (高渗糖)、硫酸锌及甘油。这类药物可使局部细胞脱水达到 “渗透休克”的效果[3]。其中高渗糖是应用最多的注射药物。研究[4]表明:高渗糖注射联合物理治疗可有效缓解由挥鞭样损伤引起的中等程度的颈部疼痛。Miller等[5]研究发现:高渗糖可以缓解腰椎间盘突出症引发的疼痛。从长期随访结果来看,高渗糖注射治疗对骶髂关节疼痛的缓解率是曲安奈德治疗组的5.7倍[6]。应用高渗糖注射治疗手指骨性关节炎4个月,疼痛缓解率达42%,手指运动功能显著提高[7]。高渗糖用于治疗KOA的多个临床研究报道[8-10]显示:高渗糖关节内注射后患者膝关节疼痛显著改善,膝关节肿胀及前交叉韧带松弛引起的错动感亦得到改善[11]。但是,有学者[12]提出:关节内单纯注射无菌水也有着潜在的治疗效果,这对高渗糖应用的治疗效果提出了质疑,同时也表明高渗糖治疗KOA的疗效存在争议。本研究采用Meta分析的方法,综合评价应用高渗糖治疗KOA的有效性及其风险。
1 资料与方法
1.1 检索方法 英文检索策略式:以dextrose AND(osteoarthritis OR arthritis OR arthralgia OR joint disease OR osteoarthritis OR osteoarthrosis OR gonarthrosis OR degenerative arthritis OR arthritis)AND (knee OR knee-joint)为检索策略进行交叉检索;计算机检索外文数据库Pubmed/Medline, Scopus 和 the Cochrane Library。中文检索策略式:右旋葡萄糖并 (骨性关节炎或关节病或关节痛)并 (膝或膝关节)为检索策略进行交叉检索;计算机检索中文数据库CNKI、维普及万方数据库。文献检索起止时间均为从建库到2014年6月。语言限制为英文和中文。为了尽量避免漏查文献,对入选文献的参考文献进行二次检索,使用Google学术检索相关文献。剔除重复发表、摘要、综述、会议、经验总结和生活保健用药等文献。
1.2 文献纳入标准 纳入标准:①试验设计。所纳入文献必须为随机对照试验 (randomized controlled trials,RCT);②受试人群。年龄>18岁;诊断为膝骨KOA,膝关节疼痛 >6个月,未进行全膝关节置换术;③干预措施。高渗糖注射于关节腔内及膝关节周围韧带;对照组:注射安慰剂 (无菌水)于关节腔及周围韧带;④研究观察指标。必须包括膝关节疼痛、活动能力及僵硬等指标之一。排除标准:①重复发表;②未充分提供原始数据;③试验设计不严谨 (如样本资料交待不清楚等);④中文和英文以外的其他语种文献。
1.3 质量评价 所选文献由2名评价员按Cochrane系统手册、采用Jadad评分[13]的治疗评分标准进行,独立对纳入的所有文献在随机序列的产生、盲法、退出与失访3方面进行质量评分:Jadad量表满分5分,2分以下属低质量研究,3分及以上的研究可以认为质量较高。
1.4 资料提取 本研究由2名研究者分别进行摘录。在资料提取之前决定摘录的内容。摘录的内容包括:①文献的相关资料,如论文作者和发表年份等;②试验设计细节,如随机化、分配隐藏、意向性分析、双盲或单盲、平行或交互等;③受试者的特征和受试者的例数;④干预措施等。
1.5 疗效指标 ①疼痛强度评定使用视觉模式评分法,采用视觉模拟评定法 (VAS)、膝关节疼痛评分 (KPS);② 膝关节活动能力评定采用西安大学和麦克马斯特大学的骨关节炎指数 (WOMAC)膝关节生理功能评分;③僵硬评价采用WOMAC膝关节僵硬评分;④安全性评价包括记录治疗期间发生不良反应的事件及由于健康因素退出研究的事件例数。对随访指标分析分为短期疗效和长期疗效。短期定义为干预终点 ≤24周,长期定义为干预终点>25周。
1.6 统计学分析 采用Cochrane协作网提供的RevMan 5.1统计学软件进行统计学处理。连续变量用标准化均差法 (Std.mean difference,SMD)及其95%的可信区间 (confidence interval,CI)表示。对纳入的研究进行同质性检验,如果P≥0.1、I2<50%,则认为各研究间无统计学差异,采用固定效应模型,反之则采用随机效应模型。对纳入的研究进行敏感性分析,剔除低质量后,对剩余的研究进行Meta分析,所得结果与未剔除前的结果进行比较,探讨对总效应的影响。若变化不大,说明纳入文献的稳定性好,结果可信;反之,纳入文献的稳定性差。绘制漏斗图描述发表偏倚,并采用Begg’s检验对发表偏倚进行分析。
2 结 果
2.1 检索结果 计算机检索出相关文献85篇 (其中54篇来自Pubmed/Medline,27篇来自Scopus,4篇来自the Cochrane Library,0篇来自CNKI、维普及万方数据库。去除重复15篇。通过阅读摘要,排除临床病例报告和综述、动物实验、剔除中文和英文以外的其他语种文献62篇,筛选出与研究目的相关的文献8篇。通过阅读全文,排除实验设计不严谨、未充分提供原始数据等不可纳入的文献3篇,最后共有5篇文献符合纳入标准,均为英文文献。
2.2 文献特征 纳入的5篇文献中,共计234例患者的355例患膝,其中高渗糖关节腔内注射201例,生理盐水膝关节腔内注射 (对照组)154例。各文献均进行了患者特点的基线对比,包括年龄、性别、体质量指数 (BMI)、注射前关节疼痛、僵硬及活动功能等。所有纳入的研究中,高渗糖浓度有所不同,即25.0%、20.0%、12.5%和10.0%4种,但各研究注射技术类似、研究的对照设计方法类似。由于纳入文献数量有限,所以本研究未将文献分亚组分析。纳入研究的基本情况见表1。
2.3 Meta分析 膝关节疼痛改善的短期效果比较:5篇文献 (共355例患膝)正确合理地描述了短期疼痛改善的情况,其中高渗糖注射组201例,对照组154例。异质性分析显示P<0.00001,I2=93%,存在异质性,采用随机效应模型。Meta分析显示:从短期效果来看,高渗糖的使用可明显改善膝关节疼痛 (SMD =-1.45,95%CI:-2.42~-0.48,P=0.003)(图1)。排除低质量研究后重新进行Meta分析的结果与未排除前比较改变不明显 (P均>0.05),结果仍提示高渗糖的使用可明显改善膝关节疼痛,说明该结果敏感性低,具有临床一致性,结果较为稳健可信。膝关节疼痛改善的长期效果比较:2篇文献 (共156例患膝)正确合理地描述了长期疼痛改善的情况。其中高渗糖注射组101例,对照组55例。异质性分析显示P=0.005,I2=88%,存在异质性,采用随机效应模型。Meta分析显示:从长期效果来看,高渗糖的使用可明显改善膝关节疼痛 (SMD=-2.20,95%CI: - 3.45 ~ - 0.94,P =0.0006)。见图2。
膝关节活动能力改善情况的比较:3篇文献(共240例患膝)正确合理地描述了膝关节活动能力改善的情况。其中高渗糖注射组122例,对照组118例。异质性分析显示P=0.001,I2=85%,存在异质性,采用随机效应模型。Meta分析显示:高渗糖的使用可明显改善膝关节活动能力 (SMD=-2.00,95%CI:-2.84~-1.55,P<0.00001)。见图3。
僵硬改善情况的比较:2篇文献 (共129例患膝)正确合理地描述了膝关节僵硬改善地情况。其中高渗糖注射组64例,对照组65例。异质性分析显示P=0.15,I2=51%,存在异质性,采用随机效应模型。结果表明:高渗糖注射对关节僵硬症状有改善的趋势,但统计学结果差异无显著性(SMD=-0.05,95%CI:-1.02~0.03,P=0.07)。见图4。
漏斗图分析显示:漏斗图分布欠对称 (图5),Begg’s检验P=0.021,表明纳入的研究存在发表偏倚。
不良反应:在纳入本研究的所有文献中,1篇文献[9]提到1例患者注射后出现膝关节弥漫性水肿而停止治疗。1篇文献[8]提及1例患者出现注射后膝关节及其远端麻木,未予特殊治疗症状2h后缓解。3篇文献[10,12,14]提到对照组和实验组均有患者出现注射相关疼痛,但均未对实验组与对照组研究对象的疼痛情况进行统计分析,症状均于注射次日缓解。
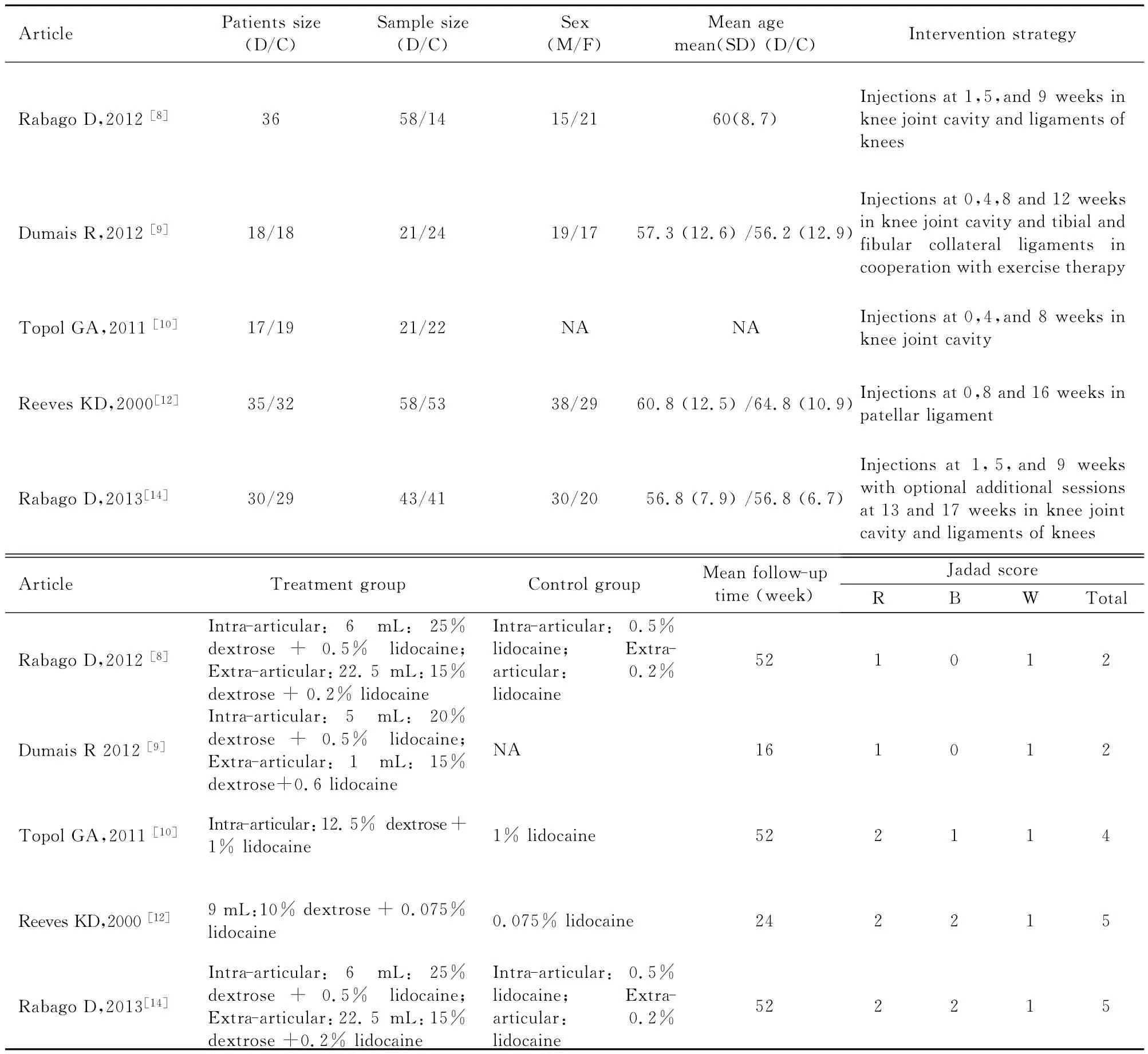
表1 纳入研究的基本情况和质量评价结果Tab.1 General characteristics of all studies and quality assessment results
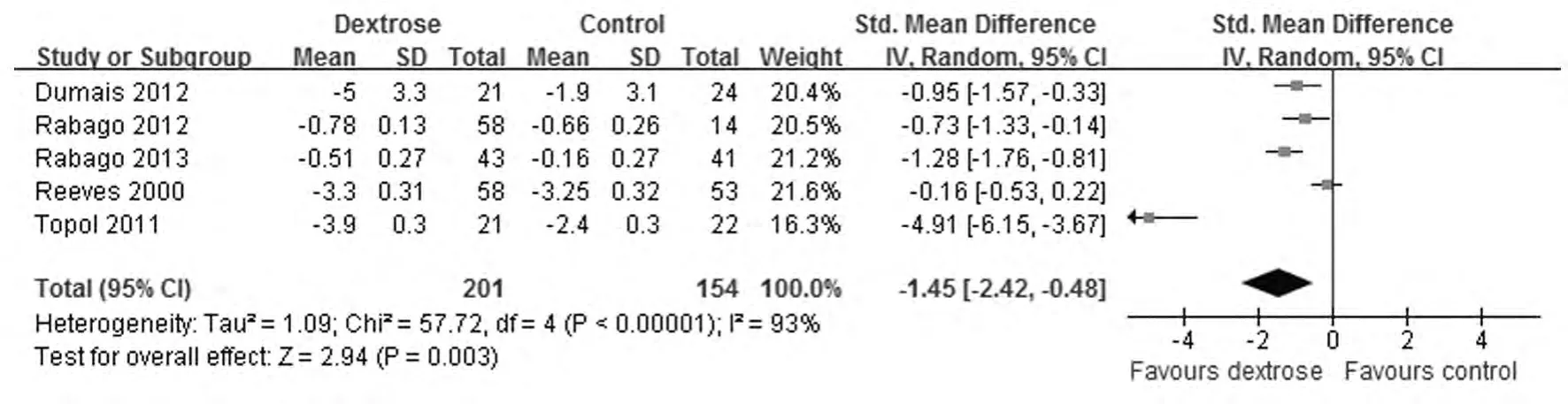
图1 高渗糖注射治疗对KOA疼痛影响短期效果的森林图Fig.1 Forest plot of short-term effect of dextrose prolotherapy on pain of KOA
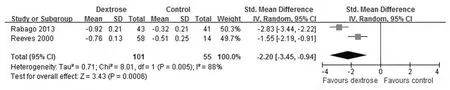
图2 高渗糖注射治疗对KOA疼痛影响长期效果的森林图Fig.2 Forest plot of long-term effect of dextrose prolotherapy on pain of KOA
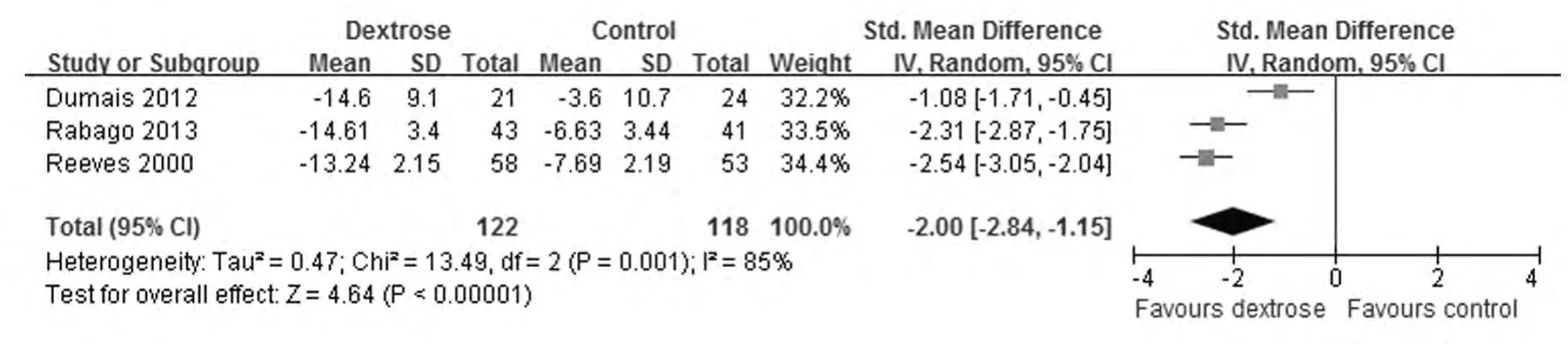
图3 高渗糖注射治疗对KOA活动能力影响的森林图Fig.3 Forest plot of effect of dextrose prolotherapy on physical function of KOA

图4 高渗糖注射治疗对KOA关节僵硬影响的森林图Fig.4 Forest plot of effect of dextrose prolotherapy on stiffness of KOA
图5 高渗糖注射治疗对KOA疼痛疗效的漏斗图Fig.5 Funnel plot of effect of dextrose prolotherapy on pain of KOA
3 讨 论
3.1 纳入研究质量 本系统评价共纳入5篇文献,主要存在以下问题:①有2篇文献未提及随机,降低了系统评价的证据强度;②2篇文献未提及是否采用盲法,因此可能存在选择性偏倚、实施偏倚和测量性偏倚;③各研究采用不同量表对效应进行量化;④4篇文献对基线情况进行了描述,1篇未描述。基线指标存在组间差异,可能造成选择性偏倚。总之,本研究纳入研究的总体质量一般,因此导致结果的论证强度有限。
3.2 有效性与安全性分析 本研究结果表明:高渗糖注射可有效缓解KOA引起的疼痛、提高膝关节活动能力。在既往研究中,Ross等[14]对有手术指证的KOA患者采用高渗糖注射治疗,患者VAS疼痛评分由治疗前的6.8下降至3.0。研究中90%的患者表示膝关节疼痛改善超过50%。Reeves等[11]研究表明:使用该疗法使患者VAS评分较治疗前下降1.69。Rabago等[14]发现:治疗后WOMAC疼痛缓解评分为7.1,关节活动能力平均提高8.2。上述3个研究由于不符合纳入标准未纳入Meta分析,但结果与本研究结论一致。然而,既往有研究[12]发现:作为安慰剂应用的无菌水注射可以改善KOA的疼痛达到28%,活动功能提高8度。因此,有学者[16]提出:在以注射方法为基础的KOA治疗中,针头创伤及注射液对局部组织的容积扩展是促进局部组织修复的重要因素。本研究结果显示:在疼痛的改善及活动功能提高上高渗糖组均明显高于无菌水注射组,提示注射治疗KOA主要治疗效果仍源于高渗糖的药效。目前,高渗糖治疗KOA的机制尚不清楚。既往对高渗糖治疗KOA的动物研究[17]发现:将高渗糖注射入结缔组织,6~24h内局部CD43+、ED1+白细胞及ED2+巨噬细胞升高,注射局部呈现胶原束增厚、细胞增生。组织内炎症修复、韧带及肌腱横截面积增粗等病理表现[18]。据此认为,高渗糖注射可增加膝关节周围韧带厚度,提高韧带及肌腱强度,控制由于韧带松驰引发的KOA的进展从而缓解疼痛并改善膝关节的运动功能[19]。
KOA造成关节僵硬的原因包括关节内的黏连,关节外的肌肉与骨骼的黏连和肌肉的挛缩。而高渗糖对KOA的治疗作用主要通过减轻局部水肿,促进局部纤维愈合。近来有研究[14-15]发现:高渗糖注射后与治疗前相比可显著改善膝关节僵硬。本研究发现:与对照组比较,高渗糖注射疗法对KOA僵硬有改善的趋势,但统计学差异不显著,可能由于目前关于高渗糖与KOA僵硬改善的相关高质量研究有限。因此,高渗糖注射疗法对KOA僵硬改善的效果及其机制尚需大量临床研究证实。
另外,纳入的所有研究均对高渗糖治疗KOA的不良反应进行了观察,未发现与治疗相关的严重不良反应及并发症,提示高渗糖注射治疗安全性好 。既往 的 多 个 临 床 研 究[8-10,12,19-22]结 果 也 支 持 高渗糖注射治疗KOA是安全的。此外,研究表明:患者对高渗糖注射疗法的满意度较高。在2项52周随访临床研究[8,20]中,分别有91%和83%的治疗对象自觉效果满意并愿意推荐给其他KOA患者。
3.3 异质性处理和偏倚分析 影响Meta分析结果的主要因素还包括纳入研究间的差异程度。本组纳入的4项指标均I2>50%,表明研究存在中、高度异质性。研究间的异质性主要来自方法学差异,如研究设计的质量不同、病例选择的差异、应用量表差异、操作者的操作差异以及不同医师对结果的判定差异。因此,采用随机效应模型以提高汇总结果的可信度。本文作者试图按高渗糖不同注射浓度进行亚组分析,但由于纳入的文献过少,无可比性,故进行总体分析,得出其总的SMD值。漏斗图及Begger’s检验结果提示存在一定的发表偏倚,这可能与阴性研究结果不易发表等有关。偏倚一定程度上影响了本研究的可信度,但本研究纳入的文献结果是在严格控制相关偏倚后获得的,与单项研究相比,具有较高的可信度,因此有较好的临床价值。
3.4 研究局限性 本研究虽然尽可能地对高渗糖注射治疗KOA的疗效进行了分析,但不可否认存在一定的局限性:①纳入研究文献数目有限,虽然高渗糖作为补偿替代疗法治疗KOA开展20余年来,但相关临床研究报道数量有限,国内尚无报道。另外本研究只检索了英文及中文文献,检索数据库有限,有可能尚未将相关文献全部纳入,因此必然存在选择偏倚;②由于既往研究设计原因,本研究评价的指标有限,仅评价了治疗后膝关节疼痛的缓解、活动功能及僵硬的改善、不良反应发生等,而膝关节运动声音、错动感、治疗前后X线、超声评价软骨厚度、韧带横截面积等指标则未纳入研究,这些指标的加入可能对研究结论产生影响;③纳入注射用高渗糖浓度有4种,由于纳入研究有限,本研究未细分亚组,可能产生偏倚。
Reeves首次报道的高渗糖膝关节注射治疗KOA的临床研究距今已有10余年,但在国内尚未见相关研究报道。本次Meta分析表明:高渗糖膝关节注射可明显改善KOA患者膝关节疼痛症状,提高患者膝关节活动能力。但由于临床研究的样本量不足,对KOA关节僵硬改善的效果尚未肯定。因此,高渗糖膝关节注射有可能成为治疗KOA一个有效的方法,但目前尚需更多高质量的研究提供更加可靠的系统评价证据指导临床。
[1]Samson DJ,Grant MD,Ratko TA,et al.Treatment of primary and secondary osteoarthritis of the knee [J].Evid Rep Technol Assess(Full Rep),2007 (157):1-157.
[2]Felson DT.The sources of pain in knee osteoarthritis[J].Curr Opin Rheumatol,2005,17 (5):624-628.
[3]DeChellis DM,Cortazzo MH.Regenerative medicine in the field of pain medicine:Prolotherapy,platelet-rich plasma therapy,and stem cell therapy-Theory and evidence[J].Interdiscip Manage Pain,2011,15 (2):74-80.
[4]Hooper RA,Frizzell JB,Faris P.Case series on chronic whiplash related neck pain treated with intraarticular zygapophysial joint regeneration injection therapy [J].Pain Physician,2007,10 (2):313-318.
[5]Miller MR,Mathews RS,Reeves KD.Treatment of painful advanced internal lumbar disc derangement with intradiscal injection of hypertonic dextrose[J].Pain Physician,2006,9 (2):115-121.
[6]Kim WM,Lee HG,Jeong CW,et al.A randomized controlled trial of intra-articular prolotherapy versus steroid injection for sacroiliac joint pain [J].J Altern Complement Med,2010,16 (12):1285-1290.
[7]Reeves KD, Hassanein K. Randomized, prospective,placebo-controlled double-blind study of dextrose prolotherapy for osteoarthritic thumb and finger (DIP,PIP,and trapeziometacarpal)joints:evidence of clinical efficacy [J].J Altern Complement Med,2000,6 (4):311-320.
[8]Rabago D,Zgierska A,Fortney L,et al. Hypertonic dextrose injections (prolotherapy)for knee osteoarthritis:results of a single-arm uncontrolled study with 1-year followup[J].J Altern Complement Med,2012,18 (4):408-414.
[9]Dumais R,Benoit C, Dumais A,et al. Effect of regenerative injection therapy on function and pain in patients with knee osteoarthritis:a randomized crossover study[J].Pain Med,2012,13 (8):990-999.
[10]Topol GA,Podesta LA,Reeves KD,et al.Hyperosmolar dextrose injection for recalcitrant Osgood-Schlatter disease[J].Pediatrics,2011,128 (5):e1121-1128.
[11]Reeves KD,Hassanein KM.Long-term effects of dextrose prolotherapy for anterior cruciate ligament laxity[J].Altern Ther Health Med,2003,9 (3):58-62.
[12]Reeves KD,Hassanein K.Randomized prospective double-blind placebo-controlled study of dextrose prolotherapy for knee osteoarthritis with or without ACL laxity [J].Altern Ther Health Med,2000,6 (2):68-74,77-80.
[13]Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary?[J].Control Clin Trials,1996,17 (1):1-12.
[14]Rabago D, Patterson JJ. Prolotherapy: An effective adjunctive therapy for knee osteoarthritis [J].J Am Osteopath Assoc,2013,113 (2):122-123.
[15]Slattengren AH, Christensen T, Prasad S, et al.Prolotherapy:A nontraditional approach to knee osteoarthritis[J].J Family Practice,2014,63 (4):206-208.
[16]Rabago D,Kijowski R, Woods M,et al.Association between disease-specific quality of life and magnetic resonance imaging outcomes in a clinical trial of prolotherapy for knee osteoarthritis [J]. Arch Physi Med Rehabilit,2013,94 (11):2075-2082.
[17]Yelland MJ,Glasziou PP,Bogduk N,et al.Prolotherapy injections,saline injections,and exercises for chronic lowback pain:a randomized trial[J].Spine,2004,29 (1):9-16;discussion 16.
[18]Jensen KT, Rabago DP, Best TM, et al. Early inflammatory response of knee ligaments to prolotherapy in a rat model[J].J Orthop Res,2008,26 (6):816-823.
[19]Jensen KT,Rabago DP,Best TM,et al.Response of knee ligaments to prolotherapy in a rat injury model[J].Am J Sports Med,2008,36 (7):1347-1357.
[20]Hackett GS. Referred pain from low back ligament disability[J].AMA Arch Surg,1956,73 (5):878-883.
[21]Rabago D,Patterson JJ, Mundt M,et al. Dextrose prolotherapy for knee osteoarthritis:a randomized controlled trial[J].Ann Fam Med,2013,11 (3):229-237.
[22]Rabago D,Slattengren A,Zgierska A.Prolotherapy in primary care practice[J].Prim Care,2010,37 (1):65-80.
[23]Hauser R,Hauser BN, Martin D.Prolotherapy as an alternative to surgery.A prospective pilot study of 34patients from a private medical practice [J].J Prolother,2010,2 (1):272-281.
