多发性骨髓瘤患者外周血清中microRNA-181a和microRNA-20a表达水平的检测及其临床意义
2015-11-28袁瑞丽王晓琴
彭 晶,袁瑞丽,王晓琴,吴 锋,郭 炫
(1.西安交通大学医学院,陕西 西安 710061;2.西安交通大学医学院第一附属医院检验科,陕西 西安 710061;3.西安交通大学医学院医学研究生教学实验中心,陕西 西安 710061)
microRNA (miRNA,miR-)是一类内源性短链非编码的单链RNA,长度约为22个氨基酸,作用机制是microRNA与其靶mRNA的3′UTR区互补,当部分配对时阻碍靶mRNA的翻译,当完全配对时可使靶mRNA降解,参与细胞增殖、凋亡、细胞分化、发育和逆境应答等多种生物学过程[1]。多发性骨髓瘤 (multiple myeloma,MM)是一种由浆细胞克隆性增生的血液系统恶性肿瘤。研究[2-4]发现:一些microRNA可能参与 MM疾病的发生过程,并在MM中发挥致癌和抑癌的作用。研 究[5]发 现:microRNA-181a 是 造 血 相 关microRNA,在急性粒细胞白血病不同亚型中microRNA-181a的表达水平不同。Chen等[6]研究发现:microRNA-181a在B淋巴细胞转化过程中起重要作用。另有研究[7]显示:microRNA-181a在MM患者外周血清中高表达。目前有关microRNA-181a与MM关系的研究较少,尤其有关MM预后等方面的研究少见报道。Lionetti等[8]发现:microRNA-20a在MM中高表达,但亦有研究[9]显示:microRNA-17~92簇在 MM 血浆中低表达。Xiao等[10]报道:microRNA-17~92簇可促进淋巴细胞增殖。microRNA-20a作为 microRNA-17~92簇中的一员,在MM中发挥致癌还是抑癌作用,尚有待于进一步研究。本研究探讨microRNA-181a和 microRNA-20a在 MM 患者血清中的表达及其临床意义,并初步探讨其与MM发病的关系。
1 资料与方法
1.1 临床资料 所有病例均为2013年1月—2014年5月于西安交通大学第一附属医院血液科住院的患者,正常对照者为西安交通大学第一附属医院查体中心同期健康体检者。将病例组分为MM组和其他血液病组。所有MM患者均符合《血液病诊断和疗效标准》中MM诊断标准且均经临床医师确诊,并排除心、肺和肝脏等其他器官衰竭且病情稳定者。MM组患者32例,平均年龄(62±2)岁,其中男性21例,女性11例;其中初诊14例,复发/难治18例。其他血液病组选择无MM病史的血液科其他恶性肿瘤患者12例 (均符合 《血液病诊断和疗效标准》),平均年龄 (57±4)岁,其中男性8例,女性4例;非霍奇金淋巴瘤4例,急性非淋巴细胞白血病3例,急性淋巴细胞白血病2例,慢性粒细胞白血病2例,慢性淋巴细胞白血病1例。正常对照组选择与病例组年龄、性别相配匹并经过常规体检合格者20人,平均年龄 (58±3)岁,其中男性14人,女性6人。
1.2 主要试剂和仪器 BLOODmisi全血 (液体样本)microRNA快速提取试剂盒、microRNA firststrand cDNA synthesis Kit和 microRNA Real-Time PCR Assay Kit(北京艾德莱生物科技有限公司),引物 (北京奥科鼎盛生物科技有限公司),白蛋白 (ALB)、乳酸脱氢酶 (LDH) (日本和光纯药工业株式会社),血清游离轻链 (FLC)(德国西门子公司),血清 M 蛋白 (法国西比亚公司),β2微球蛋白 (β2-MG) (宽范围) (潍坊三维生物工程集团有限公司)。Bio-CFX96定量PCR仪 (美国Bio-Rad公司),LABOSPECT008全自动生化分析仪 (日本日立公司),BNⅡSystem全自动蛋白分析仪 (德国西门子公司),Sebia-2毛细管电泳分析仪 (法国西比亚公司),FM-2000γ免疫计数器 (西安凯普机电有限责任公司)。
1.3 血清的分离与保存 收集MM组、其他血液病组和正常对照组研究对象的新鲜血清于无菌无酶的EP管中,4℃离心机,12000×g离心5min。吸上清于新的无菌无酶EP管中 (去除红细胞残骸)。所有标本分2份,一份用于PCR检测,另一份用于生化检测,-80℃保存。
1.4 microRNA的提取和microRNA-181a 和microRNA-20a表达检测 按照BLOODmisi全血(液体样本)microRNA快速提取试剂盒说明书提取血清 microRNA。按照 microRNA first-strand cDNA Synthesis Kit试剂盒说明书 [加poly(A)尾法]进行反转录。以上述合成的cDNA为模板,U6为内参,按照microRNA Real-time PCR Assay Kit试剂说明书在Bio-CXF定量PCR仪上进行扩增。microRNA-181a的 上游引物为 5′-AACATTCAACGCTGTCGGTGAGT-3′, microRNA-20a的上游引物为5′-GCGCTAAAGTGCTTATAGTGCAGGTAG-3′,microRNA-181a/20a 的下游共用引物由microRNA Real-Time PCR Assay Kit试剂盒提供。U6-F为 5′-CTCGCTTCGGCAGCACA-3′, U6-R 为 5′-AACGCTTCACGAATTTGCGT-3′。设定反应条件如下:94℃预变性3min;94℃、20s,60℃、40s,45个循环。然后进行溶解曲线扩增。实验结束后进行溶解曲线分析,扩增产物经2%琼脂糖凝胶电泳检测,鉴定产物的特异性。采用2-△CT计算microRNA-181a 和microRNA-20a的相对表达水平,U6作为内对照,△CT=目的基因的CT-内参基因的CT。2-△CT的值越高,表明相对表达水平越高。
1.5 血清肿瘤负荷指标及M蛋白电泳 采用1.2中试剂及仪器测定血清肿瘤负荷指标:ALB水平、LDH活性、FLC及血清β2-MG水平,并测定 M蛋白百分比。所有检测均在室内质控在控下进行,数据可靠。
1.6 统计学分析 采用SPSS 17.0统计软件进行统计学分析。血清ALB水平、LDH活性、FLC及β2-MG水平符合正态性分布,结果以表示。M蛋白百分比、microRNA-181a 和microRNA-20a表达水平为非正态分布资料,以中位数和四分位数间距[M (P25-P75)]表示。microRNA-181a和 microRNA-20a表达水平组间比较采用Kruskal-Wallis或 Wilcoxon秩和检验,microRNA-181a和 microRNA-20a表达水平与血清肿瘤负荷指标及M蛋白百分比变量间的关系分析采用Spearman线性相关分析。
2 结 果
2.1 microRNA-181a和 microRNA-20a扩增产物的溶解曲线及琼脂糖凝胶电泳 本实验构建的实时荧光定量检测microRNA-181a和 mirRNA-20a的方法特异性较好,溶解曲线分析未发现非特异性峰。扩增产物经琼脂糖凝胶电泳,只有1个目的条带。见图1和2。
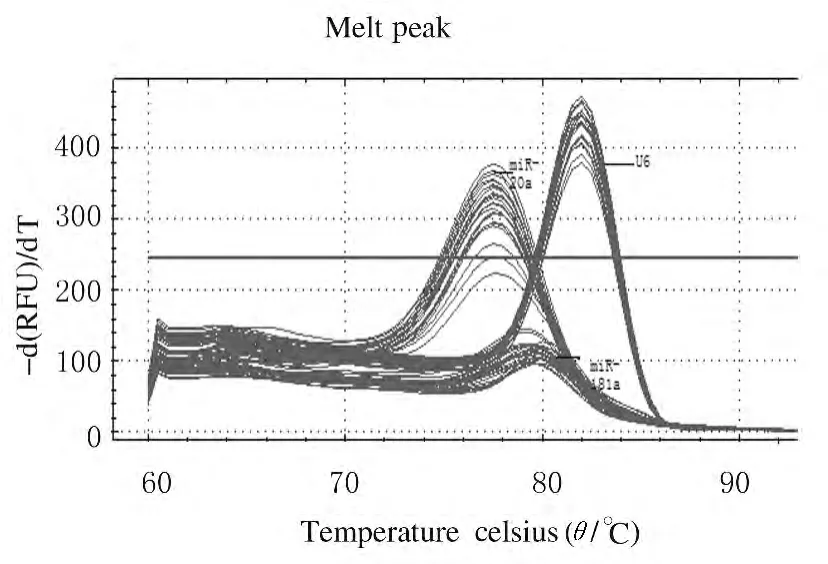
图1 microRNA-181a和microRNA-20a及U6产物的溶解曲线Fig.1 Dissolution curves of microRNA-181a,microRNA-20aand U6products
2.2 microRNA-181a和 microRNA-20a在 MM 患者血清中的表达水平 MM组、其他血液病组和正常对照组研究对象血清中 microRNA-181a和microRNA-20a表达水平比较差异有统计学意义(H=15.218,9.891;P=0.000,0.007)。与正常对照组比较,MM组患者血清中microRNA-181a (Z=-2.702,P=0.005)和 microRNA-20a(Z=-1.979,P=0.048)表达水平比较差异有统计学意义。与其他血液病组比较,MM组患者血清中 microRNA-181a (Z=-3.163,P=0.001)和microRNA-20a (Z=-2.722,P=0.005)表达水平比较差异有统计学意义。与正常对照组比较,其他血液病组患者血清中 microRNA-181a(Z=-1.735,P =0.093) 和 microRNA-20a (Z =-1.302,P=0.220)表达水平比较差异无统计学意义。见表1。

图2 microRNA-181a和microRNA-20a及U6产物的电泳图Fig.2 Electrophoregram of microRNA-181a,microRNA-20aand U6products

表1 各组研究对象血清中microRNA-181a和microRNA-20a表达水平Tab.1 Expression levels of serum microRNA-181aand microRNA-20aof subjects in various groups [M(P25-P75)]
2.3 microRNA-181a和 microRNA-20a表达水平与M蛋白百分比的相关性 采用Spearman线性相关分析,14例初诊患者的microRNA-181a和microRNA-20a表达水平与 M蛋白百分比均呈正相关关系。见表2。
2.4 血清中 microRNA-181a和 microRNA-20a表达水平与血清肿瘤负荷指标相关性 14例初诊患者的MM相关血清肿瘤负荷指标结果:FLC为(11.55±2.69)mg·L-1;ALB水平为 (30.68±1.75) g · L-1;LDH活性为(157.43 ±11.66)U·L-1;β2-MG水平为(4377.38±599.19)mg·L-1。将14例初诊患者 microRNA-181a和microRNA-20a表达水平与血清肿瘤负荷指标进行Spearman相关性分析,microRNA-181a与FLC和β2-MG呈正相关关系(r=0.780,0.552;P=0.001,0.041)。见表3。

表2 血清中microRNA-181a和microRNA-20a表达水平与M蛋白百分比相关性分析Tab.2 Correlation analysis on expression levels of serum microRNA-181a,microRNA-20aand M protein percentages
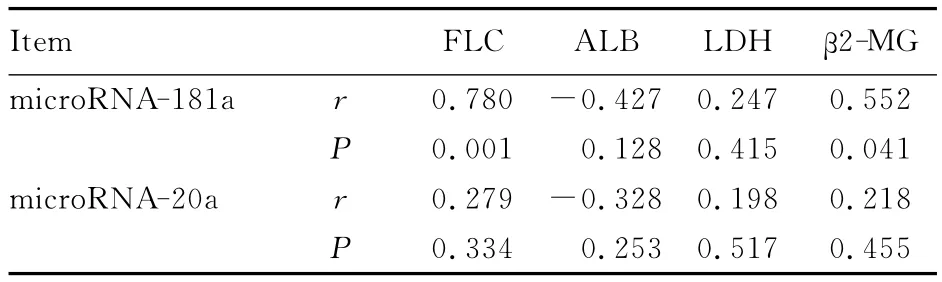
表3 血清中microRNA-181a和microRNA-20a表达水平与血清肿瘤负荷指标相关性分析Tab.3 Correlation analysis on expression levels of serum microRNA-181a,microRNA-20aand tumor loaded indexes
3 讨 论
研究[11]证实:microRNA参与了细胞生长发育过程中的多个环节,尤其是在肿瘤细胞的增殖、凋亡中起一定的调控作用。microRNA的调控作用在肝癌、肺癌、肠癌、胰腺癌和白血病等[12-16]多种恶性肿瘤中得到了证实。在MM的研究[17]中同样发 现 有 microRNA 的 参 与。 研 究[2]发 现:microRNA-21在 MM 中可通过靶基因 PTEN、Rho-B及BTG2来发挥其致癌基因作用;在研究黄连素对MM的治疗中发现:黄连素可降低microRNA-21表达水平,microRNA-21可使得靶基因IL-6/STAT3发生改变,并导致靶基因PDCD4表达上调,而后者又引发p53信号通路,最终使得肿瘤细胞发生凋亡[18]。
β2-MG主要由淋巴细胞生成,肿瘤细胞合成β2-MG的能力很强,β2-MG能反映细胞增殖、肿块大小以及肾功能损伤情况。LDH特异性低,但其可用于观察是否存在组织、器官损伤。ALB可间接地反映血清白细胞介素6(IL-6)的水平、肝功能和营养状况。FLC是免疫球蛋白的轻链,分为κ和λ2种形式,是近年来作为研究肿瘤疾病的新指标之一。β2-MG、LDH、ALB和FLC作为MM肿瘤负荷指标,可反映MM疾病的疗效及预后等。
本研究中 microRNA-181a在正常对照组、MM组和其他血液病组的表达水平分别为0.004、0.0452和 0.000。MM 患者血清中 microRNA-181a表达水平高于正常对照组,这与已往研究[7]结果一致。另外,MM 患者血清中 microRNA-181a表达水平与其他血液病组比较差异也有统计学意义,而其他血液病组患者microRNA-181a表达水平与正常对照组比较差异无统计学意义。由于临床指标 (ALB、LDH、FLC、β2-MG、M蛋白)在治疗后改变情况不一,本研究结果显示:将MM组患者血清中microRNA-181a/20a表达水平与临床指标进行相关性分析时相关性不及初诊病例,初诊病例用于临床指标的相关性研究对象更佳。本研究结果显示:microRNA-181a与M蛋白百分比呈正相关关系,血清M蛋白百分比现已是确诊 MM疾病的特异性指标之一。microRNA-181a与肿瘤负荷指标β2-MG和FLC呈正相关关系,提示microRNA-181a参与了 MM发病过程,对MM的诊断有一定的作用,且其水平的高低与肿瘤负荷有关,对疾病的预后有良好的预测效果。
microRNA-20a在正常对照组、MM组和其他血液病组的表达水平分别为1.159、5.879和0.072。与正常对照组和其他血液病组比较,MM组患者血清中microRNA-20a表达水平差异均有统计学意义。其他血液病组与正常对照组比较差异无统计学意义。此外,microRNA-20a与 M蛋白百分比相关性表现较 microRNA-181a更强,microRNA-20a和 microRNA-181a与 M 蛋白百分比相关系数 (r)分别为0.739和0.574,且r越接近1表明相关性越好,表明microRNA-20a对于MM的诊断更有价值。
本研究曾将MM组患者按D-S标准进行分期后,发现 microRNA-181a和 microRNA-20a表达水平在分期间比较差异无统计学意义。考虑研究对象过少的缘故,本文作者在以后的研究中将不断增加样本数,使所研究的对象更有代表性,研究结果更有说服力。
目前MM临床上表现为易复发、难治愈,这与缺乏良好的指标有关。本研究结果表明:microRNA-181a和 microRNA-20a均参与 MM 的发病过程,可作为 MM 的诊断标志物;microRNA-20a对 MM 诊断效果优于 microRNA-181a;microRNA-181a表达水平升高表明患者的预后不良。将二者作为MM的检测指标有助于对MM的诊断及预后判断。
[1]Turner ML,Schnorfeil FM,Brocker T.MicroRNAs regulate dendritic cell differentiation and function [J].J Immunol,2011,187(8):3911-3917.
[2]Leone E, Morelli E, Tassone P, et al. Targeting microRNA-21inhibits in vitro and in vivo multiple myeloma cell growth [J].Clin Cancer Res,2013,19 (8):2096-2106.
[3]Pichiorri F,Suh SS,Rocci A,et al.Downregulation of p53-inducible microRNAs 192,194and 215impairs the p53/MDM2autoregulatory loop in multiple myeloma development[J].Cancer Cell,2010,18 (4):367-381.
[4]Zhang W,Wang YE,Zhang Y,et al.Global epigenetic regulation of microRNAs in multiple myeloma [J].PLoS One,2014,9 (10):e110973.
[5]Pons A,Nomdedeu B,Navarro A,et al.Hematopoiesisrelated microRNA expression in myelodysplastic syndromes[J].Leuk Lymphoma,2009,50 (11):1854-1859.
[6]Chen CZ,Li L,Lodish HF,et al.MicroRNAs modulate hematopoietic lineage differentiation [J].Science,2004,303 (5653):83-86.
[7]Yyusnita Y,Norsiah MD,Zakiah I,et al. MicroRNA(miRNA)expression profiling of peripheral blood samples in multiple myeloma patients using microarray [J].Malays J Pathol,2012,34 (2):133-143.
[8]Lionetti M,Agnelli L,Mosca L,et al.Integrative highresolution microarray analysis of human myeloma cell lines reveals deregulated microRNA expression associated with allelic imbalances and gene expression profiles [J].Genes Chromosomes Cancer,2009,48 (6):521-531.
[9]Yoshizawa S, Ohyashiki JH, Ohyashiki M, et al.Downregulated plasma miR-92alevels have clinical impact on multiple myeloma and related disorders [J].Blood Cancer J,2012,2 (1):e53.
[10]Xiao C, Srinivasan L, Calado DP, et al.Lymphoproliferative disease and autoimmunity in mice with increased microRNA17-92expression in lymphocytes [J].Nature Immunol,2008,9 (4):405-414.
[11]Lee SK,Calin GA.Non-coding RNAs and cancer:new paradigms in oncology [J].Discov Med,2011,11 (58):245-254.
[12]Yang X,Liang L,Zhang XF,et al. MicroRNA-26a suppresses tumor growth and metastasis of human hepatocellular carcinoma by targeting interleukin-6-Stat3 pathway [J].Hepatology,2013,58 (1):158-170.
[13]Ahmad A,Maitah MY,Ginnebaugh KR,et al.Inhibition of Hedgehog signaling sensitizes NSCLC cells to standard therapies through modulation of EMT-regulating microRNAs [J].J Hematol Oncol,2013,6 (1):77-86.
[14]Nishida N,Nagahara M,Sato T,et al.Microarray analysis of colorectal cancer stromal tissue reveals upregulation of two oncogenic microRNA clusters [J].Clin Cancer Res,2012,18 (11):3054-3070.
[15]Song SD,Zhou J,Zhou J,et al.MicroRNA-375targets the3-phosphoinositide-dependent protein kinase-1gene in pancreatic carcinoma [J].Oncol Lett,2013,6 (4):953-959.
[16]Cui B,Chen L,Zhang S,et al.MicroRNA-155influences B-cell receptor signaling and associates with aggressive disease in chronic lymphocytic leukemia [J]. Blood,2014,124 (4):546-554.
[17]Qu X,Zhao M,Wu S,et al.Circulating microRNA 483-5p as a novel biomarker for diagnosis survival prediction in multiple myeloma [J].Med Oncol,2014,31 (10):e219.
[18]Luo X,Gu J,Zhu R,et al.Integrative analysis of differential miRNA and functional study of microRNA21by seed-targeting inhibition in multiple myeloma cells in response to berberine [J].BMC Syst Biol,2014,8 (1):82-91.
