脂联素及其受体2在肝细胞癌组织中的表达和临床意义
2015-11-28陈祖兵杨丽华龚作炯
戴 锴 陈祖兵 杨丽华 龚作炯
1.武汉大学人民医院感染科,湖北武汉 430060;2.武汉大学人民医院肝胆外科,湖北武汉 430060
脂联素及其受体2在肝细胞癌组织中的表达和临床意义
戴 锴1陈祖兵2杨丽华1龚作炯1
1.武汉大学人民医院感染科,湖北武汉 430060;2.武汉大学人民医院肝胆外科,湖北武汉 430060
目的探讨脂联素及其受体2在人肝细胞癌组织和癌旁组织中的表达及其与临床病理特征之间的关系。方法选取武汉大学人民医院2012年7月~2014年7月手术切除的48例肝细胞癌患者和48例健康体检对照者作为研究对象,运用放射免疫法检测肝细胞癌患者和健康对照者的血清脂联素水平,采用免疫组织化学法检测脂联素及其受体2在人肝细胞癌组织和癌旁组织的表达,并统计分析肝癌组织中脂联素及其受体2的表达高低与临床病理特征之间的关系。 结果 肝细胞癌患者的外周血清中脂联素水平为(12.25±5.23)μg/mL,低于健康对照者的(27.36±8.26)μg/mL,差异有高度统计学意义(P<0.01)。脂联素在肝癌组织和癌旁组织中的阳性率分别为41.67%和81.25%,脂联素受体2在肝癌组织和癌旁组织中的阳性率分别为31.25%和77.08%,差异有高度统计学意义(P<0.01)。进一步的分析发现,脂联素和脂联素受体2的阳性率与肝细胞癌患者的年龄、性别、HBsAg、抗-HCVAb、是否合并有肝硬化、肿瘤大小、组织学分级和肿瘤分期均没有明显相关性,差异无统计学意义(P>0.05),但不同淋巴结转移情况和血管侵犯的肝癌组织中的脂联素和脂联素受体2的阳性率,差异有统计学意义(P<0.05)。结论脂联素及其受体2的表达下降可能与人肝细胞癌的发生发展密切相关。
肝细胞癌;脂联素;脂联素受体;免疫组织化学
最新的研究表明,肥胖是许多肿瘤包括肝细胞癌发生发展的独立危险因素[1-3]。脂肪因子脂联素作为联系肥胖与肥胖相关肿瘤的一个中间因素近年来已引起国内外许多研究者的关注。脂肪组织的炎症变化可以使脂肪因子的产生发生失衡:具有抗炎作用的脂肪因子(如脂联素)产生减少,而具有促炎性反应的脂肪因子(如瘦素)产生增多,这种失衡可能对肿瘤的发生发展起着重要的影响。笔者前期研究和国外的同类研究都已经证实,瘦素可以促进人肝癌细胞增殖生长[4-5]。有研究发现,脂联素可以抑制乳腺癌细胞和结肠癌细胞的增殖和转移[6-7]。但对于脂联素及其受体和原发性肝细胞癌之间关系的研究还不是很多。为了研究脂联素与肝细胞癌的相关性,本研究中首先检测了肝细胞癌患者和健康对照者的血清脂联素水平,接着通过免疫组织化学的方法检测了肝细胞癌组织和癌旁组织中的脂联素及其受体2的表达情况,并进一步分析其表达与临床病理特征之间的关系。
1 资料与方法
1.1 一般资料
48例标本取自2012年7月~2014年7月于武汉大学人民医院(以下简称“我院”)行手术切除的肝细胞癌患者,所有患者术前均没有进行过放化疗等抗肿瘤治疗,有完整的病历资料,术中同时切取癌组织和距离癌组织5 cm以上的癌旁组织,制成病理切片,经过病理医师阅片后诊断为肝细胞癌。标本经过10%甲醛固定后石蜡包埋,制备常规的石蜡切片,同时行免疫组化染色和HE染色,采用美国癌症联合委员会和国际抗癌联盟的恶性肿瘤TNM分期标准对所有病理标本进行分期。肝细胞癌患者入院后抽空腹静脉血3mL,分离血清待测,同时留取48名健康对照者的血液标本,均为我院体检中心经体检合格的健康人,无心、肝、肺、肾等重要脏器疾患,肝、肾功能、血糖、血脂试验、肝脏B超检查正常。
1.2 主要试剂
脂联素放射免疫法(RIA)检测试剂盒购于美国Linco公司;脂联素(Adiponectin)和脂联素受体2(AdipoR2)的单克隆抗体均购自英国Abcam公司;免疫组化试剂盒购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 血清脂联素水平检测 运用放射免疫法检测肝细胞癌患者和健康对照者的血清脂联素水平,具体操作按试剂盒说明书进行。
1.3.2 脂联素及其受体2在人肝细胞癌组织和癌旁组织中的表达 严格按照试剂盒说明书采用免疫组织化学法检测:将石蜡包埋组织5 μm厚度连续切片,常规脱蜡至水并修复抗原,3%去离子H2O2室温下孵育10 min以阻断内源性过氧化物酶,37℃下胃蛋白酶消化孵育30 min,加入一抗后4℃过夜,第2天依次加入生物素标记的羊抗鼠二抗和Streptavidin-Peraxidase,孵育后用DAB显色,苏木精复染,脱水透明后封片。阴性对照为磷酸盐缓冲液(PBS)替代一抗。
1.3.3 结果判定 脂联素蛋白表达阳性的细胞为细胞浆染成棕黄色颗粒,脂联素受体2蛋白表达阳性的细胞为细胞膜染成棕黄色颗粒,阴性者无棕黄色颗粒或与背景颜色一致。采用半定量积分法,每张切片随机选取10个高倍视野,每个视野计数100个细胞,根据细胞背景将癌细胞染色分为0~3级(0级阴性;1级弱阳性;2级阳性;3级强阳性),取其平均值为阳性表达率。0级和1级为低表达,2级和3级为高表达。
1.4 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 临床基本资料
48例肝细胞癌患者中,男38例,女10例;年龄35~65岁,平均(52.5±6.5)岁;HBsAg阳性者36例;抗-HCV抗体阳性者5例;伴有肝硬化者30例;伴血管侵犯者16例;有淋巴结转移者20例。
2.2 肝细胞癌和健康对照者脂联素水平比较
应用放射免疫测定法测量肝细胞癌患者和健康对照者外周血清中脂联素水平,分别为(12.25± 5.23)μg/mL和(27.36±8.26)μg/mL,前者较低(P<0.01)。
2.3 肝细胞癌组织和癌旁组织中脂联素和脂联素受体2的表达情况
通过免疫组织化学的方法分别观察脂联素和脂联素受体2在肝癌组织和癌旁组织中的表达情况(图1、2),其中,脂联素在肝癌组织和癌旁组织中的阳性率分别为41.67%和81.25%,脂联素受体2在肝癌组织和癌旁组织中的阳性率分别为31.25%和77.08%,脂联素和脂联素受体2在肝癌组织中的阳性率都低于癌旁组织,差异有高度统计学意义(P<0.01)。见表1、2。
2.4 肝细胞癌组织中脂联素和脂联素受体2的表达与临床相关参数之间的关系
按照肿瘤细胞的免疫组织染色将阴性和弱阳性(0级和1级)视为低表达,而阳性和强阳性(2级和3级)视为高表达。肝细胞癌组织中脂联素和脂联素受体2的表达高低与临床相关参数之间的关系分析显示,脂联素和脂联素受体2的阳性率与肝细胞癌患者的年龄、性别、HBsAg、抗-HCV Ab、是否合并有肝硬化、肿瘤大小、组织学分级和肿瘤分期均没有明显的相关性(P>0.05),但发生淋巴结转移和血管侵犯的肝癌组织中脂联素和脂联素受体2的阳性率与未发生淋巴结转移和血管侵犯的肝癌组织比较,差异有统计学意义(P<0.05)。见表3。
3 讨论
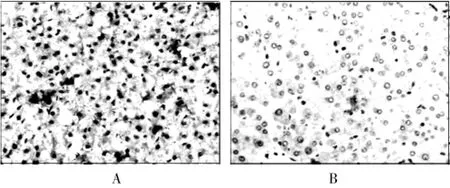
图1 脂联素在肝癌组织和癌旁组织中的表达(200×,SP)
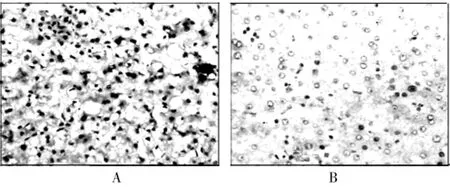
图2 脂联素受体2在肝癌组织和癌旁组织中的表达(200×,SP)

表1 脂联素在肝癌组织和癌旁组织中的表达(例)
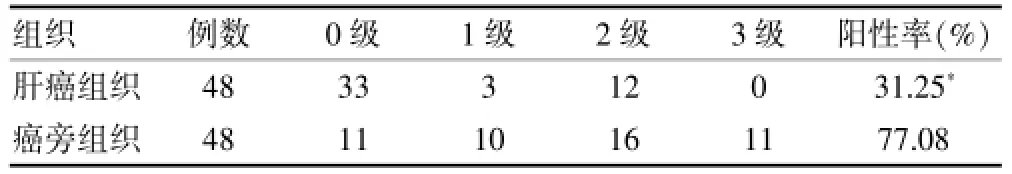
表2 脂联素受体2在肝癌组织和癌旁组织中的表达(例)
肝细胞癌是我国最常见的恶性肿瘤之一,但对其病因和发病机制仍未阐明清楚。最近的流行病学表明,肥胖及与其密切相关的非酒精性脂肪性肝病是肝细胞癌发生发展的独立危险因素,肥胖人群发生肝细胞癌的危险性是普通人群的1.5~4倍,但其中的确切机制还不是十分明确[8-9]。这可能是因为肥胖是一种长期的慢性炎性反应状态[10],而肿瘤的发生发展与炎症密切相关[11-13],其中,脂肪细胞分泌的脂肪因子可能在其中起着关键的作用。脂联素作为一种脂肪因子,在肥胖人群体内血清中的水平明显降低。在体内循环时,脂联素以全长蛋白和经蛋白酶水解成的C端球型结构域的形式存在。近年来发现,脂联素除了能够调节体内能量平衡和促进糖和脂肪代谢之外,还具有抗感染、增敏胰岛素、抗动脉粥样硬化和抗纤维化等功能,是一种具有广泛生物学效应的细胞因子[14],从而成为研究的热点。脂联素主要通过与其受体的结合介导而发挥其生物学作用,脂联素受体主要包括脂联素受体1和脂联素受体2[15]。脂联素受体1在体内各组织器官的表达存在差异,它们与脂联素全长蛋白和球型结构域的结合力也存在差异。脂联素受体1在人体内普遍表达,骨骼肌中的表达最高,相对于脂联素全长蛋白,其与脂联素的球型结构域的结合力更高;而脂联素受体2在肝细胞中的表达相对较高,其与脂联素全长蛋白和球型结构域的结合力相似,因此骨骼肌和肝脏是脂联素作用的主要靶器官[16]。
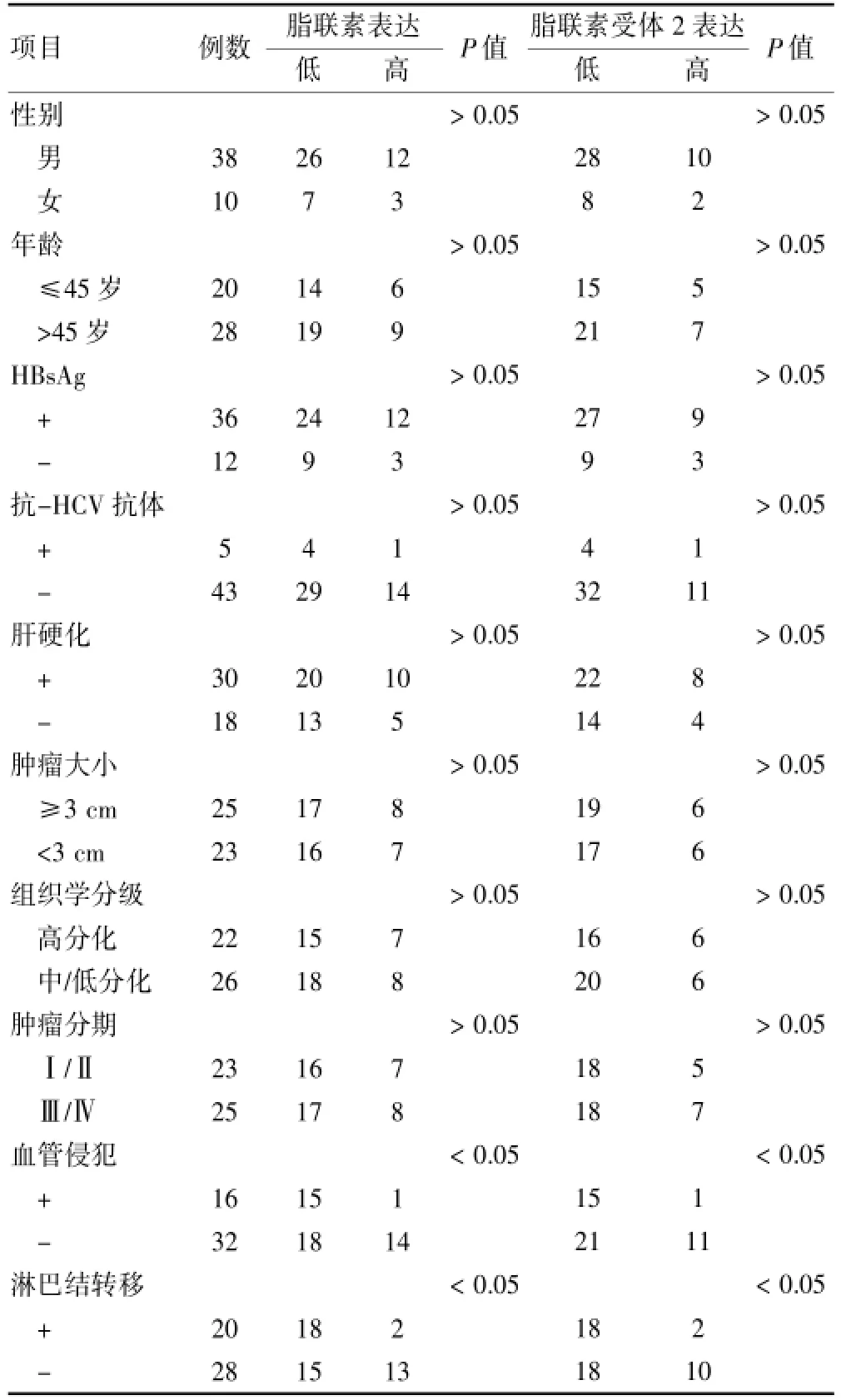
表3 肝癌组织中脂联素与脂联素受体2表达情况与临床病理参数之间的关系(例)
国外有研究认为,脂联素对多种肿瘤尤其是肥胖相关的肿瘤起保护作用[17]。近年来有研究发现,外周血中脂联素水平的降低与多种肿瘤的发病风险有关,如乳腺癌、结直肠癌、前列腺癌、甲状腺癌[7,18-20],但对于脂联素水平与肝细胞癌之间关系的报道不多。本研究发现,肝细胞癌患者的外周血清中脂联素水平为(12.25± 5.23)μg/mL,低于健康对照者的(27.36±8.26)μg/mL(P<0.01);通过免疫组化检测发现,肝细胞癌患者的肝癌组织和癌旁组织都表达有脂联素和脂联素受体2,它们在肝癌组织中的阳性表达率分别是41.67%和31.25%,而在癌旁组织中的阳性表达率分别是81.25%和77.08%,这表明脂联素和脂联素受体2在肝癌组织中存在着低表达,提示脂联素和脂联素受体2的低表达有可能成为检测肝细胞癌新的标志。
本研究还统计分析了脂联素和脂联素受体2的表达与临床相关参数之间的关系,结果显示,脂联素和脂联素受体2的阳性率与肝细胞癌患者的年龄、性别、HBsAg、抗-HCV Ab、是否合并有肝硬化、肿瘤大小、组织学分级和肿瘤分期均没有明显的相关性,这提示脂联素和脂联素受体2有可能影响了肝癌的早期发生发展。此外分析还发现,脂联素和脂联素受体2的表达高低与肝癌是否发生转移有关,发生了淋巴结转移和血管侵犯的肿瘤脂联素和脂联素受体2的表达率均低于未发生转移的肿瘤。目前许多肝癌患者手术切除后仍有很高的复发率和转移率,这是影响手术切除患者远期治疗效果的主要因素,一般认为发生了淋巴结转移和血管侵犯的肝癌更容易出现转移和复发,本实验的结果提示,脂联素和脂联素受体2有可能在抑制肿瘤的血管侵犯和浸润转移中发挥一定的作用。
总之,本研究提示外周血中脂联素水平的变化可能是肝细胞癌发病的一个重要危险因子,也可能作为一种预测指标用于恶性肝脏肿瘤的动态检测和预后判断,但其机制值得进一步研究,有可能与脂联素的“抗炎”作用有关,而炎症与肿瘤的关系密切;此外有报道称脂联素可以抑制相关肿瘤细胞的增殖并促进其凋亡[21-22],但是否对肝癌细胞有着类似的作用值得进一步研究。对其机制的进一步研究将有助于肝细胞癌的预防与早期诊断,同时对肝细胞癌的治疗提供新的研究思路。
[1]Calle EE,Rodriguez C,Walker-Thurmond K,et al.Overweight,obesity,andmortality from cancer in a prospectively studied cohort of U.S.adults[J].N Engl J Med,2003,348(17):1625-1638.
[2]Gallagher EJ,LeRoith D.Obesity and Diabetes:the increased risk of cancer and cancer-related mortality[J].Physiol Rev,2015,95(3):727-748.
[3]Starley BQ,Calcagno CJ,Harrison SA.Nonalcoholic fatty liver disease and hepatocellular carcinoma:a weighty connection[J].Hepatology,2010,51(5):1820-1832.
[4]戴锴,田德英.瘦素促进人肝癌细胞侵袭性生长的体外研究[J].肿瘤,2007,27(6):425-428.
[5]Ramani K,Yang H,Xia M,et al.Leptin's mitogenic effect in human liver cancer cells requires induction of both methionineadenosyltransferase2Aand2beta[J].Hepatology,2008,47(2):521-531.
[6]Sugiyama M,Takahashi H,Hosono K,et al.Adiponectin inhibits colorectal cancer cell growth through the AMPK/ mTOR pathway[J].Int J Oncol,2009,34(2):339-344.
[7]Guleelik MA,Colakoglu K,Dineer H,et al.Associations between adiponeotin and two different cancers:breast and colon[J].Asian Pac J Cancer Prev,2012,13(1):395-398.
[8]Baffy G,Brunt EM,Caldwell SH.Hepatocellular carcinoma in nonalcoholic fatty liver disease:an emerging menace[J]. J Hepatol,2012,56(6):1384-1391.
[9]Chitturi S,Wong VW,Farrell G,et al.Nonalcoholic fatty liver in Asia:firmly entrenched and rapidly gaining ground[J]. J Gastroenterol Hepatol,2011,26(Suppl 1):163-172.
[10]Greenberg AS,Obin MS.Obesity and the role of adipose tissue in inflammation and metabolism[J].Am J Clin Nutr,2006,83(2):461S–465S.
[11]Balkwill F,Coussens LM.Cancer:an inflammatory link[J]. Nature,2004,431(7007):405-406.
[12]Fox JG,Wang TC.Inflammation,atrophy,and gastric cancer[J].J Clin Invest,2007,117(1):60-69.
[13]Karin M,Greten FR.NF-kappaB:linking inflammation and immunity to cancer development and progression[J]. Nat Rev Immunol,2005,5(10):749-759.
[14]Chiarugi P,Fiaschi T.Adiponectin in health and diseases:from metabolic syndrome to tissue regeneration[J].Expert Opin Ther Targets,2010,14(2):193-206.
[15]Yamauchi T,Kamon J,Ito Y,et al.Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J]. Nature,2005,423(6941):762-769.
[16]Kadowaki T,Yamauchi T.Adiponectin receptor signaling:a new layer to the current model[J].Cell Metab,2011,13(2):123-124.
[17]Dalamaga M,Diakopoulos KN,Mantzoros CS.The role of adiponectin in cancer:a review of current evidence[J]. Endocr Rev,2012,33(4):547-594.
[18]Kaklamani V,Yi N,Zhang K,et al.Polymorphisms of ADIPOQ and ADIPOR1 and prostate cancer risk[J]. Metabolism,2011,60(9):1234-1243.
[19]Mitsiades N,Pazaitou-Panayiotou K,Aronis KN,et al.Circulatingadiponectinisinversely associatedwithrisk of thyroid cancer:in vivo and in vitro studies[J].J Clin Endocrinol Metab,2011,96(12):E2023-2038.
[20]Ollberding NJ,Kim Y,Shvetsov YB,et al.Prediagnostic leptin,adiponectin,C-reactive protein,and the risk of postmenopausal breast cancer[J].Cancer Prev Res(Phila),2013,6(3):188-195.
[21]Cong L,Gasser J,Zhao J,et al.Human adiponectin inhibits cell growth and induces apoptosis in human endometrial carcinoma cells,HEC-1-A and RL95 2[J].Endocr Relat Cancer,2007,14(3):713-720.
[22]Byeon JS,Jeong JY,Kim MJ,et al.Adiponectin and adiponectin receptor in relation to colorectal cancer progression[J].Int J Cancer,2010,127(12):2758-2767.
Expression of adiponectin and adiponectin receptor 2 in hepatocellular carcinoma tissue and its clinical significance
DAI Kai1CHEN Zubing2YANG Lihua1GONG Zuojiong1
1.Department of Infectious Diseases,Renmin Hospital of Wuhan University,Hubei Province,Wuhan 430060,China; 2.Department of Hepatobiliary Surgery,Renmin Hospital of Wuhan University,Hubei Province,Wuhan 430060,China
Objective To investigate the expression of adiponectin and adiponectin receptor 2(AdipoR2)in hepatocellular carcinoma (HCC)tissue and para-carcinoma tissue,and their correlation to clinicopathological features.Methods Forty-eight HCC patients undergoing partial hepatectomy and forty-eight healthy people in Renmin Hospital of Wuhan University from July 2012 to July 2014 were selected as research objects.Serum adiponectin level of HCC patients and normal controls was determined using RIA kit.The expression of adiponectin and AdipoR2 in cancerous and paracancerous tissues were detected by immunohistochemical method.The correlations of clinical pathologic parameters with the adiponectin and AdipoR2 expression in cancerous tissue were analyzed respectively.Results HCC patients had a significantly lower concentration of serum adiponectin than nomal controls[(12.25±5.23)vs(27.36±8.26)μg/mL,P<0.01].The expression rate of adiponectin and AdipoR2 in cancerous tissues were lower than those in the para-cancerous tissues obviously(41.67%vs 81.25%,31.25%vs 77.08%,P<0.01).There were no statistical differences of the expression of adiponectin and AdipoR2 in age,sexuality,HBsAg,anti-HCV Ab,liver cirrhosis,tumor size,histological differentiation degrees and stages of TNM,but there were statistical difference of the expression of adiponectin and AdipoR2 with vascular invasion and lymphatic metastasis(P<0.05).Conclusion The decrease of adiponectin and AdipoR2 expression may be closely relevant to the HCC progression.
Hepacellular carcinoma;Adiponectin;Adiponectin receptor 2;Immunohistochemistry
R735.8
A
1673-7210(2015)11(c)-0034-04
2015-07-13本文编辑:程 铭)
中国肝炎防治基金会天晴肝病研究基金(CFHPC20132133)。
戴锴(1978.1-),男,医学博士,主要从事肝脏疾病的基础和临床研究。
