益智仁提取物对糖尿病肾病模型小鼠的疗效及机制研究
2015-11-28房磊臣高新征刘一鸣谢毅强
刘 嫱 房磊臣 韦 祎 高新征 刘一鸣 谢毅强
1.海南医学院药理教研室,海南海口 571101;2.广东省深圳市武警医院生殖中心,广东深圳 518032
益智仁提取物对糖尿病肾病模型小鼠的疗效及机制研究
刘 嫱1房磊臣2韦 祎1高新征1刘一鸣1谢毅强1
1.海南医学院药理教研室,海南海口 571101;2.广东省深圳市武警医院生殖中心,广东深圳 518032
目的 探讨益智仁提取物对糖尿病肾病(DN)模型小鼠的疗效及可能机制。 方法 48只雄性昆明小鼠,分为正常对照组,DN模型组,阳性药物组,益智仁提取物高、中、低剂量组,每组各8只。给予小鼠1次大剂量腹腔注射链脲佐菌素(150 mg/kg),进行DN造模,成模后,正常对照组给予灌胃蒸馏水10 mL/(kg·d),阳性药物组给予厄贝沙坦10 mg/kg灌胃,益智仁提取物高、中、低剂量组给予益智仁提取物石油醚部位20、10、5 g/(kg·d)灌胃,连续4周。定期观察血糖、尿蛋白、肾功能[血尿素氮(BUN)、肌酐(Scr)],实验结束时,处死小鼠,测定相对肾重,肾组织做病理形态学检查,免疫组化检测水通道蛋白2(AQP2)。 结果 成模小鼠随着实验进行,表现出高血糖,并出现蛋白尿,肾功能受到损害,血肌酐明显上升,病理检查发现肾小球明显肥大,系膜区扩张,基膜增厚。药物干预4周后,与DN模型组比较,益智仁提取物各剂量组的24 h尿蛋白定量明显降低,差异有高度统计学意义(P<0.01);益智仁提取物各剂量组BUN、Scr水平也明显降低,差异有高度统计学意义(P<0.01)。HE染色结果显示益智仁提取物高剂量组的病理改变明显减轻。免疫组化结果显示正常对照组AQP2无阳性表达,DN模型组AQP2阳性表达,益智仁提取物高剂量组AQP2的阳性表达减弱。 结论益智仁提取物(石油醚部位)可以明显改善小鼠糖尿病肾病的损害,一定程度的保护肾功能,延缓肾功能减退。AQP2的表达下调可能是该物质对抗糖尿病肾病的作用机制。
益智仁提取物;糖尿病肾病;水通道蛋白2
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最主要的血管并发症之一,DN已成为终末期肾病的首位原因[1-2]。DN的发病因素诸多[3],对DN的早防早治已成为DM和肾病学者们重要的研究课题[4-5]。但因其发病机制的复杂,DN现有的治疗措施只能部分延缓DN的进程,无法从根本上阻断DN的进展[6]。目前使用的相关治疗药物主要是西药[7],而且主要是对症治疗,对于某些有并发症的患者,就形成了一定的局限性,不能有效解决DN的进展。
近年来文献表明,中医药对DN早期的防治可延缓其病变进展,并引起了国内外专家的广泛关注[8-9]。益智为姜科山姜属植物益智(Alpinia oχyphylla Miq)的干燥成熟果实,药用部位为种仁,临床上常用生品和盐炙品。益智仁在治疗多尿方面已经显示出确切的疗效。本研究通过实验动物造模,观察益智仁提取物对早期DN小鼠的各相关生化指标及病理检查的影响,探讨其对DN的防治作用,为进一步探讨其作用的分子机制提供一定的理论依据,现报道如下:
1 材料与方法
1.1 主要仪器
GS-15R低温离心机(Beckman公司)、-80℃低温冰箱(海尔)、悦准血糖仪Ⅰ型(上海鱼跃)、PL203电子分析天平(梅特勒-托利多仪器有限公司)、OLYMPUS自动生化分析仪(型号AU600,OLYMPUS)。
1.2 药品与试剂
益智仁购于海南省海口市国瑞堂医药公司,经海南医学院王勇研究员鉴定为真品。厄贝沙坦(安博维,赛诺菲杭州制药有限公司,批号:2A205);链脲佐菌素(STZ,Sigma公司-TRIZOL,Invitrogen);一抗为兔抗小鼠-AQP2(武汉Boster公司,BA0649);二抗为生物素化山羊抗兔IgG(武汉Boster);两步法抗兔免疫组化染色试剂盒 (北京中杉金桥生物技术有限公司,SA1022);
1.3 实验动物
昆明种雄性小鼠80只,SPF级,体重(22±2)g,长沙市天勤生物技术有限公司,合格证号:43006700 001036。适应性喂养1周,无不良反应即进入实验。
1.4 实验方法
1.4.1 益智仁提取
取益智仁100 g,粉碎,过一号筛,置2000 mL圆底烧瓶中,加乙醇600 mL回流提取两次,每次1 h,纱布滤过,合并两次滤液,60℃以下减压回收溶剂,浸膏加适量水混悬均匀,分散至100 mL,依次用石油醚(60~90℃)、三氯甲烷、乙酸乙酯、正丁醇萃取,分离各层,并分别减压回收溶剂,即得各部位。取石油醚部位作为试验用药,将其配制成含5%Tween-80的稳定的混悬液使用。并根据该部位的出膏率,制备成折合1 g生药/mL的药液备用。
1.4.2 造模
精密称取150 mg STZ粉剂,溶于15 mL柠檬酸缓冲液中(pH 4.8),配制成10 mg/mL的浓度。动物适应环境1周后,禁食12 h,模型组给予实验小鼠STZ(150 mg/kg)一次性大剂量腹腔注射,同时给予正常对照组腹腔注射等量无菌柠檬酸缓冲液[10]。给药后72 h小鼠尾尖取血,测血糖,血糖>16.17 mmol/L者确定为糖尿病诱导成功,此后每周定期监测血糖以及24 h尿蛋白,持续出现蛋白尿的小鼠视为DN成模。
1.4.3 分组及给药
成模后将造模小鼠随机分组:DN模型组、阳性药物组、益智仁提取物高剂量组、益智仁提取物中剂量组、益智仁提取物低剂量组。每组各8只小鼠。小鼠给药剂量按照人与动物体表面积法折算[2]。
正常对照组:给予小鼠蒸馏水10 mL/(kg·d);DN模型组:给予蒸馏水10 mL/(kg·d);阳性药物组:给予厄贝沙坦10 mg/kg(蒸馏水配制至10 mL);益智仁提取物高、中、低剂量组分别给予益智仁提取物(石油醚部位)20、10、5 g/(kg·d);以上各组给药方式均为灌胃,每日1次,期间不限制饮食、水,但不使用胰岛素及其他降血糖的药物,共4周。
1.4.4 观测指标
1.4.4.1 血糖 分别在给药前、2周末、4周末小鼠尾尖取血测定其血糖一次。用血糖仪及配套试纸进行测定,严格按照说明书进行。
1.4.4.2 尿蛋白测定 分别在给药前、2周末、4周末,用代谢笼收集当天24 h尿液,计算24 h尿量,测定24 h尿蛋白量。24 h尿蛋白量测定采用放免法,严格按说明书进行。
1.4.4.3 相对肾重测定 相对肾重(KW/BW)=肾重(mg)/体重(g)。先精密称取其体重。然后无菌操作取右肾,去掉被膜,生理盐水冲洗,滤纸吸干血迹后,称取右侧肾脏重量,然后按公式计算。
1.4.4.4 肾功能 药物干预后,于2、4周末取血样送至海南医学院附属医院检验科,通过OLYMPUS AU600全自动生化分析仪检测血清尿素氮(BUN)、肌酐(Scr)。
1.4.4.5 病理检查 小鼠处死后取右肾,沿矢状正中线切开,取其1/2小块固定、包埋,连续4 μm切片,进行HE染色,光镜下观察肾组织病理学变化。
1.4.4.6 免疫组化检测水通道蛋白2(AQP2) 采用PV9000二步法检测,切片常规脱蜡至水;枸橼酸钠缓冲液抗原热修复,3%H2O2室温灭活,PBS洗涤3次;滴加适当稀释(1∶100)的一抗(兔抗小鼠AQP2单克隆抗体),37℃,60 min;PBS洗3次;滴加适量反应增强剂,室温下20 min,PBS洗3次;滴加适量辣根酶标羊抗小鼠IgG聚合物,室温下20 min,PBS洗3次;DAB显色;苏木精轻度复染;脱水,透明,封片,显微镜观察,以细胞浆中呈现棕黄色颗粒为阳性。
1.5 统计学方法
用SPSS 13.0软件进行统计分析,正态分布计量资料以均数±标准差()表示,两组间比较采用t检验;重复测量的计量资料比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 空腹血糖
与正常对照组比较,其余各组小鼠血糖显著升高,差异有高度统计学意义(P<0.01)。阳性药物组及益智仁提取物各剂量组与DN模型组比较,差异无统计学意义(P>0.05)。随着时间延长,阳性药物组及益智仁提取物各剂量组血糖并无降低,差异无统计学意义(P>0.05)。见表1。
2.2 各组小鼠24 h尿蛋白情况
与正常对照组比较,DN模型组的24 h尿蛋白给药后显著升高,差异有统计学意义(P<0.01或P<0.05);与DN模型组比较,阳性药物组及益智仁提取物各剂量组24 h尿蛋白明显降低,差异有统计学意义(P<0.01或P<0.05)。见表2。
表1 各组小鼠血糖变化比较(mmol/L,)

表1 各组小鼠血糖变化比较(mmol/L,)
注:与正常对照组比较,*P<0.01
组别 动物只数 给药前 给药2周 给药4周正常对照组糖尿病肾病模型组阳性药物组益智仁提取物高剂量组益智仁提取物中剂量组益智仁提取物低剂量组888888 7.89±0.77 23.60±1.63*22.17±1.01*22.56±0.96*23.02±1.25*22.53±1.26*7.61±0.93 24.53±1.46*23.54±1.01*23.77±0.82*24.69±1.34*24.08±1.49*7.45±0.84 24.95±0.83*24.71±1.38*24.92±0.91*25.69±1.02*25.10±1.42*
表2 各组小鼠24 h尿蛋白比较(mg/24 h,)

表2 各组小鼠24 h尿蛋白比较(mg/24 h,)
注:与正常对照组比较,*P<0.01,**P<0.05;与糖尿病肾病模型组比较,#P<0.01,##P<0.05
组别 动物只数 给药前 给药2周 给药4周正常对照组糖尿病肾病模型组阳性药物组益智仁提取物高剂量组益智仁提取物中剂量组益智仁提取物低剂量组888888 0.29±0.06 0.54±0.06*0.37±0.07**0.43±0.06*0.44±0.05*0.46±0.07*0.28±0.05 1.71±0.13*1.33±0.08*#1.36±0.05*#1.65±0.17*#1.86±0.13*#0.23±0.02 7.29±1.41*1.74±0.17*#1.99±0.21*#2.50±0.33*#6.01±1.57*##
2.3 各组小鼠体重和相对肾重比较
与正常对照组比较,给药前各组小鼠体重差异无统计学意义(P>0.05)。随着时间增加,给药后4周,与正常对照组比较,DN模型组、阳性药物组小鼠体重减轻,差异有统计学意义(P<0.05);与DN模型组比较,阳性药物组及益智仁提取物各剂量组小鼠的体重增加(P<0.05),相对肾重明显降低(P<0.01,或P<0.05)。见表3。
表3 各组小鼠体重及相对肾重比较()
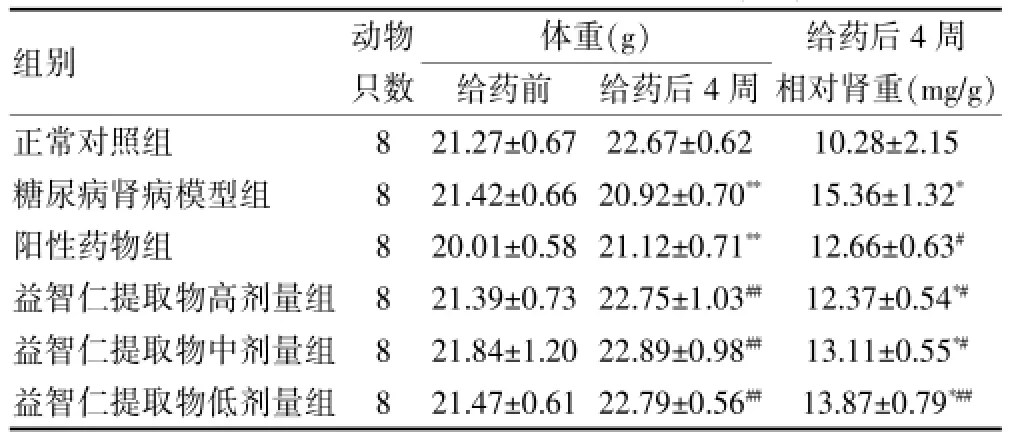
表3 各组小鼠体重及相对肾重比较()
注:与正常对照组比较,*P<0.01,**P<0.05;与糖尿病肾病模型组比较,#P<0.01,##P<0.05
组别 动物只数 给药前 给药后4周体重(g) 给药后4周相对肾重(mg/g)正常对照组糖尿病肾病模型组阳性药物组益智仁提取物高剂量组益智仁提取物中剂量组益智仁提取物低剂量组888888 21.27±0.67 21.42±0.66 20.01±0.58 21.39±0.73 21.84±1.20 21.47±0.61 22.67±0.62 20.92±0.70**21.12±0.71**22.75±1.03##22.89±0.98##22.79±0.56##10.28±2.15 15.36±1.32*12.66±0.63#12.37±0.54*#13.11±0.55*#13.87±0.79*##
2.4 各组小鼠血清Scr、BUN水平比较
与正常对照组比较,给药2周后各组小鼠的Scr明显升高(P<0.01),BUN升高较明显(P<0.01或P<0.05)。给药4周后,各组的Scr、BUN均明显升高(P<0.01);与DN模型组比较,阳性药物组及益智仁提取物各剂量组小鼠的Scr、BUN明显降低(P<0.01)。见表4。
表4 各组小鼠血清Scr、BUN水平()
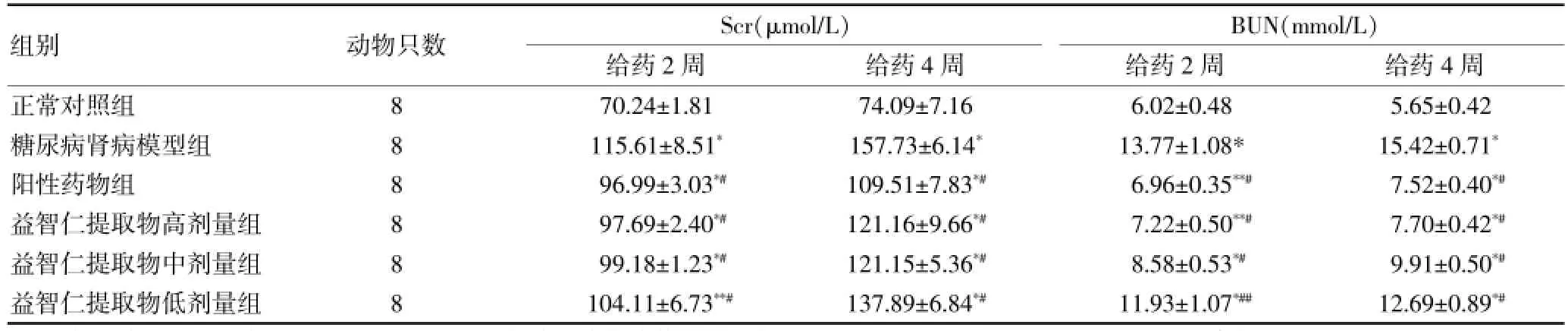
表4 各组小鼠血清Scr、BUN水平()
注:与正常对照组比较,*P<0.01,**P<0.05;与糖尿病肾病模型组比较,#P<0.01,##P<0.05;Scr:肌酐;BUN:尿素氮
组别 动物只数 Scr(μmol/L)给药2周 给药4周BUN(mmol/L)给药2周 给药4周正常对照组糖尿病肾病模型组阳性药物组益智仁提取物高剂量组益智仁提取物中剂量组益智仁提取物低剂量组888888 70.24±1.81 115.61±8.51*96.99±3.03*#97.69±2.40*#99.18±1.23*#104.11±6.73**#74.09±7.16 157.73±6.14*109.51±7.83*#121.16±9.66*#121.15±5.36*#137.89±6.84*#6.02±0.48 13.77±1.08* 6.96±0.35**#7.22±0.50**#8.58±0.53*#11.93±1.07*##5.65±0.42 15.42±0.71*7.52±0.40*#7.70±0.42*#9.91±0.50*#12.69±0.89*#
2.5 各组光镜下肾组织的情况
正常对照组:光镜下可见肾小球体积、形态均正常,基底膜未见增厚,系膜区没有扩大;DN模型组:可见肾小球肿胀,部分肾小球毛细血管上皮细胞空泡样变,系膜区略增宽;阳性药物组及益智仁提取物高剂量组与模型组比较,均有类似的病理变化,但损伤程度减轻。见图1。

图1 各组小鼠光镜下肾组织病理切片(HE染色,400×)
2.6 各组AQP2免疫组化染色情况
正常对照组未见棕黄色颗粒。DN模型组在肾脏外髓质部分可见在集合管管腔内壁细胞有棕黄色颗粒,即有AQP2蛋白的表达,而在肾小球和肾间质未见表达。阳性药物组及益智仁提取物高剂量组可见棕黄色颗粒,但阳性染色变弱,说明阳性表达减弱,即AQP2表达有所下调。见图2。
3 讨论

图2 各组小鼠水通道蛋白2表达情况(PV法,400×)
本实验运用STZ单次腹腔大量注射,成功制作DN小鼠模型。临床生化结果表明,DN模型小鼠血糖、血清BUN、Scr水平升高,尿糖阳性,24 h尿蛋白明显增加,相对肾重指数增加。蛋白尿既能反映肾脏损伤,又能加速肾脏病变进展,促进肾小球硬化、肾小管损伤等,因此能使蛋白尿减少的药物治疗都有利于减慢肾脏病变进展。厄贝沙坦能降低蛋白尿,保护肾脏,因此本实验选其作为阳性药物。益智仁提取物降低24 h尿蛋白定量,与DN模型组比较,益智仁提取物干预组的结果也明显降低(P<0.01),尤其是益智仁提取物高剂量组与阳性药物组效果相当 (P>0.05),说明益智仁提取物(石油醚部位)有较好的抑制尿蛋白排泄的作用。在降低BUN、Scr水平方面,与DN模型组比较,益智仁提取物各剂量组的结果也明显降低(P<0.01),表明其有保护肾功能的作用。
本实验还观察了小鼠肾脏情况。肾脏肥大是DN的早期特征,实验结果显示,与模型组比较,阳性药物组和益智仁提取物各剂量组的小鼠体重及相对肾重明显改善(P<0.01或P<0.05)。HE染色结果表明,阳性药物组和益智仁提取物各剂量组小鼠的肾小球、肾小管结构基本正常,与DN模型组比较,无明显肥大、纤维化,说明益智仁提取物(石油醚部位)与厄贝沙坦作用相似,对肾脏有一定的保护作用。
Kim等[11]运用STZ诱导DN,发现在肾脏髓质部AQP2表达持续升高。Nejsum等[12]也发现,在DN动物模型中肾脏内髓AQP2明显升高,可推测DN模型的肾功能水代谢异常与AQP2的表达改变密切相关。已有研究报道,周期素激酶抑制剂P27(P27kip1)在DN形成中,在高血糖诱导的肾间质细胞肥大和肾小球系膜增殖反应中起非常重要作用[13-14]。也有学者针对AQP2对肾功的影响进行了研究[15-16]。本实验观察到,益智仁提取物(石油醚部位)与厄贝沙坦处理的DN小鼠,肾功明显被保护,AQP2表达明显下调,从而推测可能通过抑制AQP2的表达实现保护肾功的效果。
本实验研究表明:益智仁提取物(石油醚部位)能够明显减少肾脏髓质AQP2的表达,对糖尿病肾病小鼠有肾脏保护作用,能延缓其病程,其机制可能与抑制AQP2的表达有关,后期研究本研究组将会针对具体的作用机制、信号转导通路,以及其作用的靶细胞等方面进行探讨。
[1]Zachary TB.Diabetes:east meets west.The joint american association of clinical endocrinologists-Chinese Society of Endocrinology(AACE-CSE)symposium [J].J Diabetes,2012,4(3):221-226.
[2]Packham DK,Alves TP,Dwyer JP,et al.Relative incidence of ESRD versus cardiovascular mortality in proteinuric type 2 diabetes and nephropathy results from the DIAMETRIC(Diabetes Mellitus Treatment for Renal Insufficiency Consortium)database[J].Am J Kidney Dis,2012,59(1):75-83.
[3]赵大鹏,隋艳波,桑仲秋,等.糖尿病肾病发病机制的研究进展[J].中国医药导报,2012,9(36):47-49.
[4]Balakumar P,Arora MK,Ganli SS,et al.Recent advances in pharmacotherapy for diabetic nephropathy:current perspectives and future directions[J].Pharmacol Res,2009,60(1):24-32.
[5]罗琳,张建中,门岚,等.短期治疗糖尿病肾病的研究[J].中国医药科学,2012,2(7):66-67.
[6]周慧超,张磊,刘传梅,等.2型糖尿病高血尿酸与糖尿病肾病的相关性研究[J].中国医药科学,2012,2(4):21-22.
[7]欧阳劭,陈伟,匡希斌.培哚普利对慢性心力衰竭大鼠肾脏水通道蛋白2的影响[J].中华心血管病杂志,2013,41(4):276-278.
[8]乌格敦其其格,赵宗江,蒋玉凤,等.糖肾平胶囊对STZ诱导糖尿病肾病大鼠肾脏保护及其对TGF-β1/p38MAPK信号转导通路的影响[J].中华中医药杂志,2012,27(4):1092-1094.
[9]胡波,范红伟,姚欣,等.丹参注射液联合卡托普利通过调节水通道蛋白2对Ⅳ期糖尿病肾病患者肾功能影响[J].时珍国医国药,2013,24(2):345-347.
[10]徐淑云,卞如濂,陈修.药理试验方法学[M].3版.北京:人民卫生出版社,2002.
[11]Kim D,Sands JM,Klein JD.Changes in renal medullary transport proteins during uncontrolled diabetes mellitus in rats[J].Am J Physiol Renal Physiol,2003,285(2):F303-F309.
[12]Nejsum LN,Kwon TH,Marples D,et al.Compensatory increase in AQP2,p2AQP2,and AQP3 expression in rats with diabetes mellitus[J].Am J Physiol Renal Physiol,2001,280(6):F715-F726.
[13]Loeffler I,Rüster C,Franke S,et al.Erythropoietin ameliorates podocyte injury in advanced diabetic nephropathy in the db/db mouse[J].Am J Physiol Renal Physiol,2013,305(6):911-918.
[14]Liao YC,Lee YH,Chuang LY,et al.Advanced glycation end products-mediated hypertrophy is negatively regulated by tetrahydrobiopterin in renal tubular cells[J]. Mol Cell Endocrinol,2012,355(1):71-77.
[15]胡波,李锋,李敏,等.泽黄煎剂对糖尿病大鼠肾脏水通道蛋白2表达的调节[J].中药新药与临床药理,2007,18(3):179-181.
[16]韩继龙,王勇,刘金钢.水通道蛋白2在梗阻性黄疸大鼠肾脏表达变化的实验研究[J].中国免疫学杂志,2015,31(2):261-263.
Effect of extract by mineral ether from Alpinia oxyphyllae on diabetic nephropathy mice and its mechanism
LIU Qiang1FANG Leichen2WEI Yi1GAO Xinzheng1LIU Yiming1XIE Yiqiang1
1.Department of Pharmacology,Hainan Medical College,Hainan Province,Haikou 571101,China;2.Reproductive Center,Shenzhen Armed Police Hospital,Guangdong Province,Shenzhen 518032,China
Objective To study the effect and mechanism of Alpinia oxyphyllae extract on diabetic nephropathy(DN) mice model.Methods 48 KM mice were were divided into 6 groups:DN model group,normal control group,positive control group,Alpinia oχyphyllae extract low,middle,high dosage group,with 8 mice in each group.DN model was induced by peritoneal injection of streptozotocin (STZ)150 mg/kg,after successfully established model,normal control group was given distilled water 10 mL/(kg·d)gavage,DN model group was given Irbesartan 10 mg/kg gavage,Alpinia oχyphyllae extract low,middle,high dosage group were given Alpinia oχyphyllae extract by mineral ether 5,10,20 g/ (kg·d),for 4 weeks.Bloood glucose,urine protein,renal function(BUN,Scr)were observed periodicly,when the experiment finished,mice were killed,relative kidney weight was measured,kidney tissue was observed by histomorphology, AQP2 was detected by immunohistochemistry.Results Hyperglycemia,urinary protein,damaged renal function, and increased serum creatinine were observed in model mice,pathological examination showed that glomerular hypertrophy,mesangial expansion,and basement membrane thickening.After giving drugs 4 weeks,compared with DN model group,24 h urinary protein in Alpinia oχyphyllae extract low,middle,high dosage group re-duced significantly,the differences were statistically significant(P<0.01);BUN,Scr in Alpinia oχyphyllae extract low, middle,high dosage group reduced significantly,the differences were statistically significant(P<0.01).The results of HE staining showed that pathologic change obviously alleviated in in Alpinia oχyphyllae extract high dosage group.The results of immunohistochemistry showed that AQP2 in normal control group had no positive expression,AQP2 in DN model group had positive expression,AQP2 in Alpinia oχyphyllae extract high dosage group had weak positive expression.Conclusion Alpinia oχyphyllae extract by mineral ether can protect the renal function of diabetic nephropathy mice,and the reducing expression of AQP2 would be the mechanism.
Alpinia oχyphyllae extract;Diabetic nephropathy;AQP2
R587.1
A
1673-7210(2015)11(c)-0021-05
2015-04-15本文编辑:苏 畅)
国家自然科学基金资助项目(8147318、81360 586);海南省自然科学基金项目(812186、814290);海口市重点科技计划项目(2012-076);海南医学院科研培育基金项目(HY 2012-009)。
刘嫱(1978-),女,博士,副教授;研究方向:新药药理。
谢毅强(1972-),男,教授;研究方向:糖尿病肾病的防治。
