下调15-LOX-2表达对缺氧状态下肺动脉平滑肌细胞的影响
2015-11-28邢文婧李思佳
刘 晔 邢文婧 李思佳
哈尔滨医科大学免疫教研室,黑龙江哈尔滨 150081
下调15-LOX-2表达对缺氧状态下肺动脉平滑肌细胞的影响
刘 晔 邢文婧 李思佳
哈尔滨医科大学免疫教研室,黑龙江哈尔滨 150081
目的 探讨下调15脂氧酶-2(15-LOX-2)对缺氧状态下肺动脉平滑肌细胞(PASMCs)的影响。方法 将PASMCs随机分为四组:正常对照组、缺氧组、scramble组、15-LOX-2 siRNA组。实时定量荧光聚合酶链反应(Real time PCR)检测15-LOX-2表达;噻唑蓝比色法(MTT)检测PASMCs增殖情况;酶联免疫吸附测定(ELISA)法检测15-羟基-二十碳四烯酸(15-HETE);分析活性氧(ROS)和超氧化物歧化酶(SOD)的表达变化。 结果缺氧增加15-LOX-2、15-HETE和ROS的产生,促进PASMCs增殖,减少SOD活性,与正常对照组比较,差异有统计学意义(P<0.05)。缺氧下转染15-LOX-2 siRNA可减少15-LOX-2、15-HETE和ROS的产生,抑制PASMCs增殖,增加SOD活性,与缺氧组比较,差异有统计学意义(P<0.05)。 结论15-LOX-2下调可通过减少15-HETE产生、调节氧化/抗氧化平衡、调控PASMCs的异常增殖,从而延缓缺氧性肺血管收缩的病理进程。
15-脂氧酶-2;肺动脉平滑肌细胞;15-羟基-二十碳四烯酸;氧化/抗氧化
缺氧可诱导缺氧性肺血管收缩(HPV)发生[1]。哺乳动物由于适应环境而出现HPV。通常一系列肺部疾病如高山病,外科手术如肺移植、单肺麻醉、应激状态等创伤可诱发HPV[2]。HPV是导致肺动脉高压乃至肺源性心脏病甚至诱发多脏器衰竭的重要原因[3-4]。研究提示缺氧可促进15脂氧酶-2(15-LOX-2)表达,其产物15-羟基-二十碳四烯酸(15-HETE)可促进缺氧肺动脉环发生收缩反应,提示15-LOX-2与HPV关系密切[5-6]。本研究自2011年1月~2014年12月深入探讨了下调15-LOX-2对缺氧状态下肺动脉平滑肌细胞(PASMCs)的作用。
1 材料与方法
1.1 实验试剂
15-HETE酶联免疫吸附测定(ELISA)试剂盒购自美国Roche公司;超氧化物歧化酶(SOD)活性检测试剂盒购自南京建成生物工程研究所;RNA提取试剂盒、反转录试剂盒购自美国invitrogen公司;细胞培养试剂购自美国Hyclone公司;siRNA引物由美国QIAGEN公司合成,引物合成由上海英骏生物技术有限公司完成;siRNA沉默构建试剂盒购自美国Amaxa Biosystems Technology公司。
1.2 实验动物
选取健康雄性Wistar大鼠,月龄2个月,SPF级,体重(250±20)g,购于哈尔滨医科大学附属二院实验动物中心(合格证号2001024)。本研究遵循本单位实验动物保护和使用指南,并经哈尔滨医科大学实验动物伦理委员会批准进行。
1.3 方法
1.3.1 肺动脉平滑肌细胞培养和分组 取出大鼠肺动脉,进行PASMCs体外原代培养[7]。取3~8代对数生长期PASMCs细胞用于实验,随机分为4组,分别为正常对照组、缺氧组、scramble组和15-LOX-2 siRNA组。缺氧组细胞置于细胞乏氧箱中,通入含92%N2、3% O2、5%CO2的混合气体,37℃条件下培养24 h。
1.3.2 转染15-LOX-2 siRNA 15-LOX-2 siRNA引物序列:5'-ATA TCT GCC AAC GTG CTA CGT-3',siRNA阴性对照引物序列:5'-ACT TCC GTA ATG GAC CTA CGT-3',转染步骤依照试剂盒说明进行。转染后放入细胞乏氧箱中培养24 h后进行后续试验。
1.3.3 实时定量荧光聚合酶链反应(Real time PCR)检测15-LOX-2 mRNA的表达 用Trizol试剂提取各组PASMCs细胞,进行Real-time PCR检测。引物序列见表1。反应条件:55℃1 min,循环条件为92℃30 s,50℃45 s,72℃35 s,共进行35个循环。进行数据收集,利用PCR反应仪软件,将磷酸甘油醛脱氢酶(GAPDH)作为参照,根据荧光定量,计算出所有样品以及标准品的起始循环数(CT),以标准品Ct值为依据,绘制出标准曲线,再根据2-△Ct法进行半定量分析。

表1 引物序列
1.3.4 15-HETE和氧化应激指标检测 利用ELISA法检测15-LOX-2产物15-HETE表达。分光光度法检测各组SOD活性和活性氧(ROS)含量变化。
3月16日,福建省食品安全委员会办公室和省食品药品监管局下发《福建省2018年食品生产加工小作坊示范点创建及考核验收工作方案》。《方案》提出,在巩固提升2017年小作坊示范点创建成果的基础上,到2018年底,全省新建成100家小作坊示范点,通过示范点创建,打造一批生产过程管控严格、食品安全有效保障的标杆单位,形成可复制、可推广的小作坊示范典型,基本形成一点带一片的良好示范带动格局,引导和推动福建省小作坊规范生产、健康发展。此外,福建省从2018年省级食品安全专项资金中安排200万元,通过以奖代补的方式对评选确定为示范点的小作坊(不含厦门)给予补助,补助标准为2万元/家。
1.3.5 噻唑蓝比色法(MTT)法检测PASMCs增殖变化
利用MTT法检测各组PASMCs增殖的变化。收集对数生长期PASMCs细胞,用含10%胎牛血清DMEM培养液以5×103个的细胞数接种于96孔培养板,培养24 h后弃去上清,随机分为4组:正常对照组、缺氧组、scramble组、15-LOX-2 siRNA组,处理方法同上。24 h后待测孔中加入20 μL无菌MTT,每个时间点设3个复孔;继续培养4 h后,彻底去除上清,加入DMSO 150 μL/孔,摇床振荡10 min,至紫色结晶充分溶解后,置酶标仪于570 nm波长处测定其吸光度(A)值,计算各组增殖率。
1.4 统计学方法
采用SPSS 16.0统计软件分析。计量资料以均数±标准差()表示,多组样本均数的比较应用单因素方差分析,组间两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组15-LOX-2 mRNA的表达变化
缺氧可上调PASMCs中15-LOX-2 mRNA表达,与正常对照组比较,差异有统计学意义(P<0.05)。15-LOX-2 siRNA可降低缺氧PASMCs中15-LOX-2,与缺氧组比较,差异有统计学意义(P<0.05)。见图1。

图1 各组15-LOX-2 mRNA的表达变化
缺氧可增加PASMCs中15-HETE生成,与正常对照组比较,差异有统计学意义(P<0.05)。下调15-LOX-2后,可降低缺氧PASMCs中15-HETE生成,与缺氧组比较,差异有统计学意义(P<0.05)。见图2。

图2 各组15-HETE的生成情况
2.3 下调15-LOX-2对缺氧状态下PASMCs增殖的影响
缺氧可促进PASMCs显著增殖,与正常对照组比较,差异有统计学意义(P<0.05)。下调15-LOX-2可减少缺氧PASMCs的增殖,与缺氧组比较,差异有统计学意义(P<0.05)。见图3。
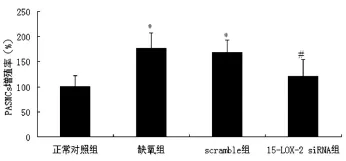
图3 下调15-LOX-2对缺氧状态下PASMCs增殖的影响
2.4 各组氧化应激指标分析
缺氧可促进PASMCs中ROS产生,降低SOD含量,与正常对照组比较,差异有统计学意义(P<0.05)。下调15-LOX-2可抑制ROS的产生,增加SOD含量,与缺氧组比较,差异有统计学意义(P<0.05)。见表2。
表2 各组氧化应激指标分析()

表2 各组氧化应激指标分析()
注:与正常对照组比较,*P<0.05;与缺氧组比较,#P<0.05;15-LOX-2:15脂氧酶-2;ROS:活性氧;SOD:超氧化物歧化酶
组别 ROS SOD正常对照组缺氧组Scramble组15-LOX-2 siRNA组107.5±35.6 291.9±27.5*286.5±31.2*128.6±41.7#117.3±11.6 47.6±6.1*52.3±5.3*99.5±15.2#
3 讨论
缺氧指组织供氧不足或用氧障碍,从而引起其代谢、功能以致形态结构发生异常变化的病理过程。缺氧时机体的功能代谢发生变化,呼吸系统、循环系统、血液系统、脑中枢、组织细胞都发生代偿性反应甚至功能障碍。缺氧可以通过直接作用于PASMC膜,也可以直接促进PASMCs增生,引起机体血管紧张素、一氧化氮、细胞因子以及离子浓度的变化,促进HPV发生,各器官代谢、功能和结构发生异常变化,可诱发肺动脉高压、心力衰竭[8-10]。
15-LOX-2是20世纪90年代被新鉴定出的同工酶[11],与其另外一种同工酶15-LOX-1在分布以及生物学特性存在不同,15-LOX-1广泛分布于身体各组织不同,15-LOX-2组织分布局限,仅在mRNA水平探查到存在于前列腺、皮肤、角膜等处[12]。而在前期研究中证实15-LOX-2在正常肺组织中不表达,但在HPV中表达显著增加[4]。15-LOX-2主要作用于花生四烯酸生成15-HETE[13]。15-LOX-2和其作用产物在炎症过程中起着重要的作用。它们不仅可以调控白三烯的形成还可以抑制白三烯的生理功能[14-16]。它可以调节炎性反应引起的中性粒细胞的趋化作用[13],其催化生成的产物15-HETE不仅可以作为脂氧素的底物,还可以抑制人类中性粒细胞超氧阴离子的产生[17-18]。因此本研究通过成组设计分析下调15-LOX-2对缺氧PASMCs的作用和机制。本研究证实利用siRNA技术干扰15-LOX-2的表达,可显著下调15-LOX-2,同时可抑制其产物15-HETE的产生,而通过调控15-LOX-2和其产物的表达,可以抑制PASMCs的异常增殖。研究表明,15-HETE是HPV的中间环节,同时研究提示缺氧时肺动脉内生成的15-HETE主要来源于15-LOX-2途径,上述研究说明15-LOX-2在HPV中发挥关键作用[19-20]。因此本研究结果提示15-LOX-2在HPV中主要通过作用花生四烯酸产生产物15-HETE,影响缺氧条件下PASMCs的增殖,从而调控HPV。
研究报道提示,缺氧还可引起机体氧化还原平衡紊乱,降低SOD等抗氧化酶的活性,增加活性氧族的生成,如ROS等氧自由基大量生产,进而促进HPV发生[21-23]。因此本研究进一步深入探讨下调15-LOX-2对缺氧条件下PASMC中氧化还原平衡的影响,结果显示,通过下调15-LOX-2在HPV中的表达,可促进SOD活性恢复,并抑制ROS氧自由基的产生,进而调控氧化/抗氧化环节,促进氧化还原平衡恢复,有助于延缓HPV的病理进程。
本研究提示15-LOX-2在HPV调控中发挥重要作用,可以为临床防控HPV治疗靶点选择提供参考和理论依据,并有助于阐释HPV发生机制的研究。
[1]Kholdani C,Fares WH,Mohsenin V.Pulmonary hypertension in obstructive sleep apnea:is it clinically significant? A critical analysis of the association and pathophysiology[J]. Pulm Circ,2015,5(2):220-227.
[2]García-de-la-Asunción J,García-Del-Olmo E,Perez-Griera J,et al.Oxidative lung injury correlates with onelung ventilation time during pulmonary lobectomy:a study of exhaled breath condensate and blood[J].Eur J Cardiothorac Surg,2015,48(3):e37-e44.
[3]Huetsch J,Shimoda LA.Na(+)/H(+)exchange and hypoxic pulmonary hypertension[J].Pulm Circ,2015,5(2):228-243.
[4]Liu Y,Tang X,Lu C,et al.Expression of 15-lipoxygenases in pulmonary arteries after hypoxia [J].Pathology,2009,41(5):476-483.
[5]Guo L,Tang X,Tian H,et al.Subacute hypoxia suppresses Kv3.4 channel expression and whole-cell K+currents through endogenous 15-hydroxyeicosatetraenoic acid in pulmonary arterial smooth muscle cells[J].Eur J Pharmacol,2008,587(1-3):187-195.
[6]Savai R,Al-Tamari HM,Sedding D,et al.Pro-proliferative and inflammatory signaling converge on FoxO1 transcription factor in pulmonary hypertension [J].Nat Med,2014,20(11):1289-1300.
[7]Ketabchi F,Mansoori S,Moosavi SM.The role of anion exchanger on pulmonary vascular response to sustained alveolar hypoxia in the isolated perfused rabbit lung[J].I-ran J Med Sci,2015,40(3):256-263.
[8]Green DE,Murphy TC,Kang BY,et al.pparγ ligands attenuate hypoxia-induced proliferation in human pulmonary artery smooth muscle cells through modulation of microRNA-21[J].PLoS One,2015,10(7):e0133391.
[9]Patel D,Alhawaj R,Wolin MS.Exposure of mice to chronic hypoxia attenuates pulmonary arterial contractile responses to acute hypoxia by increases in extracellular hydrogen peroxide [J].Am J Physiol Regul Integr Comp Physiol,2014,307(4):R426-R433.
[10]Cahill E,Rowan SC,Sands M,et al.The pathophysiological basis of chronic hypoxic pulmonary hypertension in the mouse:vasoconstrictor and structural mechanisms contribute equally [J].Exp Physiol,2012,97(6):796-806.
[11]Schewe T,Kuhn H.Do 15-lipoxygenases have a common biological role? [J].Trends Biochem Sci,1991,16(10):369-373.
[12]Kuhn H,Walther M,Kuban RJ.Mammalian arachidonate 15-lipoxygenases structure,function,and biological implications[J].Prostaglandins Other Lipid Mediat,2002,68-69:263-290.
[13]Brash AR,Jisaka M,Boeglin WE,et al.Molecular cloning of a second human 15S-lipoxygenase and its murine homologue,an 8S-lipoxygenase:their relationship to other mammalian lipoxygenases[J].Adv Exp Med Biol,1999,447:29-36.
[14]Lai N,Lu W,Wang J.Ca2+and ion channels in hypoxiamediated pulmonary hypertension[J].Int J Clin Exp Pathol,2015,8(2):1081-1092.
[15]Zhang J,Zhou J,Cai L,et al.Extracellular calcium-sensing receptor is critical in hypoxic pulmonary vasoconstriction[J].Antioxid Redox Signal,2012,17(3):471-484.
[16]Han W,Tang X,Wu H,et al.Role of ERK1/2 signaling pathways in 4-aminopyridine-induced rat pulmonary vasoconstriction[J].Eur J Pharmacol,2007,569(1-2):138-144.
[17]Li X,Ma C,Zhu D,et al.Increased expression and altered subcellular distribution of PKC-δ and PKC-ε in pulmonary arteriesexposedtohypoxiaand15-HETE[J].Prostaglandins Other Lipid Mediat,2010,93(3-4):84-92.
[18]Michalak A,Lewandowska-Polak A,Moskwa S,et al.IgE-mediated 15-hydroxyeicosatetraenoic acid(15-HETE)generation by peripheral blood leukocytes:its association with basophil activation [J].Postepy Dermatol Alergol. 2015,32(4):262-267.
[19]Shen T,Shi J,Wang N,et al.15-Lipoxygenase and 15-hydroxyeicosatetraenoic acid regulate intravascular thrombosis in pulmonary hypertension [J].Am J Physiol Lung Cell Mol Physiol,2015,309(5):L449-L462.
[20]Yu X,Li T,Liu X,et al.modulation of pulmonary vascular remodeling in hypoxia:role of 15-LOX-2/15-HETEMAPKs pathway[J].Cell Physiol Biochem,2015,35(6):2079-2097.
[21]Wei J,Xu H,Shi L,et al.Trimetazidine protects cardiomyocytes against hypoxia-induced injury through ameliorates calcium homeostasis[J].Chem Biol Interact,2015,236:47-56.
[22]Thurmond P,Yang JH,Li Y,et al.Structural modifications of the prostate in hypoxia,oxidative stress,and chronic ischemia[J].Korean J Urol,2015,56(3):187-196.
[23]Clarke MB,Wright R,Irwin D,et al.Sustained lung activity of a novel chimeric protein,SOD2/3,after intratracheal administration [J].Free Radic Biol Med,2010,49(12):2032-2039.
Effect of 15-lipoxygenase-2 down-regulation on hypoxic pulmonary arterial smooth muscle cells
LIU Ye XING Wenjing LI Sijia
Teaching and Research Office of Immunology,Harbin Medical University,Heilongjiang Province,Harbin 150081, China
Objective To explore the effect of 15-lipoxygenase-2 (15-LOX-2)down-regulation on hypoxic pulmonary arterial smooth muscle cells(PASMCs).Methods PASMCs were randomly divided into 4 groups,normal control group, hypoxic group,scramble group and 15-LOX-2 siRNA group.Real time PCR was used to detect the expression of 15-LOX-2.Proliferation of PASMCs was examined by MTT assay.ELISA was employed to detect 15-hydroxyeicosatetraenoic acid(15-HETE).The changes of reactive oxygen species(ROS)and superoxide dismutase(SOD)were analyzed.Results During hypoxia,the expression of 15-LOX-2,15-HETE,ROS and PASMCs proliferation were increased,the activity of SOD reduced,there were statistically significant differences compared with normal control group (P<0.05).After transfection of 15-LOX-2 siRNA during hyoxia,15-LOX-2,15-HETE,ROS and PASMCs proliferation were down-regulated,while SOD activity increased,there were statistically significant differences compared with hypoxic group (P<0.05).Conclusion 15-LOX-2 down-regulation can inhibit 15-HETE formation and abnormal PASMCs proliferation,regulate oxidant/antioxidant balance,which delays pathological process of HPV.
15-lipoxygenase-2;Pulmonary arterial smooth muscle cells;15-hydroxyeicosatetraenoic acid;Oxidation/ anti-oxidation
R563.9
A
1673-7210(2015)11(c)-0026-04
2015-08-10本文编辑:张瑜杰)
黑龙江省教育厅科学技术研究项目(12511177)。
刘晔(1978.4-),女,博士,副教授;研究方向:呼吸系统疾病的发病机制和防治。
