反应时间对聚多巴胺/纳米银修饰多孔钛生物学性能的影响
2015-11-28容锡沧谭帼馨宁成云李丽华
容锡沧 张 余 谭帼馨 谭 英 宁成云 李 梅 李丽华
反应时间对聚多巴胺/纳米银修饰多孔钛生物学性能的影响
容锡沧 张 余 谭帼馨 谭 英 宁成云 李 梅 李丽华
目的探讨制备新型钛基材料过程中,纳米银颗粒载入反应时间对其体外抗菌性能和细胞相容性等生物学性能的影响。方法通过聚合作用以多巴胺在纳米孔钛表面构建聚多巴胺(PDA)膜层,通过调节纳米银颗粒载入反应时间(15 min,30 min,60 min),得到不同纳米银颗粒浓度的聚多巴胺修饰钛。利用扫描电镜(SEM)、细胞黏附、细胞毒性及杀菌率等检测方法,对载不同纳米银颗粒浓度的聚多巴胺修饰钛进行体外生物相容性及抗菌性能评价。结果载入纳米银反应时间为30 min的钛基材料较其他反应时间的材料表现出良好的细胞黏附能力、较低的细胞毒性和满意的抗菌性能。结论通过调整纳米银沉积反应时间,可调节材料表面银离子释放量,可得到既有良好细胞相容性,又有较强抗菌能力的聚多巴胺/纳米银修饰多孔钛。
多孔钛聚多巴胺纳米银颗粒生物学性能反应时间
钛及其合金作为传统的金属植入物材料,具有良好的生物相容性、机械性和耐生物腐蚀性等特点,已广泛应用于临床及实验研究中。但是钛及其合金不具有抗感染能力,同时因表面具有较强的蛋白吸附能力,植入人体后表面形成的蛋白层容易被细菌定植而发生细菌感染,引起手术失败。另外,钛及其合金因表面存在生物惰性氧化层,不能与骨组织发生化学键性结构,在组织界面处容易形成纤维组织隔层,植入人体后容易发生松动,这亦是植入失败的原因之一。随着材料技术的发展,目前利用载银抗菌无机金属材料和纳米抗菌材料的优点,研究出一种新型抗菌剂,即纳米银抗菌材料,被认为是目前最强的抗菌材料。在细菌耐药性日趋严重的大环境下,纳米银具有安全性高、无耐药性,热稳定和化学稳定性好,抗炎能力强和促进损伤愈合等特性,使得利用纳米银改进钛及其合金日益受到关注。但是纳米银材料潜在的细胞毒性成为其广泛应用的制约因素。因此,寻找提高纳米银材料细胞相容性的方法尤其重要。聚多巴胺(PDA)具有仿贻贝黏连蛋白结构,其能提高材料的生物相容性和生物活性[1-2]。Giglio等[3]通过电聚合等方法,证明其形成于钛表面的纳米银/水凝胶复合涂层具有优良的生物活性和抗菌效果。此外,聚多巴胺还具有一定的还原性,Ball等[4]利用金属离子络合和还原的原理,将聚多巴胺处理后的聚苯乙烯材料与硝酸银溶液反应后在其表面形成纳米银涂层,从而可表明聚多巴胺能无电金属化于材料表面。本研究通过构建仿生聚多巴胺层于钛表面,进而通过反应时间来调节聚多巴胺对金属离子络合和还原程度,制备出载不同纳米银含量的聚多巴胺钛材料,并通过研究其体外抗菌性能和细胞相容性,探讨制备新型钛基植入材料的方法及其生物学性能。
1 实验方法
1.1 实验材料及试剂
金黄色葡萄球菌、大肠埃希菌、小鼠前成骨细胞均由广州军区广州总医院医学实验科冻存。
医用纯钛片(99.9%,宝鸡市启辰新材料科技有限公司);盐酸多巴胺(98%,阿拉丁试剂有限公司);硝酸银(98%,上海国药);4,6-联脒-2-苯基吲哚(DAPI,美国Sigma公司)。
扫描电镜(Nova Nano SEM4300,荷兰FEI公司);光电子能谱仪(ESCALAB 250,美国Thermo公司);石墨炉原子吸收光谱仪(Z-5000,日本Hitachi公司);荧光显微镜(1×2-ILL 100,日本Olympus公司);酶标仪(Multiskan FC,美国Thermo公司)。
1.2 材料制备
1.2.1 钛表面纳米孔结构化处理
实验材料由广东工业大学轻工化工学院制备提供。将直径为1 cm,厚度为0.1 mm的医用纯钛片(99.9%)分别用丙酮、无水乙醇和去离子水各超声清洗10 min,除去钛表面油污;再将钛片浸泡于HF(0.54 mol/L)、HNO3(0.29 mol/L)按体积比1∶1配成的溶液中反应5 min;去离子水超声清洗,置于50℃恒温干燥箱中干燥备用,得到酸处理钛片(Ti)。预处理后浸入60℃piranha溶液(VH2SO4∶VH2O2=7∶3)中反应30 min,超声清洗后,干燥得到纳米孔结构化钛(nTi)。
1.2.2 钛表面聚多巴胺仿生修饰
将nTi浸入到pH值为8.5、浓度为2 g/L的盐酸多巴胺(98%)溶液中振荡反应24 h,于超声清洗器中用去离子水清洗10 min,氮气中烘干,得到聚多巴胺修饰纳米孔化钛(Ti-PDA)。
1.2.3 Ti-PDA表面载纳米银
将Ti-PDA样品浸入到20 mM的硝酸银(98%)溶液中反应一定时间(15 min,30 min,60 min),再于超声清洗器中用去离子水反复清洗,后氮气干燥,得到不同反应时间的载纳米银聚多巴胺钛样品(Ti-PDA-Ag-15min,Ti-PDA-Ag-30min,Ti-PDA-Ag-60min)。
1.3 材料表征及化学成分分析
利用扫描电镜的方法观察样品表面的微观形貌和特点。使用光电子能谱仪分析样品的化学组成,采用15 KV、150 W、hν=1486.6 eV的单色AlKα射线,用C1s结合能为84.8 eV的标准进行能量校正。
1.4 银离子释放实验
为检验纳米银修饰钛表面材料银离子的释放情况,将Ti-PDA-Ag样品剪裁成1 cm2大小,在37℃恒温下浸入去离子水中,按设定的时间点(0.25 d,0.5 d,1 d,2 d,3 d,5 d,7 d,9 d,12 d,14 d)取出浸提液,每个样品利用石墨炉原子吸收光谱仪测定其中银离子的含量3次。
1.5 体外抗菌实验
革兰氏阳性菌以金黄色葡萄球菌为试验株,革兰氏阴性菌以大肠埃希菌为试验菌株,检验钛表面的抗菌性能,菌液均由广州军区广州总医院医学实验科冻存。操作如下:将冻存菌液加到LB液体培养基(Luria-Bertani培养基,含10 g/L蛋白胨,5.0 g/L氯化钠和5.0 g/L牛肉膏,pH值在7.0~7.2间)中,再放到恒温培养摇床37℃培养活化24 h。将菌液浓度调整至1×106CFU/mL(菌液浓度通过测定光密度OD值确定:在波长为600 nm条件下,0.1 OD值对应每毫升108个细胞)。将直径为1 cm2的钛样品置于24孔培养板中,用浓度106CFU/mL的细菌悬液500 μL与样品在37℃生化培养箱中共培养24 h后,将菌液稀释104倍后,取100 μL在固体LB培养基上涂板培养,最后计算菌落总数,计算杀菌率(R)。

1.6 样品表面细菌粘附实验
以金黄色葡萄球菌为代表,按照上述步骤将共培养6 h的样品用无菌生理盐水进行清洗,然后用戊二醇溶液固定5 h,PBS清洗后,乙醇梯度脱水(浓度为25%,50%,70%,95%,100%),每个浓度乙醇溶液均脱水10 min,CO2临界点干燥后喷金,置于扫描电镜下观察。
1.7 体外细胞黏附情况
小鼠前成骨细胞(MC3T3-E1)由广州军区广州总医院医学实验科冻存。将小鼠前成骨细胞悬液浓度调整至2×104cells/mL,吸取500 μL细胞悬液分别与Ti、nTi、Ti-PDA、Ti-PDA-Ag-15min、Ti-PDAAg-30min和Ti-PDA-Ag-60min样品在24孔培养板中37℃、5%CO2条件细胞培养箱内培养12 h。将样品用PBS清洗,戊二醇溶液固定5 h,再用PBS清洗,乙醇梯度脱水(浓度为25%,50%,70%,95%,100%),CO2临界点干燥后喷金,扫描电镜下观察。
6组样品按上述方法培养120 min后,加入4%多聚甲醛,4℃条件下30 min,再加入4,6-联脒-2-苯基吲哚,在室温下反应30 min,最后使用荧光显微镜观察拍照,平均3次,观察细胞早期黏附情况。
1.8 体外细胞毒性
将6组样品按照上述共培养的步骤进行处理,选取不同时间点(1 d、3 d、5 d和7 d),生理盐水清洗样品后,每孔加入300 μL α-MEM和30 μL MTT溶液,孵育3 h后吹打混匀,吸取提取液后置于96孔板中,用酶标仪以样品Ti作为对照样在490 nm波长下测定OD值,平均3次,并进行统计学处理。
1.9 统计学方法
应用SPSS 13.0软件进行统计分析。实验数据以x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 材料表征及化学成分分析
样品Ti、nTi、Ti-PDA、Ti-PDA-Ag-15min、Ti-PDA-Ag-30min和Ti-PDA-Ag-60min均可通过扫描电镜观察。Ti通过piranha溶液(H2O2/H2SO4混合液)酸洗钛表面,形成纳米孔化结构;多巴胺经过一系列反应后在纳米网结构的钛表面构建出均匀颗粒状的聚多巴胺膜层;将聚多巴胺修饰的多孔钛浸入硝酸银溶液中,通过调整反应时间,得到固定不同浓度纳米银粒子的钛基材料(图1)。
通过光电子能谱仪(XPS)分析Ti-PDA-Ag-30min样品表面化学组成,XPS宽谱中400 eV左右出现一个较强的N 1s峰,归属于PDA,XPS定量结果计算其表面O/C比值为0.32,与PDA结构理论值0.25较为接近,说明PDA成功自聚合在纳米结构化钛表面。结合能约为370 eV处有两个很强的Ag 3d峰,分别对应Ag0 3d5/2(368.28 eV)和Ag0 3d3/2(374.18 eV),说明纳米银沉积在Ti-PDA表面,且以银单质形式存在(图2)。
2.2 银离子释放实验
Ti-PDA-Ag-15min、Ti-PDA-Ag-30min和Ti-PDA-Ag-60min样本的银离子释放均呈递减的趋势,释放初期(2 d),银离子释放显著,后期释放趋于稳定(图3)。同时,随着沉积时间的增加,银离子的释放总量是在增加的。至14 d,Ti-PDA-Ag-15min、Ti-PDA-Ag-30min和Ti-PDA-Ag-60min样本的银离子累积释放量分别相当于其载银总量的11.47%、14.73%和17.10%。
2.3 体外抗菌实验
体外抗菌实验显示,无论单纯纳米结构化的钛还是增加了聚多巴胺修饰的钛(Ti、nTi和Ti-PDA),对两种细菌均未见明显的杀灭作用,而聚多巴胺/纳米银修饰钛表面具有较强的杀菌作用(图4)。Ti-PDA-Ag-15min、Ti-PDA-Ag-30min及Ti-PDA-Ag-60min样本,对金黄色葡萄球菌的杀菌率分别为60.4%、100%和100%,对大肠埃希菌的杀菌率分别为83.8%、100%和100%(图5)。
2.4 样品表面细菌黏附实验
细菌黏附实验扫描电镜结果显示,样本Ti、nTi和Ti-PDA表面黏附的细菌均较多,并且细菌量未见明显差异,而样本Ti-PDA-Ag-15min、Ti-PDAAg-30min和Ti-PDA-Ag-60min细菌黏附的数量大大减少,且部分发生碎裂,并且随着纳米银含量增多而更加明显(图6)。
2.5 体外细胞黏附情况
各样本表面小鼠前成骨细胞的早期黏附情况电镜下观察显示,Ti样本表面的小鼠前成骨细胞呈椭球状和长梭形,只能见到少量伪足伸展;nTi样本小鼠前成骨细胞呈不规则多边形铺展,较Ti表面伸出较多伪足;而使用聚多巴胺(PDA)活化的材料样本(Ti-PDA、Ti-PDA-Ag-15min、Ti-PDA-Ag-30min及Ti-PDA-Ag-60min),小鼠前成骨细胞呈不规则多边形,可见其有较多伪足甚至伪足间的交联(图7)。
DAPI染色观察,Ti-PDA、Ti-PDA-Ag-15min、Ti-PDA-Ag-30min及Ti-PDA-Ag-60min样本MC3T3-E1细胞早期黏附的数量均较Ti及nTi明显增多,差异显著(P<0.05),且Ti-PDA材料细胞早期黏附数量较其余各样本显著增多(P<0.001,图8-9)。
2.6 体外细胞毒性
MTT结果(图10)表明,小鼠前成骨细胞与Ti、nTi、Ti-PDA、Ti-PDA-Ag-15min、Ti-PDA-Ag-30min和Ti-PDA-Ag-60min材料共培养1 d和3 d,各组材料中细胞增殖情况无显著差异(P>0.05);至培养5 d和7 d,Ti、nTi和Ti-PDA之间细胞增殖数量无显著差异(P>0.05),而Ti-PDA-Ag-15min及Ti-PDAAg-30min对小鼠前成骨细胞增殖表现出一定的抑制作用(P<0.05),但增殖率仍大于90%。但是Ti-PDA-Ag-60min的增殖率已明显降低(P<0.001),增殖率接近于80%,与Ti-PDA-Ag-15min及Ti-PDAAg-30min样本比较,已有较大的细胞毒性。

图1 样本的扫描电镜结果Fig.1 The results of SEM observation

图2 样本Ti-PDA-Ag-30min的能谱分析(XPS)结果Fig.2 XPS spectra analysis of the Ti-PDA-Ag-30min samples

图3 样本Ti-PDA-Ag-15min、Ti-PDA-Ag-30min和Ti-PDAAg-60min的银离子释放溶解曲线
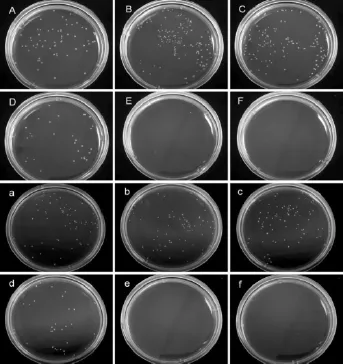
图4 各样品的杀菌能力Fig.4 Typical photographs of re-cultivated colonies on agar

图5 载纳米银样品的杀菌率对比Fig.5 Sterilization rate of the silver nanoparticles loaded samples

图6 样品表面金黄色葡萄球菌黏附6 h扫描电镜图Fig.6 SEM observation of titanium surfaces after incubation with staphylococcus aureus for 6 hours

图7 各样本细胞黏附扫描电镜观察Fig.7 SEM observation of cell adhesion in each sample
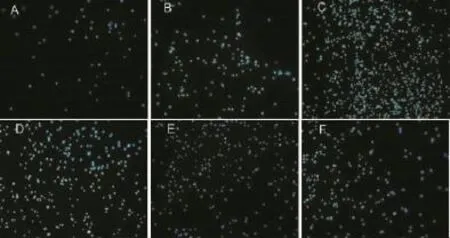
图8 MC3T3-E1细胞共培养120 min粘附情况的荧光显微镜图(DIPI染色)Fig.8 The fluorescence images of MC3T3-E1 cells(stained with DAPI)after cultured on different surfaces for 120 minutes

图9 MC3T3-E1细胞共培养120 min黏附数目比较Fig.9 Initial cell adhesion properties of MC3T3E1 cells after cultured on different surfaces for 120 minutes
3 讨论
3.1 聚多巴胺修饰纳米孔化钛表面载纳米银
Uede等[5]研究证实,H2O2/H2SO4混合液处理不同时间,会因其对基底的刻烛作用而引起钛表面粗糙度的不同改变。不同粗糙度的材料表面又将影响骨整合和机械固定的情况,微米尺度表面结构的材料通过与周围的骨组织进行机械咬合而达到长期的机械稳定性,而纳米尺度表面结构的材料则通过直接或间接的相互作用影响细胞行为,从而影响骨整合速度。谭英等[6]为了实现钛表面微纳米结构复合,通过控制H2O2/H2SO4溶液的反应时间、温度和配比,在酸处理的亚微米“台阶”结构钛表面构建了不同的纳米形貌,得到微纳米复合结构;氧化液的溶解作用使得钛表面原有的亚微米“台阶”随着时间逐渐被刻烛,亚微米粗糙度降低;氧化后钛表面的亲水性和表面能大大提高,化学成分主要为无定型的Ti02;并推导了化学氧化法构建不同纳米形貌的机理,认为主要是反应过程中钛基底的溶解与二氧化铁沉积反应之间相互竞争的结果;其细胞实验结果表明,相较于酸处理钛片,化学氧化改性得到的微-纳米多级结构更能够促进成骨细胞的早期黏附、增殖和分化。同时,通过H2O2/H2SO4混合液处理,使得钛表面羟基化。
多巴胺(3,4-二经基苯丙氨,dopamine)是3,4-二羟基苯丙氨酸(DOPA)的一种非常重要的衍生物,含有丰富的儿茶酚和乙氨基活性基团。多巴胺具有与DOPA相似的物理化学性质,几乎能黏附到任何材料基底上[1]。聚多巴胺之所以能在一些羟基化的材料表面形成强的黏附,是因为其中的邻苯二酚基团可与羟基形成有强结合力的双齿类配位体[7]。本研究中,通过piranha溶液(H2O2/H2SO4混合液)处理酸洗钛表面,不仅纳米结构化了钛表面,而且活化了钛表面,使其富含羟基,增强了聚多巴胺层的结合力。另外,多巴胺能在碱性条件下形成聚多巴胺单分子层,吸附于纳米网孔化的钛材料表面,目前Zhang等[8]已通过实验证实上述情况。
本实验中,多巴胺经过氧化、环化、分子内重排等一系列自聚合反应后,在纳米网结构的钛表面构建出均匀颗粒状的聚多巴胺膜层;将聚多巴胺修饰的多孔钛浸入硝酸银溶液中,聚多巴胺表面的邻苯二酚基团和醌式基团对银离子具有络合作用,使银离子吸附在其表面;同时,聚多巴胺利用表面酚羟基的氧化还原性将吸附的银离子原位化学还原成Ag纳米粒子固定在基底表面[6-7],并通过调控沉积反应时间,可得到固定不同浓度纳米银粒子的钛基材料。
3.2 细胞相容性
医用金属材料与普通金属材料有较大的不同,医用金属材料的要求高,因其植入体内后将与组织和细胞长期直接接触,需要满足较多的要求,包括良好的生物相容性、无毒副作用、生物活性及生物结合性好、植入体内能够与机体组织形成紧密结合或通过材料诱导组织生长等[9]。纳米银材料是一种新型的抗菌材料,但是纳米银材料潜在的细胞毒性成为其广泛应用的制约因素。有研究表明,银离子产生的细胞毒性均于较高浓度下产生[10-11]。
本研究中设定15 min、30 min、60 min沉积时间点,得到3个不同的样品Ti-PDA-Ag-15min,Ti-PDA-Ag-30min和Ti-PDA-Ag-60min。小鼠前成骨细胞早期黏附情况的电镜观察及DAPI染色观察表明,纳米结构化钛表面和聚多巴胺仿生膜层有利于细胞的早期黏附。MTT实验结果表明,至培养后期(5 d和7 d),Ti-PDA-Ag-15min及Ti-PDA-Ag-30min对小鼠前成骨细胞的增殖显示出一定的抑制作用,但增殖率仍大于90%,说明材料细胞毒性较低,符合0级医用生物材料标准。但是Ti-PDA-Ag-60min的增殖率已明显降低,接近于80%,有较大的细胞毒性。实验发现,利用聚多巴胺良好的细胞相容性及生物学活性,并通过调整聚多巴胺修饰的多孔钛浸入硝酸银溶液的沉积反应时间,可调整材料纳米银含量,得到既有良好生物相容性,又有较低细胞毒性的钛基纳米银材料。
3.3 体外抗菌性能
无机抗菌剂表面改性材料与抗生素和天然抗菌剂不同,以抗菌金属Ag、Cu、Zn等为代表的无机抗菌剂不仅具有良好的生物安全性、耐热性、持久性以及良好的加工性能,而且具有广谱抗菌性、高杀菌效率、不容易产生耐药等优点[12]。其主要通过添加Ag、Cu、Zn等无机抗菌剂发挥抗菌功能。有研究分析,带正电的Ag、Cu、Zn等抗菌金属离子可吸附至表面带负电荷的细菌细胞膜表面,进而损伤细菌的细胞膜、细胞壁[13-14]。当抗菌金属离子吸附到细菌细胞膜后,可使细菌细胞膜的通透性改变,同时使细菌内大量新陈代谢所必需的还原糖和蛋白质等物质泄漏,诱导细菌死亡[12,15-16]。另外,Zafar等[17]研究表明,聚多巴胺膜层结构中存在一种苯酚类物质,有较弱的抗菌作用,但达不到常规的抗菌要求。另外,纳米银体外抗菌性能与其含量、形状及尺寸等有着重要关联。Shahverdi等[18]证明,较小粒径的纳米银具有更大的比表面积,更强的细胞穿透性,具有更强的杀菌能力。
本研究结果表明,引入纳米银的钛基材料有高效的杀菌性。细菌生物膜形成的过程主要包括:细菌在植入物表面的黏附、增殖、分离三部分,而细菌黏附则是引发植入物感染的起始因素[19-20]。破坏细菌在金属内植物表面的黏附可有效减少感染的发生。扫描电镜示,Ti、nTi和Ti-PDA样本表面黏附的细菌均较多,且细菌量未见明显差异,而大量的细菌黏附较易形成生物膜,当生物膜形成后细菌将在其保护下避免受到如抗菌素等的杀伤,容易发生顽固的感染。而样本Ti-PDA-Ag-15min、Ti-PDA-Ag-30min和Ti-PDA-Ag-60min细菌黏附的数量大大减少,且部分发生碎裂,并随着纳米银含量增多而趋于明显,避免了细菌生物膜的形成。另外,在银离子释放实验中,我们发现Ti-PDA-Ag-15min、Ti-PDA-Ag-30min和Ti-PDA-Ag-60min样本的银离子累积释放量分别相当于其载银总量的11.47%、14.73%和17.10%,可以预见,纳米银修饰的钛表面具有持久的抗菌性能。
综合上述结果,通过纳米孔化钛表面、增加聚多巴胺涂层及载纳米银颗粒等作用,得到的新型钛材料表面有较好的细胞黏附性能及较强的杀菌能力。银离子有一定的细胞毒性,通过调整纳米银沉积反应时间,可调节材料表面银离子释放量,得到既有较低的细胞毒性,又有较强抗菌能力的聚多巴胺/纳米银修饰钛表面材料。聚多巴胺仿生膜层的接枝厚度可以通过控制多巴胺接枝浓度、时间等调控。因此,可以保留钛基底纳米结构的同时,实现聚多巴胺膜层的仿生修饰和纳米载银;且聚多巴胺表面丰富的活性基团可以进一步接枝生物分子,根据具体临床的需要,实现钛表面的特异性功能化,扩大钛金属的用途。本研究只是初步的体外研究,下一步将结合内植物材料的体表面积等因素,进行如最佳的反应时间等的下一步研究。
[1]Lee H,Dellatore SM,Miller WM,et al.Mussel-inspired surface chemistryformultifunctionalcoatings[J].Science,2007,318 (5849):426-430.
[2]Lynge ME,van der Westen R,Postma A,et al.Polydopamine--a nature-inspired polymer coating for biomedical science[J]. Nanoscale,2013,3(12):4916-4928.
[3]De Giglio E,Cafagna D,Cometa S,et al.An innovative,easily fabricated,silver nanoparticle-based titanium implant coating: development and analytical characterization[J].Anal Bioanal Chem,2013,405(2-3):805-816.
[4]Ball V,Nguyen I,Haupt M,et al.The reduction of Ag+in metallic silver on pseudomelanin films allows for antibacterial activity but does not imply unpaired electrons[J].J Colloid Interface Sci, 2011,364(2):359-365.
[5]Ueda M,Ikeda M,Ogawa M.Chemical-hydrothermal combined surface modification of titanium for improvement of osteointegration [J].Mater Sci Eng,2009,29(3):994-1000.
[6]谭英,谭帼馨,宁成云,等.钛表面化学氧化法构建纳米凝胶层性能及机理研究[J].稀有金属材料与工程,2014(10):2425-2430.
[7]Ye Q,Zhou F,Liu W.Bioinspired catecholic chemistry for surface modification[J].Chem Soc Rev,2013,40(7):4244-4258.
[8]Zhang RX,Braeken L,Luis P,et al.Novel binding procedure of TiO2nanoparticles to thin film composite membranes via selfpolymerized polydopamine[J].J Membr Sci,2013,15(437):179-188.
[9]Zhang Y,Zhang M.Three-dimensional macroporous calcium phosphate bioceramics with nested chitosan sponges for loadbearing bone implants[J].J Biomed Mater Res,2002,61(1):1-8.
[10]Navarro E,Piccapietra F,Wagner B,et al.Toxicity of silver nanoparticles to Chlamydomonas reinhardtii[J].Environ Sci Technol,2008,42(23):8959-8964.
[11]Cao H,Liu X,Meng F,et al.Biological actions of silver nanoparticles embedded in titanium controlled by micro-galvanic effects[J]. Biomaterials,2011,32(3):693-705.
[12]Sawai J.Quantitative evaluation of antibacterial activities of metallic oxide powders(ZnO,MgO and CaO)by conductimetric assay[J].J Microbiol Methods,2003,54(2):177-182.
[13]Feng QL,Wu J,Chen GQ,et al.A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J].J Biomed Mater Res,2000,52(4):662-668.[14]Kim JS,Kuk E,Yu KN,et al.Antimicrobial effects of silver nanoparticles[J].Nanomedicine,2007,3(1):95-101.
[15]Li WR,Xie XB,Shi QS,et al.Antibacterial activity and mechanism of silver nanoparticles on Escherichia coli[J].Appl Microbiol Biotechnol,2010,85(4):1115-1122.
[16]Kim KJ,Sung WS,Suh BK,et al.Antifungal activity and mode of action of silver nano-particles on Candida albicans[J]. Biometals,2009,22(2):235-242.
[17]Zafar I,Edward PCL,Tyler JA.Antimicrobial effect of polydopamine coating on Escherichia coli[J].J Mater Chem,2012,22(40): 21608-21612.
[18]Shahverdi AR,Fakhimi A,Shahverdi HR,et al.Synthesis and antibacterial activity of silver nanoparticles with different sizes [J].J Nanoparticle Res,2008,10(8):1343-1348.
[19]Valappil SP,Pickup DM,Carroll DL,et al.Effect of silver content on the structure and antibacterial activity of silver-doped phosphate-based glasses[J].Antimicrob Agents Chemother,2007, 51(12):4453-4461.
[20]Mack D,Rohde H,Dobinsky S,et al.Identification of three essential regulatory gene loci governing expression of Staphylococcus epidermidis polysaccharide intercellular adhesin and biofilm formation[J].Infect Immun,2000,68(7):3799-3807.
The Influence of Reaction Time on the Biocompatibility of Polydopamine/Silver Nanoparticles Modified Porous Titanium
RONG Xicang1,ZHANG Yu2,TAN GuoXin3,TAN Ying3,NING Chengyun4,LI Mei2,LI Lihua2.1 The Affiliated Jiangmen People’s Hospital of Southern Medical University,Jiangmen 529000,China;2 General Hospital of Guangzhou Military Command,Guangzhou 510010,China;3 Faculty of Light and Chemical,Guangdong University of Technology, Guangzhou 510006,China;4 College of Materials Science and Technology,South China University of Technology,Guangzhou 510641,China.Corresponding author:ZHANG Yu(E-mail:luck_2001@126.com).
ObjectiveTo investigate the reaction time influence on the antibacterial property and cytocompatibility of polydopamine/silver nanoparticles modified porous titanium.MethodsA bioinspired polydopamine(PDA)layer was deposited on titanium surface by polymerization.By adjusting the response time of nanosize silver particles(15 min,30 min, 60 min)of the modified titanium,different concentration of silver nanoparticles modified titanium coated by polydopamine were prepared.Using scanning electron microscopy(SEM),cell adhesion,cell toxicity and sterilization rate examination to evaluate the in vitro biocompatibility and antibacterial properties of polydopamine modified titanium with load of different concentration of silver nanoparticles.ResultsThe modified titanium surface material with the response time of 15 min in nanosize silver particles loading,showed better cell adhesion ability,lower cytotoxicity and more satisfactory antibacterial properties than the others.ConclusionBy adjusting the reaction time of nano silver deposition,the silver ion release quantity is adjustable,and the polydopamine/silver nanoparticles modified porous titanium,which have good cell compatibility and strong antibacterial ability,can be gained.
Porous titanium;Polydopamine;Silver nanoparticles;Biocompatibility;Reaction time
R318.08
A
1673-0364(2015)05-0295-07
10.3969/j.issn.1673-0364.2015.05.003
2015年5月19日;
2015年6月28日)
国家自然科学基金项目(81271957)。
529000广东省江门市南方医科大学附属江门市人民医院(容锡沧);510010广东省广州市广州军区广州总医院骨科医院(张余,李梅,李丽华);510006广东省广州市广东工业大学化工轻工学院(谭帼馨,谭英);510641广东省广州市华南理工大学材料科学与工程学院(宁成云)。
张余(E-mail:luck_2001@126.com)。
