巨型先天性黑色素细胞痣的临床病理表现
2015-11-28余庆雄李青峰
吴 敏 谢 峰 余庆雄 李青峰
巨型先天性黑色素细胞痣的临床病理表现
吴 敏 谢 峰 余庆雄 李青峰
目的探讨巨型先天性黑色素细胞痣(Giant congenital melanocytic nevi,GCMN)的临床特点,组织病理表现以及治疗方法。方法收集分析20例GCMN患者临床资料,观察总结其临床表现,切取标本进行HE、Masson、免疫组化染色,光镜下观察。结果20例均为先天性散发病例,发病部位可为头面部、躯干部和手臂,典型皮损为大面积表面被毛(多为黑色浓密毛发)的浅棕至深黑色色素沉着样皮肤变化。镜下见痣细胞浸润至真皮深层,可达皮下组织。真皮浅层可见“境界带”和“色素沉着”现象。免疫组化染色可见GCMN中痣细胞Melan-A、S-100染色阳性;HMB-45染色呈局灶性阳性;PCNA染色见痣细胞呈高增殖状态。对部分非手术治疗患者的病理切片观察可见,化学剥脱治疗后真皮浅层色素和痣细胞大量减少,而对深层痣细胞无明显影响。激光治疗后真皮乳头层色素沉着消失,局部皮肤黑色外观改善。结论GCMN中黑痣细胞浸润深度深,与神经嵴来源黑色素细胞具有同源性,且呈高增殖状态。化学剥脱治疗与激光治疗各有其特点,但均只能改善局部外观,为非彻底的治疗方法。目前临床上针对累及大部分皮肤的GCMN治疗仍是难点,亟待探索新的治疗方法。
先天性巨型黑色素细胞痣组织病理学治疗方法
黑色素细胞痣是指由黑色素性痣细胞所组成的良性病变[1],发病无性别差异。黑色素细胞痣有先天性和后天性之分。当出生时直径大于6 cm时或换算为成人体表面积直径≥20 cm时,可诊断为先天性巨型黑色素细胞痣(GCMN)。
GCMN严重影响患者外观,给患儿及家属造成极大心理压力,且相关研究证实GCMN患者恶变几率高达5%~8%[2-3],而在普通人群中恶性黑色素瘤的发病率仅为3/10 000~4/10 000[4]。GCMN可有不同的临床表现,可被毛或不被毛,颜色浅棕至深黑,皮肤光滑或粗糙,皮纹深或浅等,但其临床表现多样性的病理基础尚不甚明了。Jugpal等[5]初步观察总结了先天性痣的病理特点,认为其浸润较后天性痣更深。Lawrence[6]认为,GCMN患者真皮全层甚至皮下筋膜肌肉均可见痣细胞,且附属器也有累及。Kishi等[7]对行剥脱和磨削治疗的GCMN患者随访后提出,治疗后局部是否复发与真皮内毛囊被痣细胞累及密切相关,痣细胞累及真皮毛囊等附属器的患者,剥脱和磨削治疗后易复发。由此可见,GCMN的病理特点与其治疗密切相关。目前,关于GCMN的病理研究尚不全面,本研究收集20例临床GCMN患者资料,拟对GCMN临床及病理特点进行探讨。
1 对象与方法
1.1 病例来源与实验试剂
收集我科2013年3月至2015年8月入院诊断为GCMN的病例20例。其中,男性14例,女性6例。就诊年龄为1~37岁,平均就诊年龄9.6岁,小于3岁的6例。病灶分布范围:头面部11例,躯干部5例,四肢部位4例。所有患者于术中采集标本,均征得患者及其家属同意,并经医院伦理委员会批准。
Melan-A抗体(Santa Cruz公司,美国);HMB-45抗体(Dako公司,丹麦);S-100抗体(Epitomics公司,美国)。
1.2 方法
1.2.1 HE染色
患者病变皮肤标本石蜡包埋,4 μm厚度切片,脱蜡,HE染色,脱水透明并用中性树脂封片。
1.2.2 Masson染色
石蜡切片脱蜡,苏木素、丽春红染色,分化后直接用亮绿浸染,继续脱水透明,中性树脂封片。
1.2.3 免疫组化
石蜡包埋切片后脱蜡至水,以3%双氧水孵育15 min以阻断内源酶反应,PBS清洗3次后用1% BSA封闭非特异性反应30 min,加入一抗4℃过夜(本实验采用Melan-A,HMB-45与S-100作为一抗),PBS清洗3次后加入二抗,37℃孵育30 min,PBS洗3次,每次5 min,DAB显色10 min,自来水冲洗,苏木素复染,盐酸乙醇分化,逐级乙醇脱水,二甲苯透明,中性树脂封固即可。
2 结果
2.1 统计结果
性别:男14例,女6例;损害部位(主痣):头面部11例,躯干部5例,四肢4例;颜色:黑色13例,深棕3例,浅棕2例,浅棕至深黑2例;痣细胞浸润深度:真皮全层11例,皮下组织6例,无法判别3例;卫星痣:有卫星痣4例,无卫星痣16例;既往治疗史:化学剥脱2例,激光治疗1例;均被有毛发。
2.2 巨型先天性黑色素细胞痣病理结果
镜下可见痣细胞大量存在于真皮中,痣细胞普遍浸润较深,可达真皮中下层至真皮深层,部分标本皮下组织亦可累及。痣细胞在真皮乳头层可呈散在分布或巢状聚集,在真皮网状层的胶原纤维之间呈片索状分布,皮肤附属器、血管和神经周围可见痣细胞浸润(图1A)。真皮浅层可见大量黑色素沉积,部分色素为巨噬细胞所吞噬。大部分标本于真皮乳头层下可见一未受痣细胞累及的窄小条带(图1B),称为“境界带”或“Grenz zone”[8],统计20例患者中可见此现象的有15例,占75%。GCMN颜色可由浅棕至深黑,同一患者病灶亦可见深浅不同颜色,对比同一患者面部深、浅病灶的病理表现,可见深色区域较浅色区域真皮中痣细胞的密度显著增加,胶原纤维受到大量破坏,且真皮浅层的色素沉积明显(图1C、D)。有文献报道,大约80%的GCMN患者具有与其相关联的单个或多个卫星痣,卫星痣是GCMN患者主痣病灶以外散发的小病灶,分散在四肢、躯干、头颈部[9]。本研究对比1例4岁男性患儿(图2A)的主痣与卫星痣发现,患者腹股沟处主痣可见前述“境界带”,表皮一般不受累及(但仍有1例患者可见表皮中有一巢状排列的痣细胞团),真皮浅层痣细胞大量浸润并伴色素沉积,真皮深层痣细胞明显减少,残存胶原纤维含量增加(图2B)。肩部及头部卫星痣均无明显“境界带”,且色素沉积量大,痣细胞浸润密度较主痣大(图2C、D)。
目前对于痣细胞尚缺乏特异性高的免疫指标,但一些标志物仍有较好的参考价值,本研究中我们选用HMB-45、S-100和Melan-A对GCMN进行免疫组化染色,可见GCMN中痣细胞Melan-A和S-100均表达阳性(图3A、B),HMB-45呈局灶性阳性表达(图3C)[10]。PCNA标记的免疫组化染色结果显示,大部分痣细胞呈PCNA阳性,提示GCMN中痣细胞具有较高增殖活性(图3D)。
2.3 非手术治疗方法
2.3.1 化学剥脱治疗
剥脱术通过化学试剂或药物涂剂引起表皮和真皮浅层不同程度的坏死,继而再上皮化以重塑皮肤表面,改善皮肤质量。本研究取剥脱治疗后患者标本,HE染色镜下可见未治疗区域痣细胞浸润至真皮全层,真皮浅层可见大量散在色素沉着,浅层浸润痣细胞较大,圆形,真皮中层及深层痣细胞略小,圆形、短梭形,胞浆内所含色素颗粒少或无,痣细胞弥散排列。化学剥脱区域可见真皮浅层未见色素沉积,浅层痣细胞大范围减少,代以大量增生胶原纤维,可见表层纤维化,深层结构与前述相似(图4A-C)。
2.3.2 激光治疗后
激光常用于色素性疾病的治疗。对1例局部激光治疗后的患者标本镜下观察,可见未治疗区域的真皮浅层可见大量色素沉积,真皮深层可见中等密度痣细胞浸润。治疗区域真皮浅层未见色素沉着,真皮层中痣细胞浸润密度无明显变化。提示激光可去除浅层色素沉着,但对痣细胞无明显影响(图4D-F)。

图1 典型病例1Fig.1 Typical case 1

图2 典型病例2Fig.2 Typical case 2
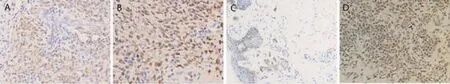
图3 典型病例3Fig.3 Typical case 3

图4 典型病例4Fig.4 Typical case 4
3 讨论
GCMN是较为罕见的一类先天性疾病,发病机理尚不明确。目前对于GCMN的病理研究并不多,大多是针对先天性痣(CMN)的描述,且文献报道GCMN的病理特点与CMN不甚相同。因此,本研究收集20例GCMN患者标本,进行临床病理探讨。
本研究发现,GCMN皮损部位大多集中在真皮层,且浸润深度深,除无法判别的切片,均达真皮全层,甚至达皮下组织。也有部分切片在表皮层中见到单个巢状痣细胞团,即存在皮内痣或混合痣的形式。痣的颜色可深可浅,其深浅与痣细胞的浸润深度、密度有直接关联,痣细胞浸润的密度与深度越深,其外观颜色越深。痣细胞的大量浸润亦可破坏真皮原本的胶原结构,密度越大,胶原含量及结构破坏越明显,皮肤的质感、弹性与光泽愈差,功能与外观明显受影响。Kishi等[7]认为1岁以内患儿其痣细胞浸润程度较浅,密度低,色素沉积少;随着年龄增长,痣细胞的浸润程度及密度均有增加,且色素沉积逐渐增多。因未收集到1岁以内患者标本,本次研究将患者以3岁为界分为两组,并未发现两组患者有明显病理差别,关于此问题需进一步探讨。Melan-A是一个18 Kd,由118个氨基酸组成的单域跨膜蛋白,由MLANA基因编码并位于染色体9p24.1。对正常人类细胞和组织的信使RNA分析表明,Melan-A是一种仅表达于皮肤黑色素细胞的黑色素细胞系抗原。免疫组化研究表明,Melan-A在所有的发育不良痣、交接痣、皮内痣、混合痣、Spitz痣、先天性痣以及淋巴结囊痣中均有表达。此外,Melan-A也表达于原发性和转移性黑色素瘤中[11]。本研究发现,Melan-A在GCMN病灶中亦呈阳性表达。S-100代表一组小的钙离子结合调节蛋白,参与细胞周期的进行、细胞分化及细胞骨架的相互作用。S-100表达于正常的黑色素细胞以及几乎所有良性、恶性的黑色素细胞中。S-100是首个用于诊断黑素瘤的标记物,在鉴别诊断中通常作为一个重要的组合加以应用[12]。本研究显示,所有GCMN标本S-100表达均呈阳性。HMB-45识别存在于前黑素小体小泡中的抗原,与正常的黑色素细胞或皮内痣不反应,但可与Spitz痣、交界痣或混合痣中的表皮内黑色素细胞反应,即处于增生状态的黑色素细胞均可阳性表达HMB-45[13]。本研究中,GCMN病灶仅部分痣细胞表达HMB-45,呈局灶阳性。PCNA(Proliferation Cell Nuclear Antigen)为增殖细胞核抗原,仅存在于正常增殖细胞及肿瘤细胞内,其量变与DNA合成一致,在细胞中的表达可作为评价细胞增殖状态的指标[14]。GCMN中痣细胞多数呈PCNA阳性,可见痣细胞呈高增殖状态。
文献报道,GCMN的来源存在3种假说:表皮黑色痣细胞来源,真皮前体细胞来源,以及循环前体细胞来源[15]。Zaal等[16]认为,先天性与后天性黑色素细胞痣都是由基底层分化的黑色素细胞快速增殖,继续留在基底层或向下迁移至真皮层所形成的。增殖的黑色素细胞向真皮深层扩散,甚至可达筋膜直至肌肉层。这种现象在先天性黑色素细胞痣中十分常见,而在后天性痣中极其少见。经过数年时间的发展,交界处的痣细胞慢慢消失,形成一未受痣细胞累及的正常胶原条带,即前文所述的“境界带”现象,这与本研究中观察到的现象相符。另一假说认为:痣细胞就是黑色素细胞,其进入真皮后增殖形成黑色素细胞痣细胞。痣细胞与黑色素细胞有着相同的形态、相同的细胞器和酶系统,唯一不同的是痣细胞在真皮缺少树突,随着深度增加黑素合成减少或停止。也有理论认为,痣细胞源于神经嵴细胞迁移途中定植于真皮等。卫星痣是散在发生于巨痣周围的小型痣,我们认为卫星痣可能由主痣的痣细胞迁移并定植形成。本研究共收集到4例有主痣及卫星痣的患者标本,选取2例典型病例进行分析发现,1例患者的主痣浸润深度及密度均大于卫星痣,另1例患者则相反。因此,有关GCMN的来源仍需进一步探究。
目前,临床治疗GCMN的方法有磨削法[17],CO2激光灼烧[18-20],化学剥脱[21],刮除术[22]和手术切除与重建[23]等。对于非手术治疗方法,化学剥脱后患者浅层真皮的痣细胞大范围减少,无巢状聚集成团,仅可见零星痣细胞存在,且有大面积胶原纤维增生性改变,而真皮深层的痣细胞并未受到明显影响。剥脱治疗区域色素性外观明显改善,局部稍隆起。可见化学剥脱治疗是一种强度大,杀伤面积广的治疗方法,对于短时间的外观改变具有显著功效,然而深层痣细胞未受到明显损伤,为不彻底的治疗,仍有复发风险。磨削治疗亦是一种非彻底的治疗方法,仅能去除真皮浅层的色素和部分痣细胞。Kishi等[7]报道了23例磨削治疗患者的随访情况,发现部分患者出现复发,认为如痣细胞累及毛囊,则在磨削治疗后仍会复发。对于激光治疗后的患者,真皮全层痣细胞密度均未受到显著影响,胶原纤维未见明显增生,仅真皮乳头层色素沉积消除。所以,激光治疗较为温和,对痣细胞无杀伤作用。可见各种非手术治疗方法各有其特点,但是均未达到根治目的,均为姑息治疗方法。
目前扩张器修复术仍是临床上最为彻底有效的方法,但是治疗周期长,费用高,并给患者带来极大痛苦。此外,对于累及体表面积过大的GCMN患者,无法采用扩张器修复术进行治疗。因此,对于GCMN的治疗,仍有待新的治疗方法,尤其是有效的非手术方法的出现。
[1]Heffel DF,Thalle r S.Congenit al melanosis:an update[J].J Craniofac Surg,2005,16(5):940-944.
[2]Sober AJ,Burstein JM.Precursors to skin cancer[J].Cancer, 1995,75(2 Suppl):645-650.
[3]Shah KN.The risk of melanoma and neurocutaneous melanosis associated with congenital melanocytic nevi[J].Semin Cutan Med Surg,2010,29(3):159-164.
[4]Leiter U,Garbe C.Epidemiology of melanoma and nonmelanoma skin cancer--the role of sunlight[J].Adv Exp Med Biol,2008, 624:89-103.
[5]Arneja JS,Gosain AK.Giant congenital melanocytic nevi[J]. Plast Reconstr Surg,2009,124(1 Suppl):1e-13e.
[6]Lawrence CM.Treatment options for giant congenital naevi[J]. Clin Exp Dermatol,2000,25(1):7-11.
[7]Kishi K,Matsuda N,Kubota Y,et al.Rapid,severe repigmentation of congenital melanocytic naevi after curettage and dermabrasion: histological features[J].Br J Dermatol,2007,156(6):1251-1257.
[8]Abbas O,Mahalingam M.The grenz zone[J].Am J Dermatopathol, 2013,35(1):83-91.
[9]Haupt HM,Stern JB.Pagetoid melanocytosis.Histologic features in benign and malignant lesions[J].Am J Surg Pathol,1995,19 (7):792-797.
[10]Lohmann CM,Iversen K,Jungbluth AA,et al.Expression of melanocyte differentiation antigens and ki-67 in nodal nevi and comparison of ki-67 expression with metastatic melanoma[J]. Am J Surg Pathol,2002,26(10):1351-1357.
[11]Ordonez NG.Value of melanocytic-associated immunohistochemical markers in the diagnosis of malignant melanoma:a review and update[J].Hum pathol,2014,45(2):191-205.
[12]Kucher C,Zhang PJ,Acs G,et al.Can Melan-A replace S-100 and HMB-45 in the evaluation of sentinel lymph nodes from patients with malignant melanoma[J]?Appl Immunohistochem Mol Morphol,2006,14(3):324-327.
[13]Gown AM,Vogel AM,Hoak D,et al.Monoclonal antibodies specific for melanocytic tumors distinguish subpopulations of melanocytes [J].Am J Pathol,1986,123(2):195-203.
[14]Moldovan GL,Pfander B,Jentsch S.PCNA,the maestro of the replication fork[J].Cell,2007,129(4):665-679.
[15]Grichnik JM,Ross AL,Schneider SL,et al.How,and from which cell sources,do nevi really develop[J]?Exp Dermatol,2014,23(5): 310-313.
[16]Zaal LH,Mooi WJ,Sillevis Smitt JH,et al.Classification of congenital melanocytic naevi and malignant transformation:a review of the literature[J].Br J Plast Surg,2004,57(8):707-719.
[17]Rompel R,Moser M,Petres J.Dermabrasion of congenital nevocellular nevi:experience in 215 patients[J].Dermatology, 1997,194(3):261-267.
[18]Csiffary A,Ruttner Z,Toth Z,et al.Oxytocin nerve fibers innervate beta-endorphin neurons in the arcuate nucleus of the rat hypothalamus[J].Neuroendocrinology,1992,56(3):429-435.
[19]Kay AR,Kenealy J,Mercer NS.Successful treatment of a giant congenital melanocytic naevus with the high energy pulsed CO2laser[J].Br J Plast Surg,1998,51(1):22-24.
[20]Horner BM,El-Muttardi NS,Mayou BJ.Treatment of congenital melanocytic naevi with CO2laser[J].Ann Plast Surg,2005,55(3): 276-280.
[21]Hopkins JD,Smith AW,Jackson IT.Adjunctive treatment of congenital pigmented nevi with phenol chemical peel[J].Plast reconstr surg,2000,105(1):1-11.
[22]De Raeve LE,Roseeuw DI.Curettage of giant congenital melanocytic nevi in neonates:a decade later[J].Arch Dermatol,2002,138(7): 943-947.
[23]Arneja JS,Gosain AK.Giant congenital melanocytic nevi[J]. Plast Reconstr Surg,2007,120(2):26e-40e.
Summary of Clinical and Pathology Characteristics of Giant Congenital Melanocytic Nevi
WU Min,XIE Feng,YU Qingxiong,LI Qingfeng.Department of Plastic and Reconstruction Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai,200011,China.Corresponding author:LI Qingfeng(E-mail:dr. liqingfeng@yahoo.com).
ObjectiveTo explore the clinical features,histopathologic manifestations and treatment methods of giant congenital melanocytic nevi(GCMN).MethodsThe clinic data of 20 GCMN patients were collected and analyzed.The biopsy specimens were obtained for HE,Masson and immunohistochemical(HMB-45,Melan-A,PCNA)staining and were observed under light microscopy.ResultsAll of these cases were sporadic cases and patients were all born with GCMN. The most common lesions were head and face,hindquarters cadres and arms.Typical lesions for GCMN were large-area lesions,with color of light brown to dark black,and covered with hairs(mostly black thick hair).Histologically,GCMN contained nevus cells within deep dermis and even in subcutaneous tissue.The phenomenon of“Grenz zone”and“pigment incontinence”could be observed in the superficial layer of dermis.For immunohistochemical staining,the expression of Melan-A and S-100 were positive in the nevus cells of GCMN,and HMB-45 was focal positive.Positive PCNA staining showed high proliferation state of nevus cells.In history observation after non-surgical treatment,a lot of nevus cells in the superficial layer of dermis were killed while deep nevus cells uninvolved after chemical peeling.After laser treatment,the dermal papilla layer pigmentation disappeared,so the pigment appearance could be partly improved.ConclusionNevus cells infiltrate deeper in GCMN.Nevus cells in GCMN and melanin cells homologous may have same ancestor and are in highly proliferation state.Chemical peeling treatment and laser therapy,which are regarded as superficial and conservative treatments,both have their unique characteristics.While all of them can only partly improve local appearance and failed to cure.In GCMN which involves large area of body,treatment is still difficult,and new strategies still need to be explored.
Congenital giant melanocytic nevi;Histopathology;Treatment
R739.5
A
1673-0364(2015)05-0305-05
10.3969/j.issn.1673-0364.2015.05.005
2015年9月10日;
2015年9月29日)
200011上海市上海交通大学医学院附属第九人民医院整复外科。
李青峰(E-mail:dr.liqingfeng@yahoo.com)。
