悬滴培养法维持瘢痕疙瘩成纤维细胞表面标志CD105的表达及其功能
2015-11-28曹蕊肖苒傅歆严笠
曹 蕊 肖 苒 傅 歆 严 笠
悬滴培养法维持瘢痕疙瘩成纤维细胞表面标志CD105的表达及其功能
曹 蕊 肖 苒 傅 歆 严 笠
目的探讨悬滴培养法对维持体外培养的瘢痕疙瘩成纤维细胞表面标志的作用,并初步研究CD105调节细胞功能的作用。方法以耳部瘢痕疙瘩标本3例培养成纤维细胞,将第5代细胞分别常规贴壁培养和悬滴培养1周,对同一患者来源常规培养的第4代(P4)、第5代(P5)以及悬滴培养的第5代细胞(P5HD),采用多色流式细胞仪检测表面标志CD105、CD90、CD73和CD44的表达;并采用Real-time PCR的方法,检测上述表面标志,以及瘢痕疙瘩成纤维细胞相关功能基因CTGF、Col IA1和Col IA2的mRNA表达。结果流式检测显示CD105+和CD73+CD90+CD105+细胞比例在P4和P5HD组均高于P5组,统计学分析显示有显著性差异,但P4和P5HD组之间无差异;而CD73+、CD90+和CD44+各组细胞比例无差异。Real-time PCR结果显示,各组细胞CD105的mRNA表达与流式结果一致;且各组CTGF和Col IA1表达差异与CD105一致。结论悬滴培养法有助于维持体外瘢痕疙瘩成纤维细胞CD105,及其与纤维化和胶原合成相应功能基因的表达,从而保持细胞的生物学功能,但机制有待于进一步的研究。
瘢痕疙瘩成纤维细胞悬滴培养法白细胞分化抗原105
瘢痕疙瘩是皮肤创伤的病理性愈合,具有肿瘤浸润性生长的特性,病程迁延不愈,复发率达50%~ 80%,临床尚无一种安全有效的治疗方法[1]。其发生机制仍不清楚,研究表明,成纤维细胞是其最重要的致病功能细胞,可持续增殖产生过量的细胞外基质,使得纤维化不断向周边扩散。而瘢痕疙瘩来源的成纤维样细胞中包含了间充质样干细胞,可能是其致病机制之一[2]。同时,体外实验中观察发现,瘢痕疙瘩成纤维细胞与正常细胞的差异与细胞对生长环境的反应相关,不同培养基和接种密度可以影响细胞的基因表达,提示培养条件对细胞行为的关键作用[3]。因此,在瘢痕疙瘩的研究中,为了防止长期体外培养引起细胞的改变,获得可靠的研究数据,一般采用培养5代以内的细胞进行研究。
悬滴培养法是常用于诱导胚胎干细胞形成拟胚体的一种培养方法,由液体悬滴形成的圆形底部有利于细胞在重力作用下发生聚集,形成细胞小球,为拟胚体的形成提供良好的环境。近年来,将其用于骨髓干细胞、脂肪干细胞和毛乳头细胞等多种细胞的体外培养和诱导分化,发现该方法有利于细胞更好地保持其表型以及定向分化[4-6]。但悬滴培养法在瘢痕疙瘩成纤维细胞培养中的应用,及其对细胞表型和功能的影响,尚未见文献报道。
本研究将悬滴培养应用于瘢痕疙瘩成纤维细胞的培养,并检测了该方法对细胞表面干细胞标志及其相关功能基因表达的影响,尝试在体外构建能长久保持细胞原有表型和生物学功能的培养环境,便于瘢痕疙瘩致病机制的研究。
1 材料和方法
1.1 组织和细胞标本
本实验采用3例瘢痕疙瘩组织,均取自我院行手术治疗的耳部瘢痕疙瘩患者,年龄分别为19、21和24岁,其中1例为手术后复发患者。采用组织贴壁法进行上述标本的原代成纤维细胞培养,培养基为含10%胎牛血清和双抗的DMEM,置于37℃、5% CO2培养箱内,每3天更换培养基,细胞采用0.25%胰酶消化以1∶4进行传代。
1.2 试剂和仪器
细胞培养常规采用DMEM高糖培养基(Hyclone公司,USA),加入10%胎牛血清(Gibco公司,USA)、青-链霉素(Hyclone公司,USA)100 u/ml、0.25%胰酶(Sigma公司,USA);悬滴培养基配方包含DMEM∶F12(Ham)=1∶1(Gibco公司,USA),20% KnockoutTMSR血清替代物(Gibco公司,USA),1% Gluta-Max supplement,10 μM β巯基乙醇,1%非必需氨基酸,40 ng/mL bFGF;人间充质干细胞表面标志多色流式检测试剂Human MSC Analysis Kit(BD公司,USA)。M-MLV Reverse Transcriptase(Invitrogen,USA);Fast Sta rt Universal SYBR Green Realtime PCR Master Mix试剂盒(Roche公司,Switzerland)。
流式细胞仪为BD AriaⅡ(BD公司,USA),实时荧光定量PCR仪为Roche 480(Roche公司,SWISS)。
1.3 悬滴培养方法
将上述培养的第4代细胞以0.25%胰酶消化、计数后,以含10%胎牛血清的DMEM中和胰酶作用,离心、去上清,以悬滴培养基重悬细胞,使其浓度为150 cells/μL,以每滴20 μL接种到100 mm培养皿的盖子上(图1a),并小心翻转盖子扣到培养皿上,使液滴倒悬,在37℃、5%CO2培养箱中培养2 d后,采用常规培养基将含有细胞团的液滴冲洗到培养皿中,继续培养1周后进行相应的检测。
1.4 流式细胞仪检测细胞表面标志
同一患者来源的普通培养基贴壁培养的第4代(P4)、第5代(P5),以及第5代悬滴培养的细胞(P5HD),采用胰酶消化、中和、离心、去上清,以PBS清洗、离心,加入100 μL流式分析缓冲液重悬细胞,每管按Human MSC Analysis Kit说明书加入相应体积的直标抗体,并设置相应的同型对照和阳性对照管,冰浴30 min,清洗后离心,以0.5 mL流式分析缓冲液重悬细胞,上机进行多色流式检测。
1.5 RNA提取
同一患者来源的普通培养基贴壁培养的P4、P5和P5HD,加入Trizol,按试剂说明提取总RNA,用紫外分光光度仪检测总RNA在A260和A280的吸光度,进行RNA浓度和纯度的测定。
1.6 cDNA制备
采用M-MLV Reverse Transcriptase合成cDNA第一链,以oligo-p(dt)15为引物,总反应体系20 μl,模板RNA为1 μg。
1.7 Real-time PCR
采用Fast Start Universal SYBR Green Realtime PCR Master Mix试剂盒进行实时PCR,反应体系包含1 μL cDNA,SYBR Green Master 10 μL,引物浓度为0.4 μM,总反应体系20 μL(表1)。反应条件:预变性95℃,2 min;变性94℃,10 sec,60℃,10 sec,72℃,20 sec,45个循环。以GAPDH基因为内参基因,采用Roche 480 PCR仪的分析软件,分析各基因表达的相对定量,获得各样本中靶基因mRNA的相对含量。在每一个PCR反应的终点,建立热变性曲线,并测量PCR产物的解链温度Tm,以验证反应的特异性。
1.8 统计学方法
采用SPSS(Version 17.0)软件,Oneway-ANOVA检验对检测结果进行统计学分析,P<0.05为有显著性差异。数据以x±s表示。
2 结果
2.1 悬滴培养观察
细胞于接种第2天在培养皿盖子的液滴底部聚集成小的细胞球(图1a),在进入培养皿常规培养后,细胞球可贴附到皿底部,并以其为中心向周围呈放射状生长,类似组织贴壁法培养的瘢痕疙瘩原代细胞的生长方式(图1b、1c)。
2.2 细胞表面标志流式检测
在P4、P5和P5HD组细胞中CD73+细胞分别占(99.433 3%±0.230 9%),(99.833 3%±0.115 5%)和(99.900 0%±0.000 0%);CD90+细胞分别占(99.833 3%± 0.115 5%),(99.066 7%±1.274 1%)和(99.666 7%± 0.305 5%);CD44+细胞分别占(99.033 3%±0.378 6%),(98.766 7%±0.611 0%)和(99.433 3%±0.305 5%),上述三种标志的阳性细胞比例,各组间无显著性差异(P>0.05)(图2 a)。
CD105+细胞在P4、P5和P5HD组分别占(92.3%±9.245 5%),(75%±3.026 6%)和(95.2%± 7.196 6%),差异显著(P<0.05);其中P4、P5组之间,P5和P5D组之间均有显著差异(P<0.05),但P4、P5HD组间无显著性差异(P>0.05)(图2 a)。
对CD73、CD90、CD105进行三色分析,发现CD73+CD90+CD105+细胞在P4、P5和P5HD组分别为(91.4%±12.113 2%),(57.3%±15.247 3%)和(92.833 3%±8.403 8%),有显著性差异(P<0.05);其中P4、P5组间,P5和P5HD组间差异显著(P<0.05),但P4和P5HD组间无显著性差异(P>0.05)(图2b、2c)。
2.3 Real-time PCR检测
检测3个患者瘢痕疙瘩成纤维样细胞不同处理组的CD73、CD90、CD105、CD44,及CTGF、ColⅠA1、ColⅠA2的mRNA表达,结果示,P4、P5和P5HD组CD73表达分别为(0.103 0±0.041 6)、(0.135 8± 0.087 5)和(0.147 3±0.024 1)(图3a);CD90表达分别为(0.326 4±0.055 4)、(0.248 3±0.115 9)和(0.505 2±0.177 1)(图3b);各组间无显著性差异(P>0.05)。
各组CD105表达分别为(1.104 1±0.438 9)、(0.163 6±0.057 8)和(0.826 1±0.151 1),差异显著(P<0.05);其中P4、P5组间,P5和P5HD组间差异显著(P<0.05),但P4和P5HD组间无显著性差异(P>0.05)(图3c);各组CD44表达分别为(0.162 3±0.018 8)、(0.230 7±0.075 4)和(0.437 0±0.137 2)(图3d),有显著性差异(P<0.05),其中P4、P5组P>0.05,但P5和P5HD组P<0.05,P4和P5HD组P<0.05。
各组CTGF表达分别为(0.509 5±0.212 9)、(0.128 0±0.009 0)和(0.382 8±0.004 5),有显著性差异(P<0.05)。其中P4、P5组,P5和P5HD组P<0.05;但P4和P5HD组间无差异(P>0.05)(图4a);各组ColⅠA1表达分别为(1.403 0±0.525 5)、(0.603 3±0.040 8)和(1.370 0±0.062 5),有显著性差异(P<0.05)。其中P4、P5组,P5和P5HD组间P<0.05;但P4和P5HD组间无差异(P>0.05)(图4b);各组ColⅠA2表达分别为(0.937 3±0.526 2)、(0.352 7±0.058 3)和(0.896 0±0.438 8),无显著性差异(P>0.05)(图4c)。

表1 引物序列Table 1Primer sequences
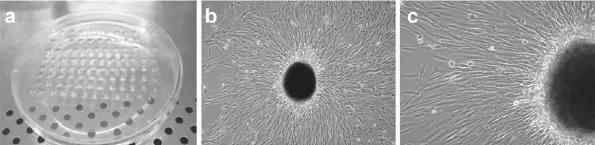
图1 悬滴法培养瘢痕疙瘩成纤维细胞Fig.1Graphic of keloid fibroblasts using hanging-drop culture method
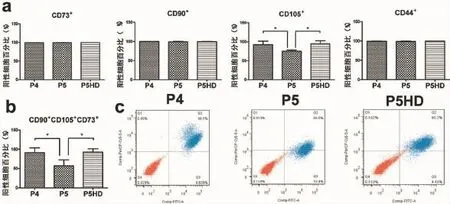
图2 流式细胞仪检测各组瘢痕疙瘩成纤维细胞表面间充质干细胞标志表达Fig.2Expressions of mesenchymal stem cell surface markers in keloid fibroblasts of each group by flow cytometry
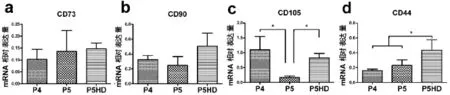
图3 荧光定量PCR检测各组瘢痕疙瘩成纤维细胞表面标志基因表达Fig.3Expressions of mesenchymal stem cell surface markers in keloid fibroblasts of each group by Real-time PCR
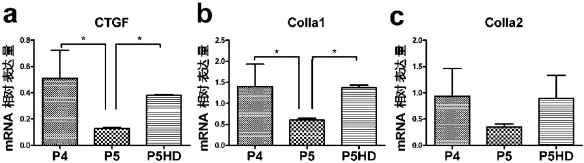
图4 荧光定量PCR检测各组瘢痕疙瘩成纤维细胞相关功能基因表达Fig.4Expressions of related functional genes in keloid fibroblasts of each group by Real-time PCR
3 讨论
在创伤愈合过程中,真皮成纤维细胞负责细胞外基质的产生和重塑,是这一过程中最主要的功能细胞,既往研究已证实瘢痕疙瘩成纤维细胞在基因表达、细胞增殖和凋亡、细胞外基质的产生等诸多方面存在异常。但是,在体外培养下,如何保持细胞的表型及其相应的生物学特性,一直是困扰人们的问题。瘢痕疙瘩来源的成纤维样细胞中包含了间充质样干细胞,与骨髓基质干细胞类似,可以表达CD73、CD90、CD105、CD44等间充质干细胞的标志[7],具有多向分化能力[6]。以专用于分析人间充质干细胞的流式试剂盒检测瘢痕疙瘩成纤维样细胞,发现在第1代细胞中的CD34-、CD73+、CD90+、CD105+的间充质干细胞可达16%[8]。本研究发现,在常规的培养基和普通贴壁培养条件下,瘢痕疙瘩成纤维细胞在培养到第5代时,其CD105+细胞的比例及其mRNA表达均比第4代细胞明显下降,其他标志CD44、CD73、CD90则无明显改变,这一表型变化与之前报道的正常人皮肤成纤维的CD105从原代93.42%到第6代84.33%的变化趋势一致[9]。因此,本研究结果提示,随着体外培养时间的延长,来自瘢痕疙瘩的成纤维细胞会逐渐丧失其某些表型。
近年来,悬滴培养法被用于多种细胞的体外培养和诱导分化,与普通的二维贴壁培养法相比较,该方法有利于骨髓干细胞向肝细胞分化,以及脂肪干细胞成骨分化,并能使毛乳头细胞更好地保持其表型[10]。分析认为,在细胞相互聚集成球状结构的三维立体环境中,细胞间的广泛接触有助于保持其表型稳定,并能更好地维持其分化成熟后的各种功能[3-5]。
我们采用悬滴培养法对第5代细胞培养1周,发现其CD105+细胞比例及其mRNA表达,与第4代细胞无明显差异,但比第5代普通培养细胞明显增加,提示该方法有助于瘢痕疙瘩成纤维细胞在体外维持CD105的表达。
CD105是细胞表面的跨膜同源二聚体蛋白,属于TβRⅢ,是TGF-β信号通路的辅助受体,在血管内皮细胞和造血细胞中高表达,也是骨髓、脂肪和皮肤来源的多种基质干细胞的表面标志之一[11]。CD105的表达可随细胞分化状态而改变,例如人脂肪干细胞在未分化时表达CD73和CD105,在成脂诱导分化后,CD73仍可维持,而CD105表达抑制[12]。
CD105是血管形成的关键介质,在多种肿瘤的血管内皮细胞中高表达,与恶性肿瘤的转移和复发有关[13]。在针对肾、肝纤维化和硬皮病的研究中发现,患者的组织、成纤维细胞和血浆中CD105高表达,并可通过激活ALK1/Smad1作用于促纤维化的TGF-β信号通路。在硬皮病的成纤维细胞中,ALK1/ Smad1途径的活化可以导致促纤维化的CTGF和胶原基因的表达[14]。因此,我们利用Real-time PCR检测了CD105导致纤维化疾病的相关功能基因CTGF和Ⅰ型胶原亚基(ColⅠA1和ColⅠA2)mRNA的表达,证实随CD105的表达下调,第5代常规培养的成纤维细胞CTGF和ColIA1的表达下降,但第5代悬滴法培养的细胞与第4代常规培养的细胞相比,CTGF和Ⅰ型胶原基因的mRNA表达无明显改变。提示悬滴法在维持瘢痕疙瘩成纤维细胞表型的同时,也可以维持其相应的功能基因的表达,有助于保持细胞的生物学功能。此外,CD105有可能通过调节胶原合成相关的基因而发挥其致病作用,但作用机制有待进一步研究。
[1]郭雷洋,曹莫.瘢痕疙瘩发病机制的研究进展[J].中国美容医学, 2012,21(9):1674-1677.
[2]Moon JH,Kwak SS,Park G,et al.Isolation and characterization of multipotent humankeloid-derived mesenchymal-like stem cells[J].Stem Cells Dev,2008,17(4):713-724.
[3]McFarland KL,Glaser K,Hahn JM,et al.Culture medium and cell density impact gene expression in normal skin and abnormal scar-derived fibroblasts[J].J Burn Care Res,2011,32(4):498-508.
[4]Wang X,Yang P.In vitro Differentiation of mouse embryonic stem(mES)cells using the hanging drop method[J].J Vis Exp, 2008,23(17):825.
[5]张齐好,郑炜炜,高丽莲,等.悬滴培养诱导大鼠骨髓间充质干细胞分化为肝样细胞[J].中国病理生理杂志,2010,26(11):2207-2211. [6]杨静,张琪.悬滴培养对人脂肪间充质干细胞成骨分化的影响[J].解放军医学杂志,2012,37(6):602-605.
[7]Calloni R,Cordero EA,Henriques JA,et al.Reviewing and updating the major molecular markers for stem cells[J].Stem Cells Dev,2013,22(9):1455-1476.
[8]Iqbal SA,Sidgwick GP,Bayat A.Identification of fibrocytes from mesenchymal stem cellsin keloid tissue:a potential source of abnormal fibroblasts in keloid scarring[J].Arch Dermatol Res, 2012,304(8):665-671.
[9]Lorenz K,Sicker M,Schmelzer E,et al.Multilineage differentiation potential of human dermal skin-derived fibroblasts[J].Exp Dermatol,2008,17(11):925-932.
[10]Higgins CA,Richardson GD,Ferdinando D,et al.Modelling the hair follicle dermal papilla using spheroid cell cultures[J].Exp Dermatol,2010,19(6):546-548.
[11]Al-Nbaheen M,Vishnubalaji R,Ali D,et al.Human stromal (mesenchymal)stem cells from bone marrow,adipose tissue and skin exhibit differences in molecular phenotype and differentiation potential[J].Stem Cell Rev,2013,9(1):32-43.
[12]Mohsen-Kanson T,Hafner AL,Wdziekonski B,et al.Expression of cell surface markers during self-renewal and differentiation of human adipose-derived stem cells[J].Biochem Biophys Res Commun,2013,430(3):871-875.
[13]Duff SE,Li C,Garland JM,et al.CD105 is important for angiogenesis:evidence and potential applications[J].FASEB J,2003, 17(9):984-992.
[14]Morris E,Chrobak I,Bujor A,et al.Endoglin promotes TGF-β/ Smad1 signaling in scleroderma fibroblasts[J].J Cell Physiol, 2011,226(12):3340-3348.
Maintenance of Cell Surface Marker CD105 and Its Function by Hanging-drop Culture Method
CAO Xin,XIAORan,FU Xin,YAN Li.
Plastic Surgery Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College, Beijing 100144,China.Corresponding author:YAN Li(E-mail:yanli@psh.pumc.edu.cn).
ObjectiveTo investigate the maintenance of cell surface markers of keloid fibroblasts by hanging-drop culture method,and to preliminarily study the role of CD105 in regulating function of cells.MethodsThe fibroblasts were isolated from 3 keloid samples of ears,and the passage 5 cells were cultured using the adherent culture and the hangingdrop culture method for 1 week respectively.The passage 4(P4)and 5 cells(P5)cultured by adherent culture method and the passage 5 cells cultured by hanging-drop culture method(P5HD)from the same patient were detected for the expression of cell surface markers including CD105,CD90,CD73 and CD44 by multicolor flow cytometry analysis.The mRNA expressions of surface markers and CTGF,Col IA1,Col IA2 were detected using real-time PCR.ResultsThe positive cell percent of CD105+and CD73+CD90+CD105+in P4 and P5HD group were significantly higher than in P5 group by flow cytometry analysis,but there was no difference between P4 and P5HD group.The positive cell percent of CD73+,CD90+and CD44+among three groups had no difference.The CD105 results of real-time PCR were in accordance with that of flow cytometry analysis.The mRNA expression tendency of CTGF and ColIA1 was similar to CD105.ConclusionThe hangingdrop culture method is helpful to maintain the expression of CD105 surface marker and functional genes related to fibrosis and collagen production,then to keep the biological function of keloid fibroblasts,but the underlying mechanism needs to be discovered.
Keloid;Fibroblasts;Hanging-drop culture;Cluster of differentiation 105
Q813.1+1
A
1673-0364(2015)04-0234-05
10.3969/j.issn.1673-0364.2015.04.004
2015年4月19日;
2015年5月28日)
国家自然科学基金(81171817)。
100144北京市中国医学科学院整形外科医院研究中心。
严笠(E-mail:yanli@psh.pumc.edu.cn)。
