SVF细胞影响移植脂肪LPL表达的实验研究
2015-11-28郑丹宁余力王健李鹏飞
樊 奇 郑丹宁 余力王 健李鹏飞
SVF细胞影响移植脂肪LPL表达的实验研究
樊 奇 郑丹宁 余力王 健李鹏飞
目的探讨脂肪移植后脂蛋白脂肪酶(Lipoprotein lipase,LPL)在SVF(Stromal vascular fraction)辅助移植脂肪组织中的表达模式。方法本实验以新鲜分离的自体SVF细胞辅助移植的脂肪组织为实验组,以脂肪组织与等量生理盐水的混合物为对照组,随机在裸鼠背部两侧注射建立动物模型,对两组移植物进行脂周蛋白免疫组化染色分析、LPL免疫组化染色分析和LPL蛋白含量测定。结果LPL蛋白含量测定及LPL免疫组化染色分析显示,随着移植时间的延长,实验组和对照组LPL表达逐渐下降,在第2周、第3周、第4周时,实验组LPL表达明显高于对照组。脂周蛋白免疫组化染色分析显示,两组脂肪移植后的存活细胞均逐渐减少,但第2周、第3周、第4周实验组存活细胞数高于对照组。结论SVF促进脂肪组织表达LPL,表达差异在移植后的第2周开始出现,这可能与SVF提高脂肪组织存活率和ASCs(Adipose-derived stromal cells)成脂分化有关。
脂肪间充质干细胞脂肪移植脂蛋白脂肪酶脂周蛋白
自体脂肪移植行软组织充填时,90%的体积构成为脂肪细胞内的三酰甘油,最终体积取决于成活的脂肪细胞数量和三酰甘油含量。既往研究更多的是针对提高脂肪细胞的存活数量[1-4],对于提高三酰甘油含量(即生脂调控)缺乏针对性的措施。
本实验根据标准方法提取脂肪基质血管组分(SVFs),与人体脂肪混合移植于裸鼠,以添加生理盐水的脂肪组织移植为对照。通过比较脂蛋白脂肪酶(Lipoprotein lipase,LPL)的表达差异,探索SVF对于LPL表达的作用,以及可能的变化规律。
1 材料与方法
1.1 材料
4~6周龄雌性裸鼠8只(本院实验动物中心提供),体质量15.6~21.6 g(平均18.8 g)。
L-DMEM培养基、胎牛血清(HyClone公司);抗脂蛋白脂肪酶抗体(Abcam公司);脂周蛋白抗体(LSBio公司);山羊抗兔二抗、BCIP/NBT显色试剂盒(武汉博士德生物公司);0.2 μm PVDF膜(Millipore公司);Marker、Ⅰ型胶原蛋白酶(Sigma公司)、5×loding-buffer(Takara公司);EpiQuickTM全组蛋白抽提试剂盒(EpiQuick公司)。
1.2 实验方法
1.2.1 脂肪组织的获取
脂肪组织来源于一名健康成年女性,通过抽脂术获取皮下脂肪。在超净工作台内将抽取后的混合物以生理盐水洗涤3次,并静置分层。用10 m L注射器吸取10 m L脂肪颗粒置于无菌的三角烧瓶中;加入10 m L 0.075%Ⅰ型胶原酶,摇匀后置于37℃恒温摇床内50 min;后将混合物600 g,离心10 min,倒掉上层油脂及液体,用生理盐水将沉淀物悬浮,再次600 g,离心10 min。用移液器将上层液体吸出,剩余沉淀物即为基质血管成分(SVF)。将获得的SVF细胞与脂肪组织混合,得到10 mL富含SVF细胞的混合物。另外留取2 mL洗净沉淀的脂肪组织作为移植前的样品放置于液氮中备用。20 mL混合物600 r/min,离心10 min,取中间的脂肪层。将与上述SVF悬液等量的生理盐水与自体脂肪颗粒混合得到10 m L注射脂肪,作为对照组。
1.2.2 脂肪移植模型的建立
2%戊巴比妥钠50 mg/K g腹腔注射麻醉裸鼠,用注射器连接18号针头将1 m L SVF混合自体脂肪颗粒(实验组)与1 m L生理盐水自体脂肪颗粒混合物(对照组),按随机化原则分别注射于8只裸鼠背部的左侧或右侧,并标记。
1.2.3 脂肪移植物存活的评价
分别在移植1周、2周、3周、4周后取材,大体观察移植物的形态,有无感染、坏死等现象。部分脂肪用于Western Blot检测,迅速保存于液氮中,部分置于4%多聚甲醛中固定,浸蜡、包埋、切片,用于HE染色与免疫组化。
1.2.4 LPL表达的W estern blot检测
对所取得组织蛋白进行蛋白初定量。配置分离胶和浓缩胶。向泳道中注入蛋白样本,然后电泳分离蛋白。将胶放于负极,转膜装置浸没在转膜缓冲液中,4℃转膜。将转膜制得的承载膜置于5%BSA中封闭,脂蛋白脂肪酶和内参抗体过夜后加萤光二抗。TBST清洗后扫描仪扫描并截图分析。得到去除背景的灰度图像,计算目的条带的阴影。
1.2.5 HE染色
标本用4%多聚甲醛固定,梯度乙醇和二甲苯脱水,石蜡包埋,切片(5 μm厚),HE染色,镜下观察。
1.2.6 LPL免疫组织化学染色
石蜡切片常规脱水至水化,PBS冲洗5 min,3次,3%过氧化氢封闭10 min,高温修复抗原(沸水浴30 min),自然凉至室温,PBS冲洗5 min,3次,正常山羊血清37℃封闭30 min,一抗孵育(1∶200),4℃过夜;滴加生物素标记的二抗(羊抗兔IgG),37℃20 min,辣根酶标记的链酶亲和素(三抗),37℃30 min,DAB显色,苏木精复染,脱水透明后中性树胶封片,以PBS代替一抗作为阴性对照,光镜下观察。
1.2.7 脂周蛋白免疫组织化学染色
石蜡切片常规脱水至水化,PBS冲洗5 min,3次,3%过氧化氢封闭10 min,高温修复抗原(沸水浴30 min),自然凉至室温,PBS冲洗5 min,3次,正常山羊血清37℃封闭30 min,一抗孵育(1∶200),4℃过夜,滴加生物素标记的二抗(兔抗羊IgG),37℃20 min,滴加AP,30 min后生理盐水洗3次,碱性磷酸酶染色剂染30 min左右,自来水冲洗10~15 min,脱水、透明、封片、镜检。深蓝色为阳性结果。
1.2.8 统计处理
采用SAS统计软件进行统计分析,计量资料中正态分布数据用x±s表示,两组数据之间的比较采用两独立样本t检验。非正态分布数据采用中位数,上四分位数~下四分位数(M,P25~P75)表示,P<0.05认为有统计学差异。
2 实验结果
2.1 大体标本观察
植入后1周,可见实验组与对照组脂肪团块都有血管长入。随着时间的延长,两组脂肪移植物,尤其是对照组,体积逐渐变小,移植物表面油滴增多。植入后2周,可见脂肪组织外侧出现纤维囊包裹;随着时间延长,脂肪组织外侧纤维囊逐渐增厚。
2.2 LPL的Westen Blot结果
实验组LPL在1周、2周、3周和4周相对表达水平为(1.64±0.12)、(1.53±0.13)、(1.21±0.21)和(1.12±0.18);对照组LPL为(1.59±0.14)、(0.65±0.14)、(0.52±0.13)和(0.47±0.13)。提示1周时两组无显著差异,2周、3周和4周两组差异显著(图1)。
2.3 LPL免疫组化染色结果
光镜下观察,存活的脂肪细胞、纤维结缔组织中的血管内皮细胞和前体脂肪细胞可表达LPL。在移植前可见脂肪组织完整,脂蛋白脂肪酶阳性细胞存在(图2)。第1周,实验组和对照组镜下无明显差异;第2周,实验组和对照组LPL表达增加,且实验组显著高于对照组;第3周,镜下可见实验组和对照组纤维结缔组织增生明显,对照组纤维化高于实验组,实验组表达LPL的细胞密度高于对照组;第4周,两组纤维化更加明显,实验组表达LPL的细胞密度高于对照组,但是总体两组都呈下降趋势(图3)。
2.4 脂周蛋白免疫组化染色结果
光镜下可见存活脂肪细胞脂滴周边区域阳性表达,为圆环状。移植前,脂周蛋白在脂肪细胞上呈强阳性环形表达(图4)。移植后1周,两组无明显差异;移植后2周,可见脂肪细胞脂滴周围脂周蛋白表达下降,表达区域界限模糊,对照组脂周蛋白表达的下降幅度比实验组更加明显,细胞间隙比对照组更宽;移植后3周,可见实验组和对照组都呈缺血性坏死,实验组存活细胞数量高于对照组;移植后4周,可见间质组织增生,前体脂肪细胞散布其中;移植后4周,两组存活的脂肪细胞数量下降,前体脂肪细胞增加,实验组的前体细胞数量大于对照组(图5)。
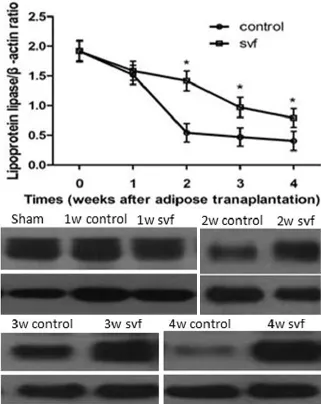
图1 移植早期脂蛋白脂肪酶W estern blot变化趋势Fig.1 The trends of LPL exp ression in the early stage after adipose transp lantation by W estern blot

图2 移植前LPL免疫组化Fig.2 The results of LPL immunohistochem istry beforeadipose transp lantation
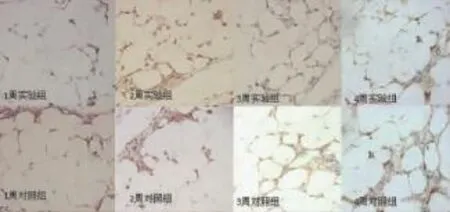
图3 移植后早期LPL免疫组化Fig.3 The results of LPL immunohistochem istry in the early stage after adipose transplantation
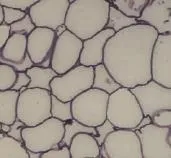
图4 移植前脂周蛋白免疫组化Fig.4 The results of perilipin immunohistochem istry before adipose transp lantation
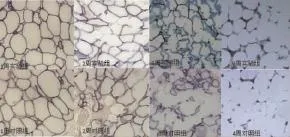
图5 移植后早期脂周蛋白免疫组化Fig.5 The results of perilipin imm unohistochem istry in the early stage after adipose transp lantation
3 讨论
脂肪注射已广泛应用于美容及整复手术。但是脂肪移植物具有较高的吸收率和较低的存活率,移植时仍需矫枉过正或重复注射,以达到满意的效果。
目前,脂肪组织的获得、提取和保存等都有了相应的经验标准。实验证明,血供是脂肪存活的重要因素[5-7]。Yoshimura等[4]利用SVF辅助脂肪移植以改善脂肪移植效果,引起广泛关注。用胶原酶处理脂肪组织,可得到大量的SVF细胞,SVF细胞经离心、培养可获得ASCs。通过自体培养可得到大量ASCs,但是培养技术复杂,培养周期长,污染风险性大,而且需要一期获取ASCs,二期获得脂肪,将两者混合植入。而SVF细胞可一期实现移植,具有更高的安全性[4,8]。鉴于SVF更为广泛的临床应用范围,我们认为针对SVF辅助移植的研究更具有现实意义,而且SVFs辅助移植与ASCs辅助移植具有共同的效果。
LPL是脂质代谢中最重要的酶之一[9],主要由脂肪和肌肉细胞合成后分泌至细胞外,并进一步转运至邻近毛细血管内皮表面的硫酸类肝素上,锚定于此处发挥生理功能。通过一系列生理作用,外源性甘油三酯转化为自由脂肪酸,进入脂肪细胞中,再发生一系列变化,成为脂肪细胞本身的甘油三酯。脂蛋白脂肪酶发挥作用使得机体各种组织能够利用来自食物摄取和肝脏合成的脂肪。但是各组织的脂蛋白脂肪酶对机体脂质代谢的作用各不相同。目前普遍认同的是白色脂肪组织(WAT)中的LPL活性升高有助于机体脂质的贮存,棕色脂肪组织(BAT)的LPL则与机体产热有关,而骨骼肌的LPL活性升高有利于机体利用能量。LPL在脂肪组织(AT)中的活性及其在肌肉组织内的相对活性决定了脂肪是用于贮存或是供能。而与脂肪移植密切相关的是白色脂肪。LPL在人体内分泌代谢研究中是重要的研究对象,但涉及该关键酶含量和活性变化的报道却较少。Hudson等[10]通过比较人体不同部位脂肪组织LPL的活性和脂肪细胞大小来确定较好的脂肪供区,认为大腿部的脂肪组织最适合于脂肪移植。Yost等[11]比较抽脂术前后人体血清中LPL的表达和活性,认为抽脂术后3个月内人体血清中LPL表达升高,与体重降低后的代偿相关。此外,未发现其他相关报道。
在脂肪组织中表达LPL的细胞包括成熟脂肪细胞,前体脂肪细胞和血管内皮细胞。本研究结果显示,SVF可提高脂肪组织的LPL表达,并且移植后2周开始,对照组和实验组呈现差异性变化,究其原因,应当结合ASCs在脂肪存活中的分化机制来探讨。ASCs在脂肪存活中具有如下作用:①ASCs可分化为血管内皮细胞,加速脂肪移植物的血管化和再成活[12-13]。新鲜分离的自体SVFs或培养的自体ASCs均参与脂肪移植物的血管化进程。而ASCs在脂肪移植物的血管化进程中的作用一般在移植1周左右开始显现,血管密度的增加提高了脂肪细胞的存活率[14],从而提高了LPL表达阳性细胞的存活率。②ASCs可分化成脂肪细胞,成为脂肪移植物的组成部分。ASCs与脂肪细胞体外联合培养有利于ASCs向脂肪细胞的分化[15-16],1~2周内,LPL mRNA开始表达升高并可持续于整个诱导过程,而非成脂诱导干细胞的LPL表达则可忽略不计。本实验第2周开始,实验组LPL阳性细胞数量明显升高,可能与SVF提高脂肪组织中脂肪前体细胞数量有关,前体细胞血管密度增加后,在有较充分氧气和营养的情况下需要大量贮存甘油三酯而使得LPL含量大幅增加。
组织学和Western blot检测可以看出,尽管SVF可提高早期LPL表达,但比起移植前脂肪组织,LPL表达仍是下降的。由此可见,尽管SVF可以提高细胞生存率,提高LPL表达,但无法改变移植早期在缺血缺氧的条件下脂肪细胞大量坏死的趋势。
总之,SVF可提高脂肪细胞远期存活率,促进LPL表达和细胞成脂,提高脂肪移植效果。今后我们将继续研究相关机制和SVF的作用方式,进一步探索促进脂肪组织LPL表达及促进脂肪细胞成脂的方法,为改进脂肪移植效果提供新的策略。
[1]Gomillion CT,Burg KJL.Stem cell and adipose tissue engineering [J].Biomaterials,2006,27(36):6052-6033.
[2]Del Vecchio DA.Grading lipoaspirate:is there an optimal density for fat grafting[J].Plast Reconstr Surg,2013,131(4):637e-639e.
[3]Gonzalez AM,Lobocki C,Kelly CP,et al.Analternative method for harvest and processing fat grafts:an in vitro study of cell viability and survival[J].Plast Reconstr Surg,2007,120(1):285-294.
[4]Yoshimura K,Sato K,Aoi N,et al.Cell-assisted lipotransfer for cosmetic breast augmentation:supportive use of adipose-derived stem/stromal cells[J].Aesthetic Plast Surg,2008,32(1):48-55.
[5]聂云飞,李小林,巫国辉.骨骼重建与自体脂肪移植在面部整形中的应用[J].中国组织工程研究,2012,16(28):5264-5267.
[6]Saunders MC,Keller JT,Dunsker SB,et al.Survival of autologous fat grafts in humans and in mice[J].Connect Tissue Res,1981,8 (2):85-91.
[7]Ellenbogen R.Free autogenous pearl fat grafts in the face-A preliminary report of a rediscovered technique[J].Ann Plast Surg,1986,16(3):179-194.
[8]Lin YF,Jing W,Wu L,et al.Identification of osteo-adipo progenitor cells in fat tissue[J].Cell Prolif,2008,41(5):803-812.
[9]Hosseini M,Ehrhardt N,Weissglas-Volkov D,et al.Transgenic expression and genetic variation of LMF1 affect LPL activity in mice and humans[J].Arterioscler Thromb Vasc Biol,2012,32(5): 1204-1210.
[10]Hudson DA,Lambert EV,Bloch CE.Site selection for fat autotransp lantation:Some observations[J].Aesthetic Plast Surg,1990, 14(3):195-197.
[11]Yost TJ,Rodgers CM,Eckel RH.Suction lipectomy:Outcome relates to region-specific lipoprotein lipase activity and interval weight change[J].Plast Reconstr Surg,1993,92(6):1101-1108.
[12]付冰川,高建华,鲁峰,等.新鲜分离的脂肪SVF细胞促进脂肪移植存活的实验研究[J].中华整形外科杂志,2010,26(4):289-294.
[13]Chang L,Wang J,Zheng D,et al.Improvement of the survival of autologous free-fat transplants in rats using vascular endothelial growth factor 165-transfected bone mesenchymal stem cells[J]. Ann Plast Surg,2014,72(3):355-362.
[14]Planat-Benard V,Silvestre JS,Cousin B,et al.Plasticity of human adipose lineage cells toward endothelial cells:physiological and therapeutic perspectives[J].Circulation,2004,109(5):656-663.
[15]Considine RV,Nyce MR,Morales LM,et al.Paracrine stimulation of preadipocyte-enriched cell culture by mature adipocytes[J]. Am J Physiol,1996,270(5 Pt 1):E895-E899.
[16]Yoshimura K,Shigeura T,Matsumoto D,et al.Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates[J].J Cell Physiol,2006,208(1): 64-76.
Effect of SVF Cells on the LPL Expression after Fat Transp lantation
FAN Qi,ZHENG Danning,YU Li,WANG Jian, LI Pengfei.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:ZHENG Danning(E-mail:zhengdan218@hotmail.com).
Objective To explore the effect of adipose stromal vascular fraction(SVF)cells on the LPL expression after fat transplantation.M ethods Freshly isolated SVFs(experimental group)were mixed with adipose tissue and then injected under the back skin of nudes random ly on one side.In the same manner,the mixture of physiological saline and adipose tissue(control group)were injected on the other side.Immunohistochem istry for perilipin,immunohistochem istry for LPL and western blot for LPL were combined to explore the trends of LPL expression at 1,2,3 and 4 weeks.Results According to the results of western blot and immunohistology of LPL,the levels of LPL started to decrease as early as the transplantation in both groups.And the expression of LPL in the experimental group was higher than the control group at 2,3 and 4 weeks after implantation.Immunohistology of perilipin indicated no remarkable changes in the viable adipocyte zone during the first week.The adipose cells decreased day to day in both group.And 2,3 and 4 weeks after implantation there were more survived adipose cell in the experimental group.Conclusion SVF can improve the expression of LPL in transplanted adipose tissue.It begins to make effects at the second week post-implantation.It may be related to its effect on the adipose cell survival and the adipogenic differentiation of ASCs.
Adipose-derived stromal cells;Fat transplantation;Lipoprotein lipase;Perilipin
R622+.9
A
1673-0364(2015)03-0148-04
10.3969/j.issn.1673-0364.2015.03.008
2015年3月21日;
2015年5月6日)
200011上海市上海交通大学医学院附属第九人民医院整复外科。
郑丹宁(E-mail:zhengdan218@hotmail.com)。
