β-葡萄糖醛酸苷酶键选择性高效筛选体系的构建与应用
2015-11-26吕波冯旭东李春
吕波,冯旭东,李春
-葡萄糖醛酸苷酶键选择性高效筛选体系的构建与应用
吕波,冯旭东,李春
(北京理工大学生命学院生物工程系,北京 100081)
分子改造是提高-葡萄糖醛酸苷酶(PGUS-E)在生产单葡萄糖醛酸基甘草次酸(GAMG)过程中的键选择性的有效方法,但高通量筛选方法的缺失是限制其发展的重要瓶颈。为解决该问题,在大肠杆菌中构建了组成型表达-葡萄糖醛酸苷酶(PGUS-E),利用温度诱导表达噬菌体裂解酶SRRz实现原位裂解的一锅法(one-pot)甘草酸键选择性筛选体系(CELS);同时考察了启动子强度对PGUS-E外源表达的效果,优化了不同温度下裂解酶SRRz的表达对酶释放效率的影响。结果表明,CELS筛选体系成功实现了集培养、产酶、裂解和反应于一体化工艺,并将其应用于PGUS-E的非理性改造,获得了一系列键选择性显著提高的突变酶。研究证明,TIM 桶状结构域中螺旋结构的变化对甘草酸键选择性的改善有很大的影响。
-葡萄糖醛酸苷酶;生物催化;分子生物学;优化设计;键选择性
引 言
甘草酸(glycyrrhizin,GL)是甘草中最主要的有效活性成分之一,由五环三萜皂苷通过-1,2-糖苷键和-1,3-糖苷键与两分子葡萄糖醛酸相连构成,具有抗炎症[1]、抗病毒[2]、抗高血压[3]、抗衰老、增强机体免疫力、改善高血脂症和维持体内水盐代谢平衡等功效。单葡萄糖醛酸基甘草次酸(glycyrrhetinic acid monoglucuronide,GAMG)是甘草酸外侧的-1,2-糖苷键通过水解一分子的葡萄糖醛酸得到的产物,与甘草酸相比,其极性适中,甜度更高[4],具有更好的甜度药理活性和生物安全性[5-6],被广泛应用于食品[7]、化妆品[8]以及潜在的精细化工领域。
目前,GAMG的生产主要有化学法[9]和生物 法[10]两种。与化学法相比,生物法具有反应条件温和、对环境友好以及收率高等特点,符合环境和健康的可持续发展。生物法制备GAMG主要是利用微生物所产生的-葡萄糖醛酸苷酶(-glucuronidase,-GUS)水解甘草酸制备得到[11-13]。然而,目前酶法制备GAMG普遍存在发酵周期长、酶的产量低、生产成本高和键选择性低等问题[12]。本课题组通过基因克隆构建-葡萄糖醛酸苷酶的大肠杆菌[.BL21 (DE3)]异源表达体系[14],发现重组的-葡萄糖醛酸苷酶(PGUS-E)存在键选择性差的问题,不仅能够催化甘草酸生成GAMG,也能同步水解GAMG生成甘草次酸(GA),无法形成GAMG的大量积累,大大限制了酶法制备GAMG的工业化应用。
目前,蛋白工程的定向进化和理性设计的成功应用赋予酶分子功能的多样性[15],其主要步骤包括突变库的建立、突变体酶的表达和高通量筛选方法的建立。其中,能否建立一个高灵敏、高通量和易操作的高效筛选方法是蛋白成功改造的关键[16]。然而,并不是所有的分子改造都能建立相应的高通量筛选方法。同时,在突变酶的重组表达过程中涉及多步骤操作,如诱导剂的添加、离心、细胞破碎等,在大规模的筛选过程(>103)中无疑增加了筛选的工作量。利用基因工程技术和过程集成,对筛选的工艺进行一系列改进,可以减少筛选的工作量,提高筛选效率,为酶的工业化应用提供新的支持。
本文以大肠杆菌为宿主,以-葡萄糖醛酸苷酶(PGUS-E)为研究对象,建立了一种组成型表达-葡萄糖醛酸苷酶,温度诱导表达噬菌体裂解酶SRRZ实现原位裂解,集培养、产酶、裂解和反应于一体的一锅法(one-pot)甘草酸键选择性筛选体系(CELS)(图1),并将其成功运用于-葡萄糖醛酸苷酶的定向进化的筛选中,获得了一系列键选择性显著提高的突变酶,为分析蛋白质结构与功能的关系提供了理论依据。

图1 PGUS-E筛选工艺的改进
1 材料和方法
1.1 菌种和质粒
.DH5α(ΔuidA)由实验室构建并保存。重组大肠杆菌[.BL21(DE3)/pET-28a(+)-PGUS]由实验室前期构建。pUC19载体购自Takara公司,温度敏感型质粒pEAS-1a载体由清华大学的林章凛教授惠赠[17]。
1.2 培养基
LB 培养基(g·L-1):胰蛋白胨10,酵母提取物5,氯化钠10,琼脂粉15(固体培养基)和氨苄青霉素100 μg·ml-1。筛选培养基CPGYG: KH2PO43.0 g·L-1、Na2HPO47.0 g·L-1,(NH4)2SO43.0 g·L-1, 酪蛋白胨 30.0 g·L-1,谷氨酸钠5.0 g·L-1,酵母提取物5.0 g·L-1, 甘油50.0 g·L-1, MgSO41.0 g·L-1, 柠檬酸钠1.0 g·L-1,甘草酸 1 g·L-1,pH 6.8;于121℃下灭菌20 min备用。
1.3 主要试剂
PCR相关试剂如rTaq DNA聚合酶、 dNTP等购自Takara公司;PCR产物纯化、酶切产物纯化提取试剂盒购自北京百泰克生物有限公司,质粒提取试剂盒和核酸分子量标准(DNAMarker)购自北京博迈德科技发展有限公司;T4 DNA连接酶及限制性内切酶等购自Fermentas公司,氨苄青霉素等试剂购自北京鼎国生物工程公司,TransStart FastPfu DNA Polymerase购自北京金式金生物技术有限公司;本实验用到的引物由金唯智生物科技有限公司合成,测序工作也由金唯智公司完成。
1.4-葡萄糖醛酸苷酶突变体的表达和筛选
通过易错PCR方法构建突变体文库[18],采用96微孔板进行表达。将LB固体培养基平板上的单菌落转接到含有200 μl CPGY培养基(含100 μg·L-1Amp)的96孔板中,于30℃、170 r·min-1培养24 h。然后将96孔板转入40℃的摇床中,170 r·min-1,热诱导表达噬菌体裂解酶SRRz裂解细胞进行酶反应,反应时间为24 h。接着,筛选键选择性提高的-葡萄糖醛酸苷酶突变体,初筛通过薄层色谱(TLC)检测各体系中GL、GAMG和GA的含量,通过初筛的转化子利用HPLC进行复筛。
1.5-葡萄糖醛酸苷酶酶活测定方法
以甘草酸为底物测定-葡萄糖醛酸苷酶的 活力[19]。准确移取100 µl酶液到400 µl甘草酸 1 g·L-1缓冲溶液中,40℃反应 10 min,所得产物用甲醇按1:9的比例进行稀释,用高效液相色谱仪检测GL、GAMG和GA的含量,采用外标法对GL、GAMG和GA进行定量。检测仪器参数为:岛津LC-10A;色谱柱Shim-pack,VP-ODS(150×46);检测器SPD;检测波长254 nm;流动相甲醇:重蒸水(pH 2.85)81:19;进样量10 µl;流速1 ml· min-1;柱温箱40℃;工作站:LCsolution。每个-葡萄糖醛酸苷酶活力单位定义为在上述条件下每分钟消耗 1 nmol甘草酸所需要的酶量。
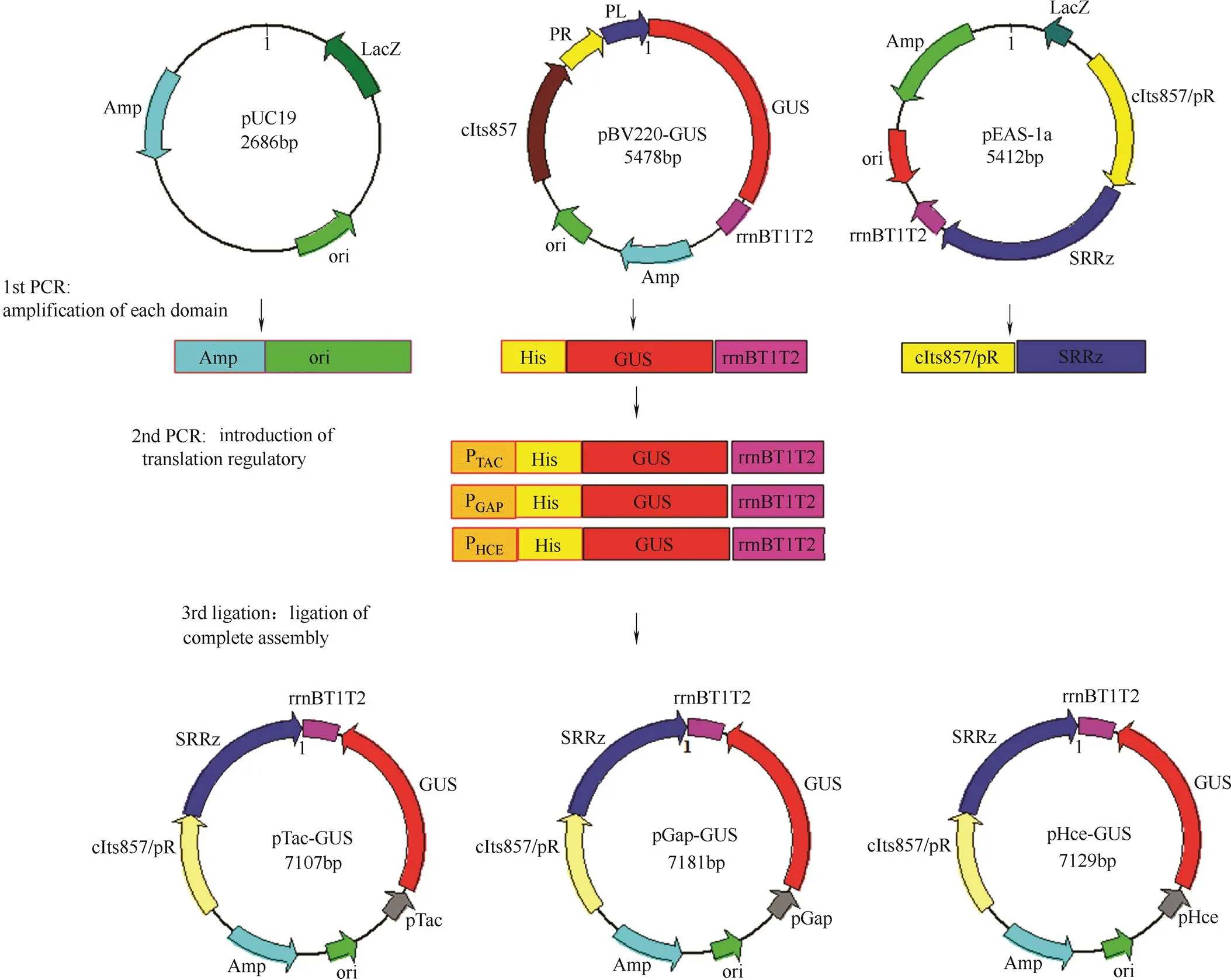
图2 PGUS-E筛选表达载体的构建
1.6-葡萄糖醛酸苷酶的底物特异性定义
在一定时间内,GL转化率>90%以上,产物GAMG在产物中的摩尔比定义为-葡萄糖醛酸苷酶的键选择性,具体计算公式如下[20]
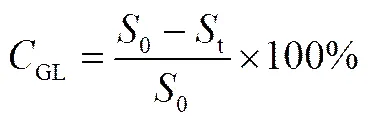
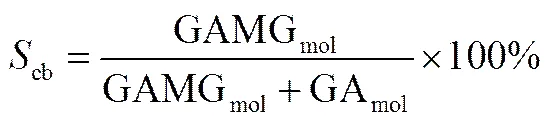
式中,0为甘草酸的初始浓度;t为甘草酸的剩余浓度;GL为甘草酸的转化率,%;GAMGmol为GAMG的浓度;GAmol为GA的浓度;cb为GAMG的键选择性,%。
2 结果与讨论
2.1 双功能质粒的构建
载体构建选用了氨苄抗性基因和pUC19的复制起始序列作为载体的基本骨架序列,用于原核生物.的阳性克隆筛选和扩增。载体主要包含3部分:原核生物抗性基因和复制起始位点序列、含有温度诱导的启动子cIts857/pR控制的噬菌体裂解基因SRRz和不同组成型启动子控制的GUS酶基因,各片段直接通过设计的酶切位点进行连接,具体的构建策略如图2所示。根据启动子的不同将构建的载体分别命名为pHce-GUS,pTac-GUS和pGap-GUS。载体中的各目的片段分别通过PCR方法获得,其中Amp-ori片段长度为2125 bp(Ⅰ/Ⅰ),cIts857/pR-SRRz片段长度为2579 bp (Ⅰ/Ⅰ),Hce-GUS-rrnB片段长度为2435 bp(Ⅰ/Ⅰ),Gap-GUS-rrnB片段长度为2487 bp(Ⅰ/Ⅰ),Tac-GUS-rrnB片段长度为2413 bp(Ⅰ/Ⅰ),通过将各自的片段进行胶回收、酶切过夜再回收,控制连接片段的摩尔比在16℃下定向连接过夜,热激转化到大肠杆菌.DH5α/ΔuidA感受态细胞中,在Amp抗性平板上 30℃培养过夜生长单菌落,通过菌落PCR进一步筛选阳性克隆,将获得阳性克隆送北京金唯智生物公司测序。
2.2 启动子对-葡萄糖醛酸苷酶表达的效果
大肠杆菌的启动子是控制外源基因转录的重要调控元件,在一定条件下,外源基因转录的启动效率取决于RNA聚合酶与启动子的作用强度。为了研究不同启动子强度对PGUS-E的组成型外源表达的影响,构建了3种不同启动子重组菌株,.DH5α(ΔuidA)/pHce-GUS,.DH5α(ΔuidA)/ pTac-GUS和.DH5α(ΔuidA)/pGap-GUS。SDS-PAGE蛋白电泳结果显示,不同启动子调控的重组菌在70×103处出现明显的条带,与理论的-葡萄糖醛酸苷酶的大小相符,说明Tac、Hce和Gap启动子成功地表达了-葡萄糖醛酸苷酶(图3)。同时,SDS-PAGE蛋白电泳图显示,.DH5α(ΔuidA)/pHce-GUS的蛋白表达量是最高的。比较不同来源启动子表达的-葡萄糖醛酸苷酶的酶活发现,来源于的pHce启动子控制的.DH5α(ΔuidA)/pHce-GUS的重组-葡萄糖醛酸苷酶的酶活最高(图4),达到17.2 U·ml-1,达到了诱导性表达pET-28a(+)-PGUS的70%左右,满足了后续高通量筛选的需要。
2.3 温度对噬菌体裂解酶裂解效率的影响
噬菌体裂解酶SRRz的表达受温度诱导的启动子cIts857/pR控制,随着温度的升高,阻遏蛋白cIts857 因热失活,并引起噬菌体裂解基因SRRz的表达,达到溶菌的效果。将构建成功的.DH5α(ΔuidA)/pHce-GUS接种后30℃过夜培养,以 1%接种量转接到300 ml(Amp浓度100 μg·L-1)CPGY培养基中,30℃培养24 h。根据-葡萄糖醛酸苷酶酶活测定方法,将含有.DH5α(ΔuidA)/ pHce-GUS的菌体分别在35~42℃之间的多个温度下反应,终止反应后测定酶活,考察在不同温度和不同时间下-葡萄糖醛酸苷酶酶活的变化,结果见图5。噬菌体裂解基因SRRz酶严格受到温度的调控,当温度低于37℃时,阻遏蛋白 cIts857抑制了pR的转录,当温度高于37℃时,阻遏蛋白 cIts857开始失活,噬菌体裂解基因SRRz酶开始表达,在40℃诱导2 h后,以超声破碎的菌株为对照,溶菌率达到99.64%。
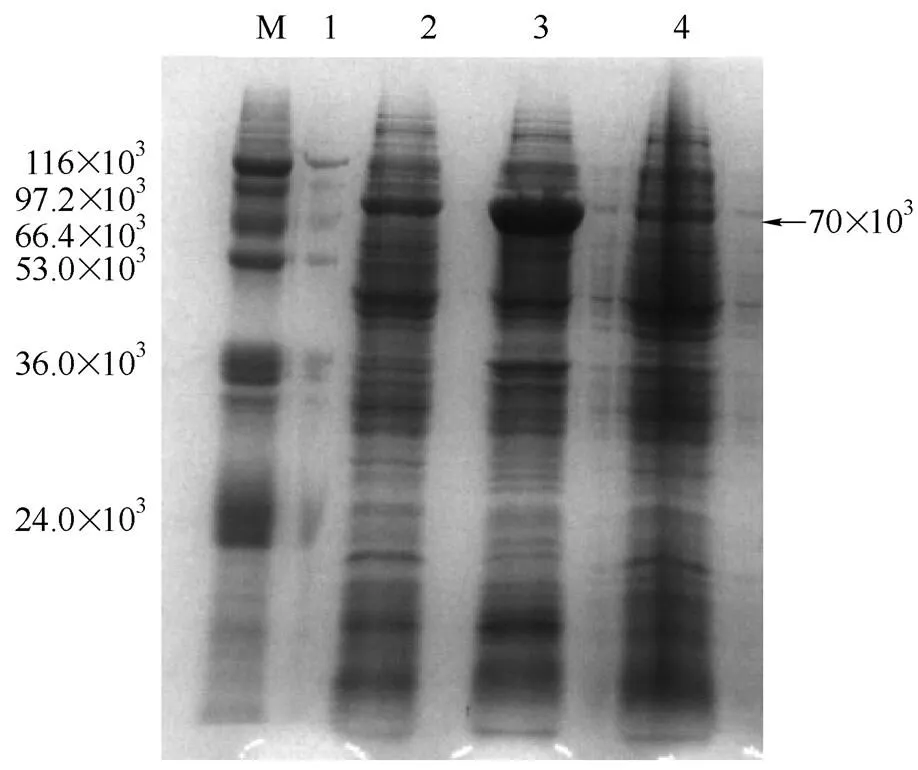
图3 不同启动子重组菌的SDS-PAGE分析
lane M—protein marker; lane1—.; lane 2—pTac-GUS;lane 3—pHce-GUS; lane 4—pGap-GUS

图4 不同启动子重组PGUS-E的活力比较
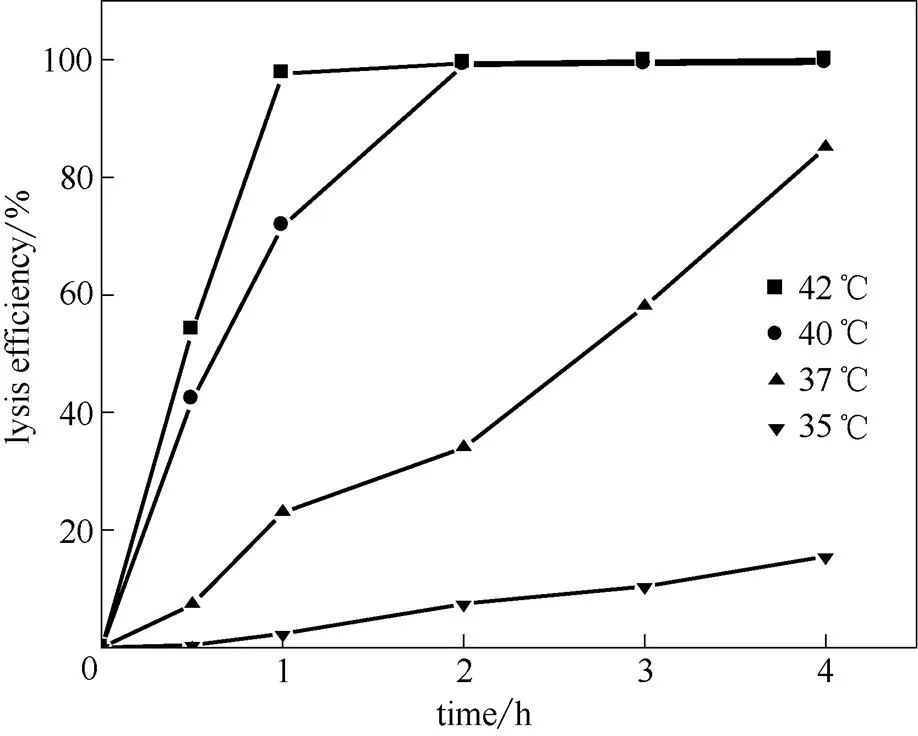
图5 不同温度下的裂解效率
2.4 集培养、产酶、裂解和反应于一体的突变酶的筛选
将建立的高通量筛选方法应用于-葡萄糖醛酸苷酶的定向进化,通过对约10000个克隆单菌落进行大规模的筛选,结果发现与野生的PGUS-E相比,约有14个突变体可能具有键选择性改进的潜力(图6)。其中C9、F72和M51突变体键选择性明显高于其他的突变体,分别为25%、37%和41%。将3株键选择性提高的目标菌株送上海生工测序,测序结果发现在氨基酸水平上,C9发生V257I和E261K的突变,F72发生A47S、D60S和K587R的突变,M51发生E87A、T195S和R434H的突变。
2.5 键选择性提高的突变体酶的结构分析
进一步分析氨基酸突变对PGUS-E结构和功能的影响。PGUS-E结构由3个结构域组成,分别是N端1~180 位氨基酸组成的糖基结合域(sugar- binding domain),C 端 275~593 位氨基酸组成的(/)8桶状结构域(TIM-barrel domain)以及在两者之间的181~274位氨基酸组成的免疫球蛋白状-三明治结构域(immunoglobulin-like-sandwich domain)。利用PyMOL软件分析结构发现,突变位点R434H和 K587R均位于TIM-barrel domain的-螺旋上,分析Arg434和Lys587与周围氨基酸的相互作用发现(图7),Arg434与周围的Asp462、Leu460、Pro430和Lys431存在6个氢键的相互作用,Lys587与周围His583、Leu584和Asn591也存在复杂的氢键的相互作用,同时Lys587与相邻亚基的Lys587也有相互作用力,推测螺旋的突变影响相邻氨基酸的空间结构,从而影响TIM- barrel的空间结构,造成-葡萄糖醛酸苷酶的键选择性显著 提高。
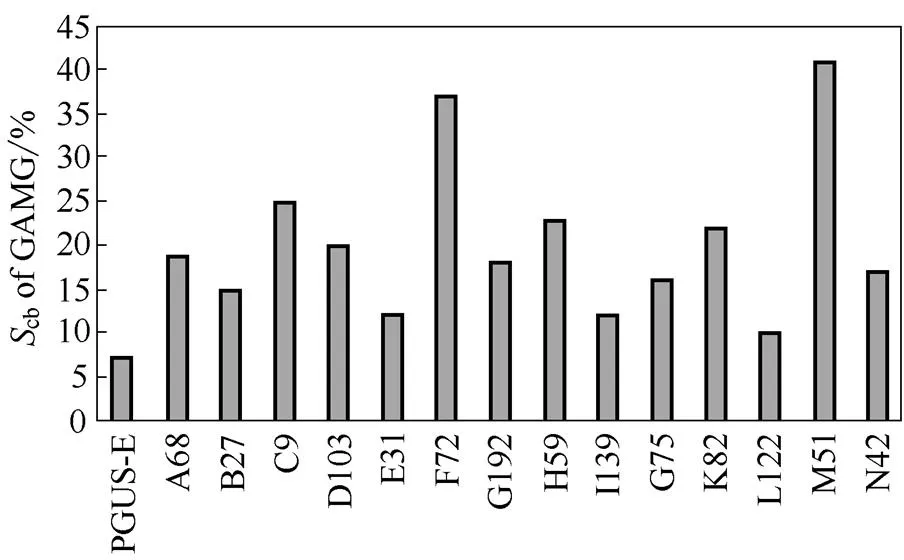
图6 β-葡萄糖醛酸苷酶不同突变体的底物特异性
Fig 6 Comparison of substrate specificity of-glucuronidase mutants

图7 β-葡萄糖醛酸苷酶(PGUS-E)突变位点分析
3 结 论
为了简化-葡萄糖醛酸苷酶转化甘草酸的键选择性的筛选步骤,提高筛选效率,降低筛选成本,建立了一种利用组成型表达-葡萄糖醛酸苷酶,温度诱导表达噬菌体裂解酶SRRz裂解细胞,集培养、产酶、裂解和反应于一体的一锅法(one-pot)甘草酸键选择性筛选体系(CELS),并将其成功应用于-葡萄糖醛酸苷酶的定向进化的筛选。
(1)成功构建了温度诱导表达噬菌体裂解酶SRRz,不同启动子强度调节的组成型表达-葡萄糖醛酸苷酶载体pHce-GUS、pTac-GUS和pGap-GUS。其中,-葡萄糖醛酸苷酶的表达受组成型启动子的强度影响,pHce-GUS载体表达的酶活最高,酶活力为17.2 U·ml-1。对噬菌体裂解酶SRRz酶的溶解能力进行了考察,温控启动子cIts857/pR的起始诱导温度为37℃,40℃以上2 h内溶菌率达到99.64%,具有良好的酶释放效果。
(2)将建立的高通量筛选方法应用于-葡萄糖醛酸苷酶的定向进化,获得了一系列键选择性显著提高的突变酶,对甘草酸键选择性提高到41%。突变位点结构分析表明PGUS-E TIM 桶状结构域中螺旋结构的变化对键选择性的改善有很大的影响。
[1] Fujisawa Y, Sakamoto M, Matsushita M, Fujita T, Nishioka K. Glycyrrhizin inhibits the lytic pathway of complement—possible mechanism of its anti-inflammatory effect on liver cells in viral hepatitis [J]..., 2000, 44 (9): 799-804.
[2] Cinatl J, Morgenstern B, Bauer G, Chandra P, Rabenau H, Doerr H W. Glycyrrhizin, an active component of liquorice roots, and replication of SARS-associated coronavirus [J]., 2003, 361 (9374): 2045-2046.
[3] Kalyan S, Bansal M. Recent trends in the development of oral dissolving film [J]......, 2012, 4 (2): 725-733.
[4] Mizutani K, Kuramoto T, Tamura Y, Ohtake N, Doi S, Nakaura M, Tanaka O. Sweetness of glycyrrhetic acid 3--beta-D-monoglucuronide and the related glycosides [J]...., 1994, 58 (3): 554-555.
[5] Akao Teruaki, Akao Taiko, Hattori M, Kanaoka M, Yamamoto K, Namba T, Kobashi K. Hydrolysis of glycyrrhizin to 18-glycyrrhetyl monoglucuronide by lysosomal-D-glucuronidase of animal livers [J]..., 1991, 41 (6): 1025-1029.
[6] Lu Dingqiang, Zhang Shumin, Wang Jun, Li Hui, Dai Yan. Adsorption separation of 3-D-monoglucuronyl-18-glycyrrhetinic acid from directional biotransformation products of glycyrrhizin [J]...., 2008, 7 (22): 3995-4003.
[7] Liu Hongmin, Sugimoto N, Akiyama T, Maitani T. Constituents and their sweetness of food additive enzymatically modified licorice extract [J]...., 2000, 48 (12): 6044-6047.
[8] Maitraie D, Hung Chi-Feng, Tu Huang-Yao, Liou Ya-Ting, Wei Bai-Luh, Yang Shyh-Chyun, Wang Jih-Pyang, Lin Chun-Nan. Synthesis, anti-inflammatory, and antioxidant activities of 18-glycyrrhetinic acid derivatives as chemical mediators and xanthine oxidase inhibitors [J]...., 2009, 17 (7): 2785-2792.
[9] Brieskorn C H, Lang J. Glycyrrhetic acid glycosides and their sweet flavor [J]..., 1978, 311 (12): 1001-1009.
[10] Kuramoto T, Ito Y, Oda M, Tamura Y, Kitahara S. Microbial production of glycyrrhetic acid 3--mono--D-glucuronide from glycyrrhizin byMG-27 [J]...., 1994, 58 (3): 455-458.
[11] Wang Chao, Guo Xiaoxiao, Wang Xiaoyan, Qi Feng, Feng Shijiang, Li Chun, Zhou Xiaohong. Isolation and characterization of three fungi with the potential of transforming glycyrrhizin [J]...., 2013, 29 (5): 781-788.
[12] Feng Shijiang, Li Chun, Xu Xiaolin,Wang Xiaoyan. Screening strains for directed biosynthesis of-D-mono-glucuronide-glycyrrhizin and kinetics of enzyme production [J]....., 2006, 43 (1): 63-67.
[13] Liu Yanli, Huangfu Jie, Qi Feng, Kaleem I, E Wenwen, Li Chun. Effects of a non-conservative sequence on the properties of-glucuronidase fromLi-20 [J]., 2012, 7 (2): 1-8.
[14] Song Zhanke (宋占科), Wang Xiaoyan (王小艳), Chen Guoqiang (陈国强), Li Chun (李春). Clonging and prokaryotic expression of-glucuronidase fromLi-3 [J].() (化工学报), 2008, 59 (12): 3101-3106.
[15] Hu Sheng (胡升),Yu Qing (虞青), Mei Lehe (梅乐和),Yao Shanjing (姚善泾), Jin Zhihua (金志华). Semi-rational directed evolution in improving indole-hydroxylation ability of cytochrome p450 BM-3 [J].(化工学报), 2009, 60 (11): 2869-2875
[16] Sun Xinxiao (孙新晓),Tang Qiuya (唐秋雅),Yuan Qipeng (袁其朋). Several new technologies for pathway and strain modification by metabolic engineering [J].(化工学报), 2015, 66 (8): 2831-2837. DOI: 10.11949/j.issn.0438-1157. 20150641
[17] Xu Lihua, Li Shuang, Ren Chuan, Cai Zhen, Lin Zhanglin. Heat-inducible autolytic vector for high-throughput screening [J]., 2006, 41 (3): 319-322.
[18] Cirino P C, Mayer K M, Umeno D. Generating mutant libraries using error-prone PCR//Arnold F H, Georgiou G. Directed Evolution Library Creation [M]. Berlin: Springer, 2003: 3-9.
[19] Zou Shuping (邹树平), Zhang Qi (张琦), Li Limin (李丽敏), Guo Yanxia (郭燕霞), Dai Dazhang (戴大章), Li Chun (李春). Biosynthesis of glycyrrhetinic acid monoglucuronide by whole-cell ofin an aqueous/organic system [J].(化工学报), 2009, 60 (8): 2040-2045.
[20] Kaleem I, Shen Huang, Lü Bo, Wei Bin, Rasool A, Li Chun. Efficient biosynthesis of glycyrrhetic acid 3--mono--D-glucuronide (GAMG) in water-miscible ionic liquid by immobilized whole cells ofLi-3 in alginate gel [J]...., 2014, 106: 136-143.
Construction and application of expression system for high-throughput screening of-glucuronidase with high bond selectivity
LÜ Bo, FENG Xudong, LI Chun
Department of Biological EngineeringSchool of Life ScienceBeijing Institute of TechnologyBeijingChina
To improve the bond selectivity of-glucuronidase towards glycyrrhetic acid 3--mono--D-glucuronide (GAMG), a one-pot selecting system (CELS) was established for the high-throughput screening. The system is consisted of the constitutive expression of fungal-glucuronidase and the bacteriophage lyase SRRz under the temperature-induced promoter in.. Then, the expression efficiency of PGUS-E with promoters of different strengths as well as the effect of the expression of bacteriophage lyase SRRz on lysis were investigated. In addition, a directed evolution based on the established screening system (CELS)was introduced to improve the bond selectivity of PGUS-E. The results indicated that CELS effectively integrated the strain culture, protein expression, cell lysis and the reaction. And a series of positive mutants with improved bond selectivity towards GAMG were obtained. It is concluded that the changes inhelix structure of TIM barrel domain have a strong influence on the improvement of the bond selectivity.
-glucuronidase; biocatalysis; molecular biology; optimal design; bond selectivity
2015-06-01.
Prof.LIChun, lichun@bit.edu.cn
10.11949/j.issn.0438-1157.20150788
Q 816
A
0438—1157(2015)08—3189—06
李春。
吕波(1985—),男,博士研究生。
国家自然科学基金项目(21376028, 21176028,21425624)。
2015-06-01收到初稿,2015-06-08收到修改稿。
supported by the National Natural Science Foundation of China (21376028, 21176028, 21425624).
