羊口疮病毒湖北株F1L基因克隆与遗传进化分析
2015-11-26田永祥周丹娜段正赢杨克礼刘泽文袁芳艳刑崔昱裴小英
郭 锐,田永祥,周丹娜,段正赢,杨克礼,刘泽文,袁芳艳,刘 威,刑崔昱,裴小英
(1.湖北省农业科学院畜牧兽医研究所,武汉 430064;2.动物胚胎工程及分子育种湖北省重点实验室,武汉 430064;3.山西农业大学;4.武汉市动物卫生监督所)
疾病防控
羊口疮病毒湖北株F1L基因克隆与遗传进化分析
郭 锐1,2,田永祥1,2,周丹娜1,2,段正赢1,2,杨克礼1,2,刘泽文1,2,袁芳艳1,2,刘 威1,2,刑崔昱3,裴小英4
(1.湖北省农业科学院畜牧兽医研究所,武汉 430064;2.动物胚胎工程及分子育种湖北省重点实验室,武汉 430064;3.山西农业大学;4.武汉市动物卫生监督所)
为了分析羊口疮病毒湖北株(ORFV-HB-YX株)F1L基因遗传变化规律,参照GenBank公布的ORFV-F1L基因序列设计特异性引物,对ORFV-HB株F1L基因进行PCR扩增、克隆、测序以及遗传进化分析。结果显示:F1L基因PCR扩增产物大小为999 bp,编码333个氨基酸,系统进化树显示HB-YX株与GenBank参考毒株的核苷酸序列同源性为95.0%~98.0%,与福建FJ-GO株同源性高达98%,亲缘关系最近,属于同一分支。
羊口疮病毒;F1L基因;克隆;遗传进化分析
羊口疮(ORF)又称羊传染性脓疱口炎或羊传染性脓疱等,是由羊口疮病毒(orfvirus,ORFV)引起的一种绵羊和山羊的高度接触性人畜共患传染病,也会感染其他野生反刍动物如鹿、麝牛等,以羔羊最为易感[1]。近年来,羊口疮在湖北省内临床病例呈逐渐上升趋势,以口唇、舌、鼻、乳房等部位形成丘疹、水泡、脓疱和结成疣状结痂为特征[2],同时容易继发细菌感染,如葡萄球菌、链球菌和变形杆菌等,以羔羊发病为主,严重者死亡率可达30%。
ORFV的基因组结构极其复杂,为线性dsDNA,其长度134~139 kb。目前公认的ORFV基因组共包含130多个基因,由两个相同的反向末端重复区(ORFs 001~008和ORF 112~134)和中央编码区(ORFs 009~111)组成。F1L基因是ORFV基因组的第59个开放阅读框,编码39 ku蛋白,位于基因组中部高度保守区域[3-5]。国内外学者对该基因研究也较多,如苏高莉等[6]、吉艳红等[7]、刘媛等[8]已证实F1L蛋白为免疫优势蛋白,能刺激机体产生中和抗体,有利于清除病原体,有助于阐明ORFV致病机制与新型疫苗研究,也为ORF的综合防控提供了实验依据。
1 材料与方法
1.1 材料
羊口疮病毒湖北株(HB-YX株)由本实验室保存;pMD18-T载体、DNA限制性内切酶HindⅢ和EcoRⅠ、rTaq DNA、E.coli DH5α聚合酶购自大连宝生物工程有限公司;DNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒均购自北京全式金生物技术有限公司。
1.2 病毒DNA的提取
按照DNA提取试剂盒说明操作提取HB-YX株DNA并-20℃保存。
1.3 引物设计与合成
根据GenBank中公布的F1L基因序列(登录号:AY386264)并参考文献设计1对特异性引物,上游引物P1:5'-CCCAAGCTTATGGATCCACCCGAAATCACGGCC -3';下游引物P2:5'-CGGAATTCTCACACAATGGCCGTGACCAGCAGCC-3',下划线处分别为HindⅢ和EcoRⅠ酶切位点,预期扩增片段大小为1 000 bp,引物由上海生工生物工程技术服务有限公司合成。
1.4 HB-YX株F1L基因的扩增
用1.2中提取的DNA为模板进行PCR扩增。PCR反应体系体积为50 μL,其中10 μmol/L浓度的上下引物各1 μL,模板5 μL,2×EasyTaq PCR Mix 25 μL,添加ddH2O至50 μL。反应程序:95℃预变性5 min;95℃变性30 s,68℃退火45 s,72℃延伸30 s,30个循环;72℃延伸10 min。
1.5 重组质粒的构建及鉴定
重组质粒的构建及鉴定反应体系为10 μL,依次加入PCR产物5 μL、pMD18-T载体1 μL、连接缓冲液4 μL,16℃连接4 h。取5 μL连接产物转化用DH5α感受态细胞,涂于含氨苄青霉素的LB平板,37℃培养过夜。从平板上挑取单菌落接种于3 mL含氨苄青霉素的LB培养液,37℃振荡培养过夜。用菌液提取质粒,用HindⅢ和EcoRⅠ限制性内切酶酶切鉴定。将酶切鉴定为阳性的重组质粒送到上海生工生物工程有限公司测序,利用基因分析软件MegAlign 5.0对测序结果进行分析,参考毒株信息见表1。
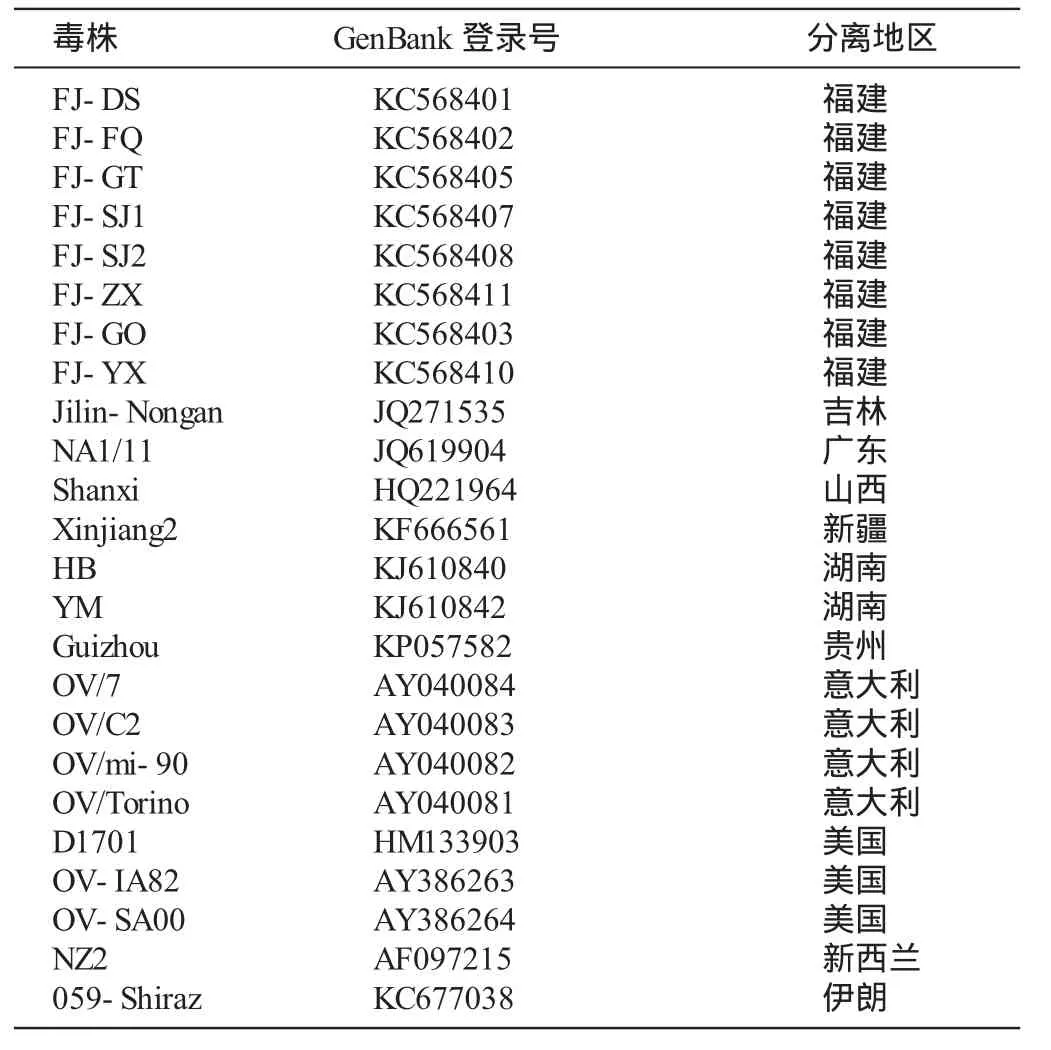
表1 参考毒株信息
2 结果与分析
2.1 HB-YX株F1L基因的扩增
进行PCR扩增后得到999 bp的片段,与预期相符,见图1。
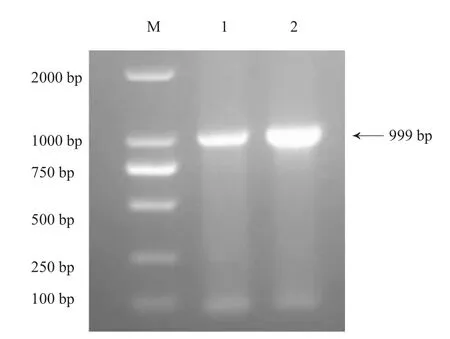
图1 HB-YX株F1L基因PCR扩增电泳图
2.2 重组质粒的酶切鉴定
提取重组质粒pMD18-T-F1L后,选用限制性内切酶HindⅢ和EcoRⅠ双酶切后,获得两条大小为2 692 bp和999 bp左右的基因片段,分别与预期基因片段大小相符,见图2。
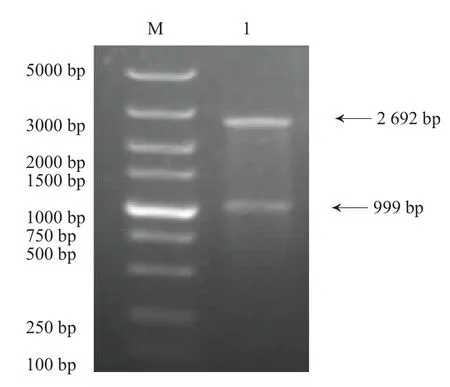
图2 重组质粒PCR鉴定
2.3 F1L基因序列测定
将鉴定的阳性质粒送上海生工生物工程有限公司进行序列测定,对测序结果应用MegAlign 5.0软件进行拼接,HB-YX分离株F1L基因序列长999 bp,编码333个氨基酸,见图3。

图3 ORFV-HB株F1L基因测序结果
2.4 HB-YX-F1L基因片段的氨基酸同源性分析
用MegAlign 5.0软件进行氨基酸同源性分析表明,HB-YX株和GenBank中公布的21个不同ORF毒株的F1L基因氨基酸序列同源性为95.0%~98.0%,与福建FJ-GO株同源性高达98%,亲缘关系最近,为同一分支,见图4。
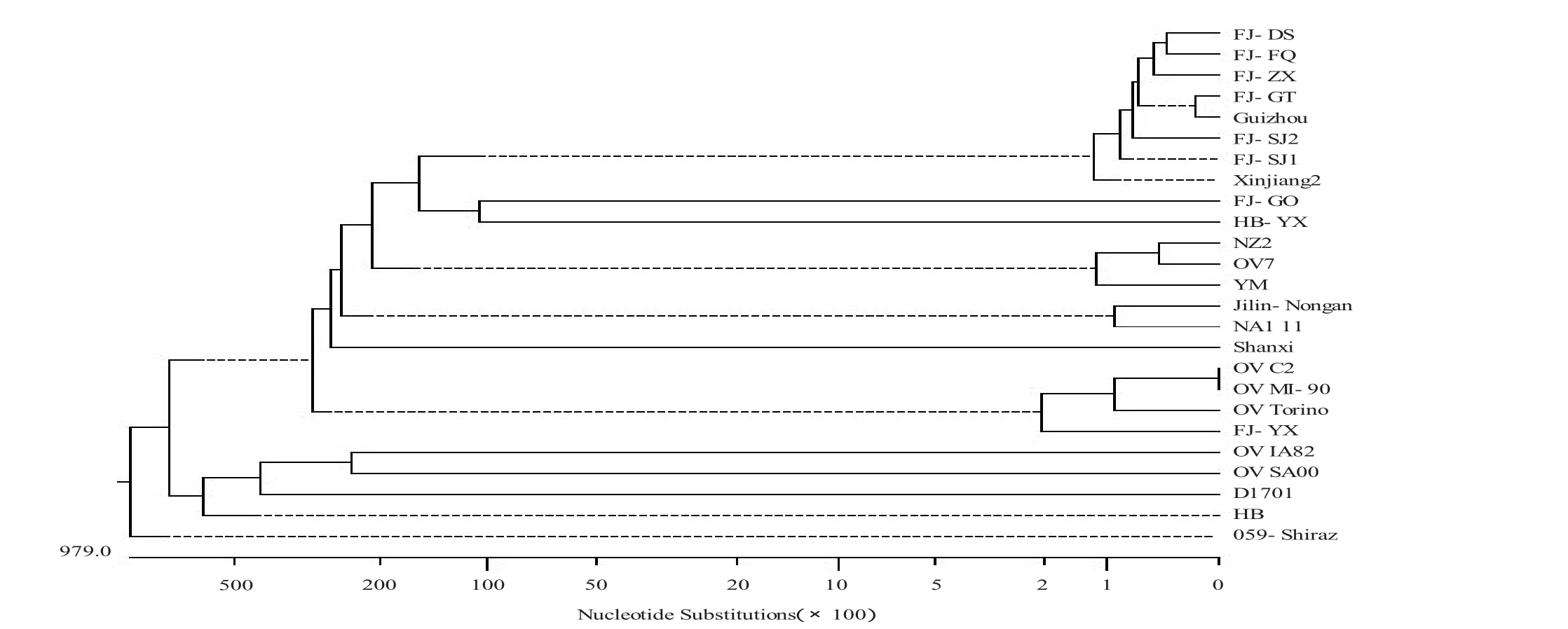
图4 HB-YX株F1L基因序列系统进化树
3 讨论
近年来湖北省大力发展山羊养殖业,种羊需求量巨大,因此从全国各地大量引种。由于引种过程耗时长,以及新环境引起的应激,导致山羊机体免疫力下降,如果此时山羊体内已经受羊口疮病毒隐性感染,极易出现排毒现象,导致羊口疮的暴发。目前市场上没有治疗羊口疮的特效药,所以对于羊口疮的预防工作就显得尤为重要。国内外羊口疮疫苗的研发经历了痂皮强毒疫苗、灭活疫苗、弱毒疫苗几个阶段,虽然有研究报道制备成功了亚单位疫苗和DNA疫苗,但仍然处于实验室研究阶段,并没有上市销售。同时不少文献报道国内羊口疮弱毒疫苗株免疫后不能提供有效的保护,而且不同地区、不同毒株的血清型存在差异,因此一种羊口疮疫苗并不能预防所有地域羊口疮的发生,导致羊群出现免疫失败和重复感染现象[9],还极易继发细菌感染(链球菌、葡萄球菌、变形杆菌等),造成极高的死亡率。
本实验成功克隆出HB-YX株F1L基因,序列全长999 bp,通过与国内外已公布序列对比发现,HB-YX株与GenBank参考毒株的核苷酸序列同源性为95.0%~98.0%,虽属于高度保守区域,仍存在一定的差异。HB-YX株与福建FJ-GO株同源性最高达98.0%,同属于一个分支,通过核苷酸序列对比发现存在一定的基因突变现象,主要突变点在160位处,比FJ-GO株缺少了GCGCCGGCCCCT共12个碱基。环境改变和免疫压力等因素可能是造成F1L基因变异的原因,这种变异性对其生物学特性的影响还有待考证。本研究阐明了湖北省羊口疮流行毒株的F1L基因变异情况,也为今后对F1L基因的蛋白表达、相关基因功能研究和新的ORF疫苗的研制奠定了基础。
[1] 殷震,刘景华.动物病毒学[M].北京:科学出版社,2008:423-445.
[2] Abrahao J S,Campos R K,Trindade G S,et al.Detection and phylogenetic analysis of Orf virus from sheep in Brazil:a case report[J].Virol J,2009(6):47.
[3] 王锴桦.羊传染性脓疱病毒F1L基因重组腺病毒的构建与鉴定[D].长春:吉林农业大学,2012.
[4] 赵魁.羊传染性脓疱病毒重组DNA疫苗的构建与实验免疫研究[D].长春:吉林农业大学,2010.
[5] 李前瑞,李杰,田婷婷,等.羊口疮病毒多重PCR检测方法的建立[J].动物医学进展,2013(6):36-38.
[6] 苏高莉,赵魁,孙秀萍,等.羊口疮病毒农安分离株的分离鉴定及Orf059(F1L)基因的序列分析[J].中国兽医学报,2013,33(1):4-8.
[7] 吉艳红,尚佑军,王光祥,等.羊口疮病毒F1L基因的克隆及其B细胞表位预测[J].中国兽医科学,2010,40(11):1101-1105.
[8] 刘嫒,杨钰,鲜思美,等.羊口疮病毒贵州株F1L基因克隆及生物信息学分析[J].中国畜牧兽医,2015,42(1):53-60.
[9] Friebe A,Friederich S,Scholz K,et al.Characterization of immunotimsulatorycomponents of orf virus(Parapoxvirus ovis)[J].J Gen Virol,2011,92(7):1571-1584.
Cloning and Phylogenetic Analysis of F1L Gene of Orf Virus Isolated in Hubei
GuoRui1,2,Tian Yongxiang1,2,Zhou Danna1,2,et al
(1.Institute ofAnimal Husbandryand Veterinary,Hubei AcademyofAgricultural Science,Wuhan 430064,China;2.Hubei KeyLaboratoryofAnimal EmbryoEngineeringand Molecular Breeding,Wuhan 430064,China)
In order toanalyze the orfvirus Hubei strain(ORFV-HB-YX strain)genetic variation ofF1L gene,specific primers for ORFV-F1L gene sequence published by GenBank was designed,the PCR gene of ORFV-HB strain was amplified,cloned and sequenced,and the genetic analysis ofF1L gene was carried out.The result displayed that gene F1L amplification product size was 999 bp,encoding 333 amino acids.Phylogenetic tree showed that the homology of nucleotide sequence of HB-YX strain with GenBank strain was 95.0%~98.0%,the homology with the Fujian FJ-GO strain was 98%,it indicated that they belonged to the same branch.
Orfvirus;F1L gene;clone;phylogenetic analysis
S826.2,827.2
A
2095-3887(2015)06-0031-04
10.3969/j.issn.2095-3887.2015.06.010
2015-08-17
湖北省农业科技创新中心资助项目(2015-620-004-001);动物胚胎工程及分子育种湖北省重点实验室开放课题项目(2015ZD150);国家公益性行业(农业)科研专项(201303035)
郭锐(1981-),男,助理研究员,硕士,主要从事动物疫病防控研究。
田永祥,研究员。
