家蝇幼虫抗菌物质提取方法的比较
2015-11-25张紫秋王智柔邓先余林连兵
雷 琎,张紫秋,王智柔,邓先余,林连兵
(昆明理工大学生命科学与技术学院,昆明 650500)
家蝇是我国常见的一种资源性的昆虫。研究发现,家蝇幼虫体内含有多种抗菌物质,其中包括蛋白类,如:天蚕素、昆虫防御素等(马红霞等,2007),非蛋白类如:1-LPE (Meylaers et al.,2004)、几丁质(Sukontascn et al.,2000)、尿囊素等(Moreira et al.,2003)。这些抗菌物质具有分子量小,热稳定性好,广谱抗菌 (翟朝阳,1996)甚至是抑制肿瘤细胞等特点 (Mohammad et al.,1995)。
利用基因工程克隆抗菌肽,其种类少,效果不佳且蝇蛆体内有非蛋白抗菌物质,这部分物质无法通过基因工程的方法合成,所以如何高效制备抗菌物质是工业上一直探索的问题。
目前国内关于家蝇抗菌物质的研究主要集中在抗菌肽的诱导与单蛋白的纯化上,如周永富等(1997)探究了家蝇抗菌肽的诱导条件,陆婕等(2006)分离出单一的家蝇抗菌肽MD7095,陆婕等(2007)人采用加热层析法和海藻酸法优化工业制备抗菌肽的方法,对于抗菌物质大量工业化制备的文献较少见。
在陆婕等(2007)采用的海藻酸吸附和加热后冻干再层析的制备方法中,由于海藻酸的昂贵和层析处理的样品量少,在大规模制备上仍然存在一定的局限性。切向流是一种大体积的超滤系统,根据党向利(2008)的研究结果表明,使用10 kDa的小体积超滤浓缩管就能很好的回收家蝇抗菌肽,基于此结论本文采用加热后再利用切向流超滤法和直接冻干法提取抗菌物质,通过分析比较,探索最佳提取抗菌物质的方法。
1 材料与方法
1.1 材料
实验蝇蛆:在65℃下干燥24 h的家蝇Musca domestica 幼虫
测试菌株:金黄色葡萄球菌Staphylococcus aureus ATCC6538、枯草芽孢杆菌Bacillus subtilis CMCC (B)63501、大肠杆菌 Escherichia coli 0157NOTC12900、大肠杆菌Escherichia coli Rosetta、沙门氏菌Salmonella enteritidis CMCC (B)50335、志贺氏菌Shigella dysenteriae A7CC10231 (以上菌种购自广东微生物研究所)
主要试剂:GE Hiload Superdex 75 (GE Amersham)、LB 培养基(安琪)
主要仪器:层析系统AKTA Explorer (GE Amersham)、蛋白电泳系统(GE Amersham)、恒温培养箱(上海一恒)、粉碎机(普润)、真空冷冻干燥器(Jouan)、蠕动泵(Lopump)、10 kDa 切向流膜包(Sartorius)
1.2 方法
1.2.1 蝇蛆抗菌物质提取液制备
将400 g 干蝇蛆用粉碎机磨成粉末,将其溶于2 L 0.5 mol/L 乙酸溶液中,在4℃下静置10 h,4℃8000 rpm 离心15 min,将上清通过1000 目的网目后置于100℃水浴锅中水浴10 min,4℃8000 rpm 离心15 min,取上清,并用真空抽滤装置透过0.22μm 滤膜,取滤液用于抗菌物质的浓缩。
1.2.2 抗菌物质的浓缩
本文采用两种不同的方法浓缩抗菌物质,具体方法:(1)超滤法:采用切向流超滤法(如图1的装置),将其中1 L 抗菌物质酸提取液在4℃通过10 kDa的切向流系统进行浓缩,至50 mL 获得浓缩液。(2)直接冻干法:将抗菌物质提取液分装于几个平皿中进行真空冷冻干燥,将干燥后的粉末再次溶回50 mL 0.5 mol/L 乙酸溶液,以13000 rpm 离心去除沉淀,获得可溶性的浓缩液,用于蛋白质含量测定。

图1 切向流超滤装置Fig.1 Device of tangential flow ultrafiltration
1.2.3 凝胶过滤层析
参照钟雅(2007)的层析条件并适当改进,用0.2 mol/L 乙酸溶液平衡Superdex 75 柱子,分别将以上浓缩液以13000 rpm 离心后,通过0.22μm 针头滤膜,取其中2 mL 进行凝胶过滤层析。以2.5 mL/min的速度用0.2 mol/L 乙酸进行洗脱,根据280 nm 处监测值对样品分离的各组分进行收集,每管收集10 mL,并冻干后,每个组分加入1 mL 蒸馏水溶解,供抗菌活力检测用。同时取10 mL 0.2 mol/L 醋酸冻干后溶于1 mL 蒸馏水中作为空白对照。切向流法制备层析的组分为A 组,直接冻干法制备的组分为B 组,空白组为C 组。
1.2.4 抗菌活力检测
采用平板打孔法,取OD600 ≈0.8 待测菌500μL,加入到20 mL 预热的LB 固体培养基中,混匀后倒平板。待琼脂凝固后打孔,向孔内分别加入40μL 上述各组分的溶液,自然扩散30 min后,将平板倒置于37℃恒温培养箱静置过夜培养。
1.2.5 蛋白质含量测定
采用考马斯亮蓝法(Coligan,2003),测定可溶性蛋白含量。
1.2.6 蛋白质电泳
采用Tricine-SDS-PAGE 法进行电泳,参考Herman 等(1987)的方法,分离胶浓度为17%,浓缩胶浓度为5%,每孔上样20μL。
2 结果与分析
2.1 两种浓缩方法制备液中蛋白含量测定结果
利用超滤法得到的抗菌物质为深褐色浓缩液,无沉淀;利用冻干法制备出的抗菌物质也为深褐色,但有较多沉淀。
通过考马斯亮蓝法测定超滤法制备液的可溶蛋白含量为10.2 mg/mL,而直接冻干法得到的可溶蛋白含量仅为1.2 mg/mL。
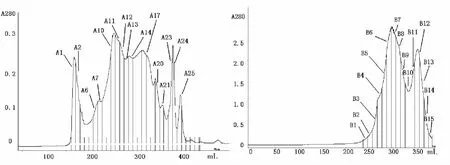
图2 两种不同浓缩液的凝胶层析结果Fig.2 Gel chromatography results of two different extraction methods
2.2 凝胶过滤层析结果
对采用超滤法获得的浓缩液进行凝胶过滤层析后,收集得到25个组分(A1-A25),直接冻干法获得的浓缩液则得到15个组分(B1-B15)。
2.3 各组分抗菌活性的分布
采用7 种不同的测试菌对切向流超滤浓缩液和直接冻干浓缩液的不同组分抗菌能力进行检测,结果如表1 和表2 所示。A1、A2、A10、A11、A12、A13、A20、A21 具有抗菌活性,但抗菌谱不尽相同。在这9个具有抗菌活性的组分中,A1、A2、A10、A11、A12、A13 抗菌谱均较窄,仅对革兰氏阳性细菌和部分革兰氏阴性细菌有抑菌能力,而A20、A21的抗菌谱较宽,对几种测试菌都有不同程度的抑菌效果。但通过考马斯亮蓝法检测,A1、A2、A10、A11、A12、A13 组分的蛋白量均超过0.5 mg/mL,而A20、A21 难以检测的其含有蛋白,可能为非蛋白成分。
采用直接冻干法提取的蛋白再进行凝胶层析后,得到15个组分,除了B4 和B14 以外,所有组分均具有抗菌活性。其中B1、B2 仅对革兰氏阳性细菌和部分革兰氏阴性细菌有抑菌能力,两个组分的蛋白量均超过0.2 mg/mL;B6-B12 具有较宽的广谱抗菌能力,对7 种测试菌都有不同程度的抑菌效果,且有较强抗菌活性,其抑菌圈超过了1 cm,但无法通过考马斯亮蓝检测到蛋白,也有可能是非蛋白成分。
空白对照组C 组对6 种测试菌均无抑菌效果。

表1 超滤法提取的抗菌物质各组分抑菌效果Table 1 Bacteriostatic effect of antimicrobial substances components extracted by ultrafiltration method
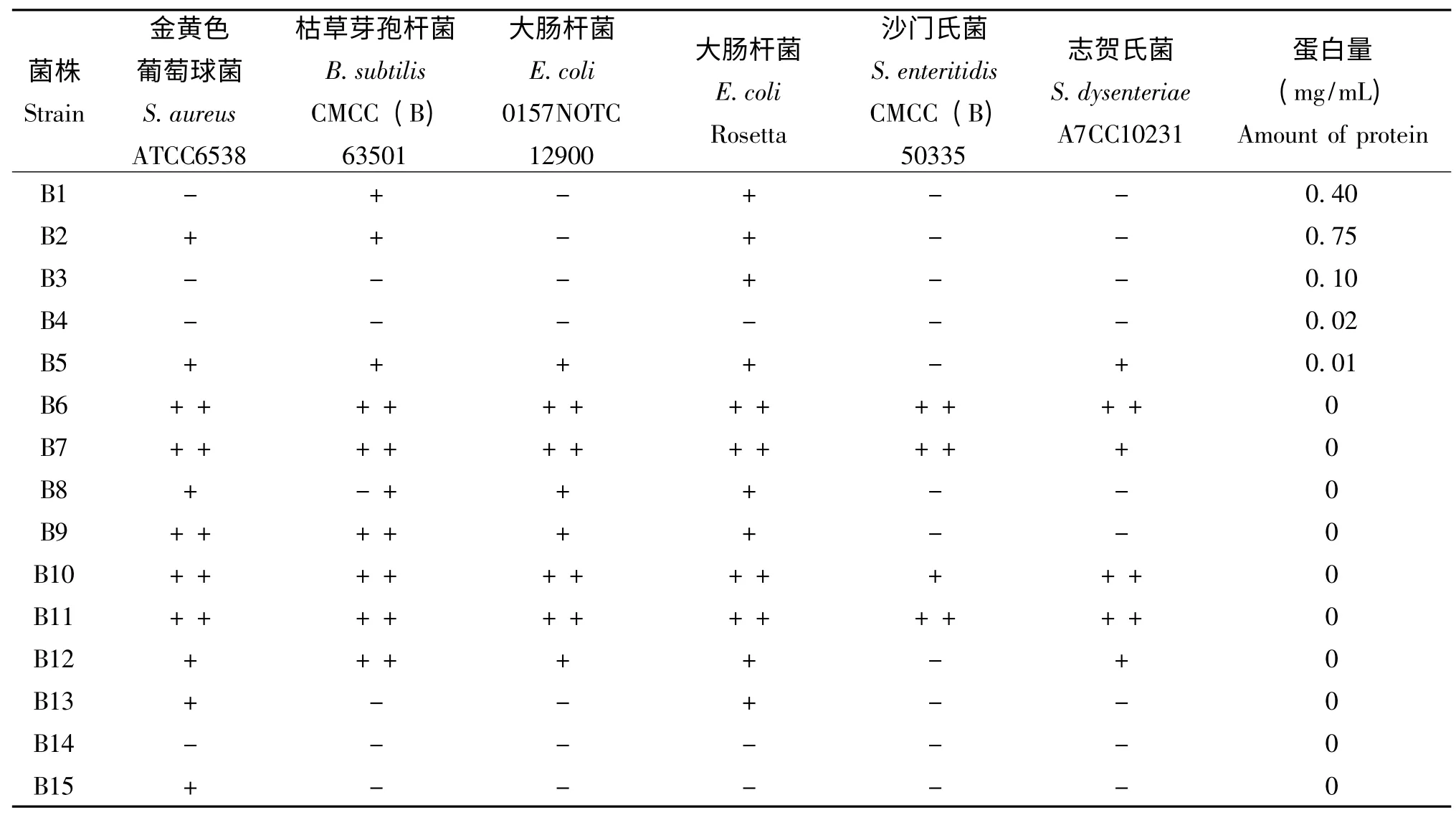
表2 直接冻干法提取的抗菌物质各组分抑菌效果Table 2 Bacteriostatic effect of antimicrobial substances components extracted by direct freeze-drying
2.4 活性组分的电泳结果
使用Tricine-SDS-PAGE 进行电泳,每孔上样20μL,结果如图3 所示(箭头表示)。采用超滤法分离得到的各组分中,A2 分布在75 kDa、48 kDa、24 kDa、17 kDa 和11 kDa 几个位置,A11主要集中在9 kDa-41 kDa,A12 主要集中在25 kDa-34 kDa 和7 kDa-18 kDa,A13 主要集中在25 kDa-33 kDa、15 kDa-17 kDa 和6 kDa-12 kDa 三段。A20 和A21 电泳后没有显示出明显的条带(图中未显示),结合蛋白浓度测定的结果,断定为非蛋白类物质。B1、B2 主要集中在15 kDa-17 kDa 和6 kDa-10 kDa 这两段。B5-B11 电泳后没有显示出任何条带(图中未显示),结合蛋白浓度的测定结果,也推断为非蛋白类物质。
A11 和A12的抗菌强度均好于A13、B1、B2,对比A11、A12、A13、B1、B2的电泳条带可知有一部分的蛋白类的抗菌物质处在11 kDa-41 kDa这个范围。A2 具有一定的抗菌活性,但是由于抗菌物质在制备过程中进行了沸水浴,所以电泳图中的100 kDa、75 kDa、48 kDa 条带的位置是少量未热变性沉淀的蛋白,不具有抗菌活性,而24 kDa、17 kDa、11 kDa 条带是具有抗菌活性的蛋白。

图3 抗菌活性组分的电泳结果Fig.3 Electrophoresis results of fractions with antibacterial activity
3 结论与讨论
家蝇体内含有多种抗菌肽,这些抗菌肽对革兰氏阳性细菌和革兰氏阴性细菌均有一定的杀灭作用。目前对抗菌肽的大规模制备仍处于探索阶段。陆婕(2007)等人采用了海藻酸吸附的方法和加热后直接冻干再层析的方法进行了提取,使用海藻酸吸附法并不能得到较高的产率且海藻酸较为昂贵,而使用加热层析法虽然产率有所提升但是层析并不适合用于大规模的工业生产,故上述两种方法并非工业化上最优方法。根据党向利(2008)研究表明,使用10 kDa 超滤浓缩管进行超滤,抗菌肽的回收率可达到99%。由于浓缩管超滤的流速方向与滤膜是垂直的而切向流超滤的流速方向与滤膜是平行的,所以与浓缩管超滤相比切向流超滤不但可以更高的提高回收率而且可以一次性处理更大体积的样品。本研究采用了加热后通过10 kDa 切向流系统超滤和直接冻干两种方法进行抗菌肽的提取,结果表明利用切向流超滤法得到的可溶蛋白量是直接冻干法可溶蛋白量的8.5 倍。考虑到切向流超滤是一种简单的设备,使用时仅需要定期清洗即可重复使用,对于大规模工业生产这是一种简单而且有效降低成本的方法。
在对比两种制备方法制备的抗菌物质的组分分析方面,本研究采用凝胶过滤层析法,使用Superdex 75 凝胶过滤层析柱,参照钟雅(2007)的层析条件并适当改变了流速,对使用两种提取方法得到的抗菌肽进行分离得到了两种不同的洗脱峰。使用超滤法提取的蛋白进行层析后在A280处得到多个吸收峰,其中收集到的蛋白组分的抗菌谱不如非蛋白组分的抗菌谱广。使用直接冻干法提取的蛋白在A280处只有两个峰,但抑菌试验和蛋白含量检测结果表明未能测出蛋白的组分无论从抗菌谱还是抗菌活性均更好。通过 Tricine SDS-PAGE后,通过分析对比,能测出蛋白类的抗菌物质的组分分布各不相同,但大致可以断定抗菌物质是分布在11 kDa-41 kDa,而未能测出蛋白的组分均无法得到电泳图,进一步证实这些组分为非蛋白类物质。
凝胶过滤层析过程中有大量无法用考马斯亮蓝法测出蛋白含量,但在A280有较高吸光值的物质,结合蛋白检测结果断定为非蛋白类的抗菌成分,家蝇体内除了抗菌肽以外也含有非蛋白类抗菌物质,如Meylaers 等(2004)用甲醇从家蝇体内提取出抗菌物质1-LPE,其分子量为451.2 Da,此外人们还发现了几丁质、尿囊素等非蛋白类抗菌物质(Craezyk et al.,2001)。它们的分子量较小,具有抗细菌、真菌、病毒的作用,其中尿囊素还可以促进伤口的愈合(罗金香等,2005)。尿囊素在A293处有强烈的吸光度,壳聚糖的衍生物在A260处有最大吸光度,这些非蛋白抗菌组分也会在A280处会有一定的吸光度。
通过凝胶过滤层析分析显示,在制备抗菌物质的方法上,使用切向流超滤法比直接冻干法得到的蛋白类抗菌组分多,非蛋白类抗菌组分少。通过蛋白电泳结果也显示,使用10 kDa 切向流超滤可以高效回收复合抗菌物质中抗菌蛋白类成分。综合上述结果可知,切向流超滤在有效浓缩蛋白类抗菌组分的同时,非蛋白类抗菌组分也从切向流超滤系统中透过。非蛋白类的抗菌物质可采用喷雾干燥等方法进行浓缩干燥。蛋白类抗菌组分与非蛋白类抗菌组分在此过程中得以分离,同时也保证了蛋白类的抗菌物质得到了最大程度的回收。
在家蝇的抗菌物质中,既有蛋白类抗菌物质也有非蛋白类抗菌物质,在制备蝇蛆抗菌物质时,需充分考虑不同方法获得的组分差异和制备效率。
References)
Coligan JE.Short Protocols in Protein Science [M].Hoboken:John Wiley & Sons,Inc.2003,41-60.
Craezyk TK,Knight R,Gilman RH,et al.The role of non-biting flies in the epidemiology of human infection diseaaes [J].Microbe and Infeclion,2001,3:231-235.
Dang XL.Preparation and Study on Separation and Purification of Musca domestica Pupa Natural Antibacterial Peptide [D].Guangzhou:Zhongshan Universiry,2008.[党向利.家蝇蛹天然抗菌肽的制备及其分离纯化研究[D].广州:中山大学,2008]
Hermann S,Von GJ.Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kD [J].Analytical Biochemistry,1987,166:368-379.
Lu J,Wang JH,Zhong Y,et al.Purification and characterization of weak-acid antibacterial peptide MD7095from Musca domestica larvae[J].Acta Micrbidogica Sinica,2006,46 (3):406-411.[陆婕,汪俊汉,钟雅,等.弱酸性家蝇蛆抗菌肽MD7095的分离纯化及性质研究[J].微生物学报,2006,46 (3):406-411]
Lu J,Zhong Y,Liu L,et al.Optimization of extraction technique for antibacterial peptides from Musca domestica larvae [J].Acta Entomologica Sinica,2007,50 (2):106-112.[陆婕,钟雅,柳林,等.家蝇蛆抗菌肽提取工艺研究[J].昆虫学报,2007,50 (2):106-112]
Luo JX,Yang CL,Wu WD.Study and application of Musca domestic antimicrobial peptides [J].Chinese Bulletin of Entomology,2005,42 (3):235-239.[罗金香,杨春龙,吴伟东.家蝇抗菌肽的研究与应用[J].应用昆虫学报,2005,42 (3):235-239]
Ma HX,Sun N,Pei ZH,et al.Reseaech progress on antibiotic peptite of Musca domestica [J].Chinese Journal of Veterinary Drug,2007,41 (11):45-49.[马红霞,孙娜,裴志花,等.家蝇抗菌肽研究进展[J].中国兽药杂志,2007,41 (11):45-49]
Meylaers K,Clynen E,Daloze D.Identification of 1-lysophosphatidylethanolamine (C16 ∶1) as an antimicrobial compound in the housefly Musca domestica[J].Insect Biochemistry and Molecular Biology,2004,34 (1):43-49.
Sukontascn K,Bunchoo M,Khantawa B.Musca domestica as a mechanicak carrier of becteria in Chiang Mai,North Thailand [J].Vector Ecol.,2000,25:114-117.
Mohammad FV,Noorwala M,Ahmad VU,et al.A bidesmosidic triterpenoidal saponins from the roots of Symphytum off icinale [J].Planta Med.,1995,61:94.
Moreira CK,Capurro M,Calvo E.The Musca domestica larval hexamerin is composed of multiple,similar polypeptides [J].Insect Biochem.Mol.Biol.,2003,33 (4):389-395.
Zhao CY.The progress of studies on insecet antibacterial proteins [J].Acta Entomologica Sinica,1996,39 (1):99-104.[翟朝阳.昆虫抗菌物质的研究进展[J].昆虫学报,1996,39 (1):99-104]
Zhong Y.Purification and Partial Characterization of a Novel,Antibacterial Peptide from Musca domestica Larvae [D].Wuhan:Huazhong University of Science and Technology,2007.[钟雅.一个新家蝇抗菌肽的分离纯化和部分性质研究[D].武汉:华中科技大学,2007]
Zhou YF,Rao JH,Yang JC,et al.Induction of antibacterial substance of Musca domestica [J].Journal of Biology,1997,14 (77):23-26.[周永富,饶军华,阳建春,等.家蝇抗菌物质的诱导[J].生物学杂志,1997,14 (77):23-26]
