甘蔗抗褐锈病基因Bru1分子检测体系的建立与应用
2015-11-25李文凤王晓燕黄应昆张荣跃单红丽罗志明
李文凤,王晓燕,黄应昆,张荣跃,单红丽,尹 炯,申 科,罗志明
(云南省农业科学院甘蔗研究所,云南省甘蔗遗传改良重点实验室,开远 661699)
甘蔗抗褐锈病基因Bru1分子检测体系的建立与应用
李文凤,王晓燕,黄应昆*,张荣跃,单红丽,尹 炯,申 科,罗志明
(云南省农业科学院甘蔗研究所,云南省甘蔗遗传改良重点实验室,开远 661699)
为建立高效、快速、准确的甘蔗抗褐锈病鉴定方法,提高抗褐锈病育种效率。本研究以5个已知含抗褐锈病基因Bru1和5个高感褐锈病的甘蔗品种为试材,通过优化PCR反应体系、酶切体系和循环条件,构建了甘蔗抗褐锈病基因Bru1的分子检测体系。经反复验证,该体系能高效、稳定、准确地检测出抗褐锈病基因Bru1。22份生产品种抗褐锈病基因Bru1的PCR检测结果显示,‘闽糖69-421’、‘闽糖70-611’、‘粤糖 86-368’、‘新台糖10号’、‘新台糖16号’、‘新台糖22号’、‘新台糖25号’、‘桂糖11’、‘桂糖21’、‘云蔗71-388’、‘云蔗81-173’、‘云蔗89-151’、‘云瑞99-601’、‘赣蔗95-108’等14份抗褐锈病品种含抗褐锈病基因Bru1,另8个抗褐锈病品种未检测到抗褐锈病基因Bru1。研究结果为深入开展甘蔗抗褐锈病育种,选育和推广优良抗病品种,有效防控甘蔗褐锈病提供了关键技术和优良抗源材料。
甘蔗褐锈病; 抗病基因Bru1; 分子检测
由黑顶柄锈菌(PucciniamelanocephalaH.Sydow & P. Sydow)引起的甘蔗褐锈病是世界性的重要病害,常造成巨大的经济损失。该病最早于1890年在爪哇发现;印度自1949年以来经常发生流行,主栽品种‘Co475’因高度感病而被迫取消栽种;20世纪70年代后,在古巴、牙买加、澳大利亚、美国、墨西哥、印度、泰国和毛里求斯等植蔗国家和地区普遍发生,并多次暴发流行,致使一些丰产高糖当家品种如‘Co475’、‘T34362’、‘CP78-1247’等惨遭淘汰[1-6]。我国台湾1977年首次发生甘蔗锈病,1982年首次在中国大陆云南甘蔗种植区发现该病害,之后在福建、广东、四川、江西和广西等蔗区先后报道。目前,该病在国内蔗区普遍发生和蔓延危害,造成甘蔗种质退化、产量降低[7-10]。发病田块一般减产15%~30%,严重地块减产幅度可达40%以上,蔗糖含量降低10%~36%[11-12]。尤其近年,我国蔗区主栽的一批丰产高糖品种如‘桂糖15’、‘桂糖17’、‘桂引9号’、‘P44’、‘台糖86-1626’和主推品种‘粤糖60号’和‘德蔗03-83’等也因高度感染锈病而面临淘汰,极大地影响了蔗糖产业的持续稳定发展[11]。
选育并推广抗病品种是控制病害最经济、有效的途径,而抗病性鉴定直接影响抗病育种成效[1-2]。目前,国外研究人员已在栽培品种‘R570’上发现和定位了甘蔗抗褐锈病的主效基因Bru1[13-14],该基因被证实对来自不同国家和地区的褐锈病菌具有抗性[13],并开发出了与Bru1密切相关的2个分子标记用于辅助选择抗病育种[15]。而我国对甘蔗锈病的抗性鉴定评价还停留在人工接种后表型的观察阶段,尚未开展抗锈病基因标记选择方面的研究。传统的人工接种表型选择抗病性鉴定耗时、低效,难以满足育种家对抗病育种的要求[16-20]。因此,为高效、准确地开展甘蔗抗褐锈病鉴定和抗病育种选择,本课题组开展了甘蔗抗锈病基因分子检测研究,优化建立了甘蔗抗褐锈病基因Bru1的PCR快速检测方法,有助于提高抗性鉴定的准确性和选择效率;同时应用建立的PCR方法对部分生产品种进行了抗褐锈病基因Bru1检测,以期为选育和利用抗病品种有效防控甘蔗锈病提供科学依据和优良抗源材料。
1 材料与方法
1.1 材料
5份已知含抗褐锈病基因Bru1的材料‘R570’、‘新台糖1号’、‘新台糖9号’、‘台糖160’、‘Q127’[18](编号R1~R5)、5份高感褐锈病材料‘CO290’、‘Q138’、‘P44’、‘桂糖15’、‘选3’(编号S1~S5)和22份抗褐锈病生产品种(编号为1~22,表1)共32份材料均由国家甘蔗种质资源圃提供。
1.2 方法
1.2.1 引物设计
甘蔗抗褐锈病基因Bru1的PCR标记R12H16和9O20-F4引物参照文献[15]的方法设计,委托上海生物工程公司合成。
R12H16标记上游引物5′-CTACGATG-AAACTACACCCTTGTC-3′,下游引物5′-CTTATGTTAGCGTGACCTATGGTC-3′,预期扩增产物长度为570 bp;9O20-F4标记上游引物5′-TACATAATTTTAGTGGCACTCA GC-3′,下游引物为5′-ACCATAATTCAATTCTGCAGGTAC-3′,预期扩增产物经RsaⅠ酶切后可得到长度为200 bp的片段。
1.2.2 甘蔗抗褐锈病基因Bru1的PCR检测体系建立
采用北京全式金生物技术公司Easy PureTMplant Genqmic DNA Kit植物DNA提取试剂盒对R1~R5、S1~S5共10份已知基因载体的材料进行叶片总DNA提取,具体方法步骤按照说明书进行,提取后用Eppendorf AG 22331蛋白/核酸分析仪鉴定提取质量。
以抽提的叶片总DNA为模板,采用天根生化科技(北京)有限公司的TaqPCR MasterMix进行PCR扩增。对2个标记PCR扩增反应体系的DNA模板、引物浓度、TaqPCR MasterMix用量、退火温度、循环参数等主要因子分别设多个处理进行优化,筛选出PCR反应体系最佳模式。R12H16标记最佳模式扩增体系25 μL:ddH2O 9.5 μL、2×PCRTaqMix 12.5 μL、DNA模板2.0 μL、上下游引物各0.5 μL(20 μg/μL);9O20-F4标记最佳模式扩增体系25 μL:ddH2O 12.7 μL、2×PCRTaqMix 10.5 μL、DNA模板1.0 μL、上下游引物各0.4 μL(20 μg/μL)。2个标记的PCR扩增程序均为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃延伸5 min。R12H16标记的阳性结果需要通过限制性内切酶RsaⅠ的消化来辨别,即PCR扩增产物直接用1.5%琼脂糖凝胶进行电泳检测;9O20-F4标记的阳性结果需要通过限制性内切酶RsaⅠ的消化来判别,即PCR扩增结束后取PCR产物15 μL、10×NEB buffer 2.5 μL、RsaI(10 000 U)1.0 μL、加ddH2O补足至25 μL 进行酶切。酶切反应程序:37 ℃ 2 h、65 ℃10 min,酶切结束取酶切反应产物10 μL,2%琼脂糖凝胶电泳检测。
1.2.3 生产品种抗褐锈病基因Bru1的 PCR检测
按照1.2.2 建立的扩增体系对22份抗褐锈病生产品种进行抗褐锈病基因Bru1的 PCR检测。
2 结果与分析
2.1 甘蔗基因组DNA提取
采用植物DNA提取试剂盒提取甘蔗基因组DNA并检测A值。所提取的DNA为清晰的一条带,且A260/A280值在1.8~2.0之间,表明提取的DNA质量较好。
2.2 甘蔗抗褐锈病基因Bru1 的PCR检测体系
分别以抗褐锈病基因Bru1的2个特异性标记R12H16和9O20-F4序列为引物,提取的甘蔗DNA为模板,按照1.2.2建立的方法对5份已知含Bru1的抗病材料(R1~R5)和5份感病材料(S1~S5)进行PCR扩增检测和酶切检测。结果显示:5份抗病材料均稳定扩增出2个标记的特异性条带,而5份感病材料未扩出特异性条带(图1),各样品重复检测结果一致,表明2个特异性标记R12H16和9O20-F4均能稳定地检测出抗褐锈病基因Bru1。

图1 5份含Bru1抗病材料(R1~R5)和5份感病材料(S1~S5)的PCR扩增和酶切结果Fig.1 PCR amplification and restriction enzyme analysis of five resistant cultivars containing Bru1 (R1-R5) and five susceptible cultivars (S1-S5)
2.3 生产品种抗褐锈病基因Bru1的 PCR检测
对22份生产品种抗褐锈病基因Bru1的PCR检测结果表明(表1),‘闽糖69-421’、‘闽糖70-611’、‘粤糖 86-368’、‘新台糖10号’、‘新台糖16号’、‘新台糖22号’、‘新台糖25号’、‘桂糖11’、‘桂糖21’、‘云蔗71-388’、‘云蔗81-173’、‘云蔗89-151’、‘云瑞99-601’、‘赣蔗95-108’等14份品种和已知含抗褐锈病基因Bru1的‘R570’扩增出目的条带;‘粤糖93-159’、‘粤糖00-236’、‘德蔗93-94’、‘德蔗93-88’、‘川糖61-408’、‘赣蔗02-70’、‘纳印310’、‘纳印376’等8份品种、感病品种‘选3’均未扩增出目的条带(图2)。

表1 22个生产品种抗褐锈病基因Bru1的 PCR检测结果
续表1 Table 1(Continued)
样品编号Sampleno.品种名称Variety抗病等级Resistancegrade抗病性Resistanceresponse扩增结果Amplificationresult10桂糖11(Guitang11)3中抗(MR)Bru111桂糖21(Guitang21)1高抗(HR)Bru112云蔗71⁃388(Yunzhe71⁃388)1高抗(HR)Bru113云蔗81⁃173(Yunzhe81⁃173)1高抗(HR)Bru114云蔗89⁃151(Yunzhe89⁃151)1高抗(HR)Bru115云瑞99⁃601(Yunri99⁃601)2抗病(R)Bru116德蔗93⁃94(Dezhe93⁃94)2抗病(R)无17德蔗93⁃88(Dezhe93⁃88)2抗病(R)无18川糖61⁃408(Chuantang61⁃408)1高抗(HR)无19赣蔗95⁃108(Ganzhe95⁃108)1高抗(HR)Bru120赣蔗02⁃70(Ganzhe02⁃70)1高抗(HR)无21纳印310(NCO310)1高抗(HR)无22纳印376(NCO376)1高抗(HR)无PCR5701高抗(HR)Bru1NC选3(Xuan3)9高感2(HS2)无
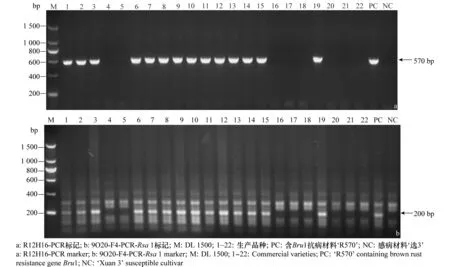
图2 22份生产品种抗褐锈病基因Bru1的PCR扩增和酶切结果Fig.2 PCR detection results of sugarcane brown rust resistance gene Bru1 of 22 commercial varieties
3 结论与讨论
本研究以5个已知含抗褐锈病基因Bru1和5个高感褐锈病的甘蔗品种为试材,通过优化PCR反应体系、酶切体系和循环条件,构建了甘蔗抗褐锈病基因Bru1的分子快速检测体系。经反复验证,该体系能高效、稳定、准确地检测出抗褐锈病基因Bru1,为抗褐锈病甘蔗种质资源的鉴定评价和抗褐锈病甘蔗育种提供了关键技术支撑。采用本研究建立的抗褐锈病基因Bru1分子快速检测体系可以有效地选择甘蔗抗褐锈病基因型,提高选择效率;有助于在甘蔗种质资源及大批量后代材料中高效、准确地筛选抗锈病材料,缩短育种时间,增加抗褐锈病育种的成功率。
22份生产品种抗褐锈病基因Bru1的PCR检测结果显示,‘闽糖69-421’、‘闽糖70-611’、‘粤糖 86-368’、‘新台糖10号’、‘新台糖16号’、‘新台糖22号’、‘新台糖25号’、‘桂糖11’、‘桂糖21’、‘云蔗71-388’、‘云蔗81-173’、‘云蔗89-151’、‘云瑞99-601’、‘赣蔗95-108’等14份抗褐锈病品种含抗褐锈病基因Bru1,它们是选育抗褐锈病甘蔗品种很有利用潜力的育种材料,在大力推广应用的同时,可作为抗病亲本与野生资源杂交,分析评价其抗病遗传力,并建立抗病种质基因库,进一步选育抗褐锈病甘蔗新品种,供生产上推广应用。在甘蔗褐锈病高发蔗区加强‘粤糖 86-368’、‘新台糖22号’、‘新台糖25号’、‘云瑞99-601’、‘赣蔗95-108’等抗褐锈病优良品种的推广应用,可有效控制甘蔗褐锈病大发生流行。
另一方面,8个抗褐锈病品种未检测到抗褐锈病基因Bru1,显示除了Bru1外,可能还有其他抗褐锈病基因存在,有待于进一步深入研究发掘新的抗性基因源,从而克服抗源单一,有选择性增加其他类型抗病基因在抗病育种中的引入与利用,避免由锈菌致病性发生变异引起Bru1抗性丧失的潜在威胁。
[1] 陈庆龙,译.世界甘蔗病害[M].北京:农业出版社,1982:34-40.
[2] CSIRO. Unlocking success through change and innovation:Options to improve the profitability and environmental performance of the Australian sugar industry [M]. Submission to Sugarcane Industry Assessment, 2005.
[3] Rice R W. Florida sugarcane handbook[M]. University of Florida, 2006: 1-3.
[4] Comstock J C. Effect of rust on sugarcane growth and biomass[J]. Plant Disease, 1992, 76(2): 175-177.
[5] Comstock J C, Shine J M, Raid R N. Effect of early rust infection on subsequent sugarcane growth [J]. Sugar Cane,1992(4):7-9.
[6] 马利.泰国甘蔗生产及科研现状[J].世界农业,1995(9):23.
[7] 阮兴业,杨雾,孙楚坚.云南省发现甘蔗蔗茅柄锈菌[J].真菌学报,1983,2(4):260-261.
[8] 全国甘蔗重要病害研究协作组. 我国大陆植蔗省(区)(部分)甘蔗病害种类调查初报[J]. 甘蔗糖业, 1991(1): 1-8.
[9] 刘晓妹, 刘文波, 施焕焕. 海南儋州甘蔗锈病病原菌的鉴定及其生物学特性的测定[J]. 中国糖料, 2008(2): 30-32.
[10]韦金菊,邓展云,黄伟华,等.广西北海甘蔗锈病生物学特性研究及防治对策[J].安徽农业科学,2010,38(27):14997-14999.
[11]黄应昆, 李文凤. 现代甘蔗病虫草害原色图谱[M]. 北京: 中国农业出版社, 2011.
[12]黄应昆,李文凤. 云南蔗区甘蔗锈病流行原因及防治对策[J]. 植保技术与推广, 1998, 18(5): 22-23.
[13]Daugrois J H, Grivet L, Roques D. A putative major gene for rust resistance linked with a RFLP marker in sugarcane cultivar‘R570’[J]. Theoretical and Applied Genetics,1996,92:1059-1064.
[14]Asnaghi C, Roques D, Ruffel S, et al.Targeted mapping of a sugarcane rust resistance gene (Bru1) using bulked segregant analysis and AFLP markers [J]. Theoretical and Applied Genetics, 2004,108:759-764
[15]Costet L, Le Cunff L, Royaert S, et al. Haplotype structure aroundBru1 reveals a narrow genetic basis for brown rust resistance in modern sugarcane cultivars [J]. Theoretical and Applied Genetics, 2012,125(5):825-836.
[16]Chu T L. 抗黑顶柄锈菌甘蔗田间品种反应的鉴定[J]. 国外农学—甘蔗, 1983(2): 53-54.
[17]Chu T L. 甘蔗对锈病的品种抗性和感病性的遗传动态[J]. 国外农学—甘蔗,1983(3): 49-53.
[18]李文凤, 蔡青, 黄应昆,等. 甘蔗野生资源对蔗茅柄锈菌的抗性鉴定[J]. 植物保护, 2005,31(2): 51-53.
[19]李文凤,蔡青,黄应昆,等.甘蔗优良亲本及创新种质对蔗茅柄锈菌的抗性鉴定[J].中国糖料,2007(4):10-12.
[20]李文凤, 蔡青, 黄应昆,等. 甘蔗栽培原种对蔗茅柄锈菌的抗性鉴定[J]. 云南农业大学学报, 2008(1): 25-28.
Establishment and application of molecular detection approach for sugarcane brown rust resistance geneBru1
Li Wenfeng, Wang Xiaoyan, Huang Yingkun, Zhang Rongyue,Shan Hongli,Yin Jiong,Shen Ke,Luo Zhiming
(Sugarcane Research Institute, Yunnan Academy of Agricultural Sciences, Yunnan Key Laboratory of Sugarcane Genetic Improvement, Kaiyuan 661699, China)
In order to establish an efficient, rapid and accurate method for sugarcane brown rust resistance identification, and improving the breeding efficiency of brown rust resistance. In this study, five well-known cultivars containing brown rust resistance geneBru1 and five cultivars showing high susceptibility to brown rust were used as testing materials. The molecular detection approach for sugarcane brown rust resistance geneBru1 was established by optimizing the PCR reaction system, enzymatic system and cycling conditions. After repeated test and verification, this approach could effectively, stably and accurately detect sugarcane brown rust resistance geneBru1. The PCR detection results of sugarcane brown rust resistance geneBru1 of 22 commercial cultivars showed thatBru1 was detected in 14 resistant cultivars, including ‘Mintang 69-421’,‘ Mintang 70-611’,‘ Yuetang 86-368’, ‘ROC10’, ‘ROC16’, ‘ROC22’, ‘ROC25’, ‘Guitang 11’, ‘Guitang 21’, ‘Yunzhe 71-388’, ‘Yunzhe 81-173’,‘ Yunzhe 89-151’, ‘Yunri 99-601’ and ‘Ganzhe 95-108’. The geneBru1 was not detected in the other 8 resistant cultivars. These results can provide critical technique and elite resistance resources for selection and breeding of brown rust resistance, popularizing elite resistant varieties and effectively controling sugarcane brown rust disease.
sugarcane brown rust disease; resistance geneBru1; molecular detection
2014-03-03
2014-06-19
国家现代农业产业技术体系(CARS-20-2-2);云南省现代农业产业技术体系;云南省科技计划项目(2013BB013)。
S 435.661
A
10.3969/j.issn.0529-1542.2015.02.021
* 通信作者 E-mail: huangyk64@163.com
