双重PCR检测马铃薯晚疫病和环腐病方法的建立
2015-11-25刘秀丽张金文张俊莲
刘秀丽, 庞 博, 张金文*, 王 蒂*, 张俊莲
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃农业大学农学院,兰州 730070;2. 陇东学院生命科学与技术学院,庆阳 745000)
双重PCR检测马铃薯晚疫病和环腐病方法的建立
刘秀丽1,2, 庞 博1, 张金文1*, 王 蒂1*, 张俊莲1
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃农业大学农学院,兰州 730070;2. 陇东学院生命科学与技术学院,庆阳 745000)
通过克隆马铃薯环腐病菌和晚疫病菌转录间隔区(ITS)序列,并对测序结果进行同源性比较,选取差异位点分别设计了两对引物 P.IN1/P.IN2和C.IN1/C.IN2,并检测了引物的特异性及方法的灵敏度。引物 P.IN1/P.IN2可扩增出1 条 363 bp 马铃薯晚疫病菌的特异性条带,在 DNA 水平上其灵敏度达18 fg/μL;引物C.IN1/C.IN2可扩增出1条218 bp 马铃薯环腐病菌的特异性条带,在细菌数上检测灵敏度为104cfu/mL。混合这两对引物构建双重PCR反应体系,能从马铃薯环腐病菌和晚疫病菌的混合 DNA 及感染这两种菌的马铃薯植株中同时扩增到 363 bp和218 bp的特异片段。实现了同时对马铃薯晚疫病菌和环腐病菌的快速可靠检测。
马铃薯; 双重PCR; 马铃薯晚疫病菌; 马铃薯环腐病菌
马铃薯晚疫病菌(Phytophthorainfestans)和环腐病菌(Clavibactermichiganensissubsp.sepedonicum)是马铃薯生产上可造成毁灭性破坏的两大病害,均可致种薯带有肉眼无法诊查的潜伏侵染,这样的种薯种植后,常造成马铃薯烂种、死苗,储藏期间还可导致烂窖,给农户造成严重的经济损失。在马铃薯病害的预防方面,对种薯的病原检测是一项重要的工作。在传统栽培中,一般仅是在播种之前淘汰肉眼能够看到的烂薯,实际上对潜伏病原的种薯根本无法彻底根除。因此寻找一种快速、灵敏、准确的检测方法对保证马铃薯种薯的质量以及预防晚疫病病菌和环腐病菌的蔓延具有重要的意义。
植物学家对这两种病原菌的分子检测进行了研究,取得了一定的成果。2000年Judelson等[1]根据晚疫病菌全基因组中33段DNA重复序列的08序列设计出的 08-3 和 08-4 引物对晚疫病菌具有很强的特异性和较高的灵敏度。随后,2004 年徐安传等[2]将这对引物,通过 PCR技术直接应用到了马铃薯种薯的带菌检测上,进一步证明了该引物的特异性和灵敏度以及它的实际应用价值。在马铃薯环腐病菌检测方面,1997 年 Mills 等[3]通过消减杂交技术获得环腐病菌株特异性序列并设计引物达到对其进行分子检测的目的。2011 年韩广涛等[4]针对马铃薯环腐病菌 pCS1 质粒上的纤维素酶A 基因序列设计特异性引物,与已经报道过的马铃薯黑胫病菌特异性引物[5]组合建立双重 PCR 体系,达到在短时间内能够同时检测两种病原的目的。而双重 PCR 技术已经在很多作物的病原检测中得到了应用,包括小麦条纹花叶病毒和小麦花叶病毒的检测[6]、水稻白叶枯病菌和细菌性条斑病菌的检测[7]、洋葱黄矮病毒和葱潜隐病毒的检测[8]以及马铃薯晚疫病菌和青枯病菌的检测[9]等。本研究利用细菌和真菌的内转录间隔区序列在种间变异和种内稳定的特点,克隆出马铃薯晚疫病菌的内转录间隔区(ITS)序列和马铃薯环腐病菌的 16S-23S 间隔区序列,并设计针对马铃薯晚疫病菌和环腐病菌的特异性引物,构建双重 PCR 体系,达到在同一反应中可以特异、灵敏地检测两种病原菌的目的,以期为这两种病害的预防及有效的防控提供可靠依据。
1 材料与方法
1.1 供试菌株及材料来源
本研究选用来自于甘肃省渭源县的马铃薯晚疫病菌及感染晚疫病植株,来自于甘肃省陇南的感染环腐病菌的马铃薯植株以及来自于甘肃省农科院植保所和甘肃农业大学农学院实验室的其他参试真菌和细菌进行测定。本研究所用到的接种病原物的马铃薯均系用菌悬液侵染新鲜马铃薯块茎切片所得,直到在块茎上可观察到明显感病症状。
1.2 菌株培养及 DNA 的提取
晚疫病菌的培养采用黑麦培养基[10],马铃薯环腐病菌培养采用肉汁胨培养基(BPA)[4]。其他供试真菌使用马铃薯葡萄糖培养基培养。基因组的提取根据萨姆布鲁克编著的《分子实验指南》并稍作改良,真菌菌丝体和马铃薯发病叶片中DNA的提取采用改良的 CTAB 法,马铃薯发病块茎和细菌DNA采用 SDS 法提取。
1.3 ITS区段的克隆及引物的设计
根据 GenBank 数据库中马铃薯晚疫病菌和马铃薯环腐病菌的基因组信息,设计引物扩增晚疫病菌 18S 和 28S 之间包含 ITS1 和 ITS2 两个内转录间隔区的片段和环腐病菌 16S 和 23S 之间间隔区的片段。反应体系均为 25 μL:含 2.5 μL 10×PCR buffer (Mg2+Plus),0.8 mmol/L dNTP,1.0 U TaKaRaTaqDNA 聚合酶,0.2 μmol/L引物,100 ng DNA 模板,不足部分由无菌超纯水补足。在 TProfessional PCR 仪(Biometra)上按以下程序扩增:94 ℃ 5 min;94 ℃ 40 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃ 10 min。扩增结束后取 5.0 μL PCR 产物于 2%琼脂糖凝胶电泳,在凝胶成像系统上检测并拍照。
回收 PCR 扩增产物连接载体 pMD19-T vector,转化大肠杆菌感受态细胞,筛选出阳性克隆,送北京华大工程有限公司测序。用 DNAMAN 软件及 NCBI-BLAST 功能对测序结果进行同源性比较,选取差异位点设计检测马铃薯环腐病菌和晚疫病菌的引物。
1.4 引物的特异性检测
用所设计的引物对参试菌株的基因组 DNA 进行扩增,优化 PCR 反应参数,包括退火温度、循环次数及延伸时间,并检测引物的特异性。最终 PCR 反应体系为 25 μL:包括2.5 μL 10×PCR buffer (Mg2+Plus), 0.4 mmol/L dNTP,0.75 U TaKaRaTaqDNA 聚合酶,0.2 μmol/L引物,25 ng DNA模板,不足部分由无菌超纯水补足。扩增程序为:94 ℃ 5 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 40 s,30 个循环; 72 ℃ 10 min。扩增结束后取 5.0 μL PCR 产物于2%琼脂糖凝胶电泳,在凝胶成像系统上检测并拍照。
1.5 引物灵敏性检测
1.5.1 引物P.IN1/P.IN2对晚疫病菌DNA的灵敏度检测
采用10倍梯度稀释法将提取的晚疫病菌纯DNA稀释成1.8 μg/μL、180 ng/μL、18 ng/μL、1.8 ng/μL、180 pg/μL、18 pg/μL、1.8 pg/μL、180 fg/μL、18 fg/μL和1.8 fg/μL共10种不同浓度梯度,测定引物P.IN1/P.IN2检测晚疫病原菌的灵敏度。反应体系及反应程序同1.4。
1.5.2 引物 C.IN1/C.IN2 对马铃薯环腐病菌悬浮液的灵敏性检测
采用 10 倍梯度稀释法, 将马铃薯环腐病菌悬浮液稀释成 1011、1010、109、108、107、106、105、104、 103、102cfu/mL共 10 种不同浓度梯度,测定引物 C.IN1/C.IN2检测环腐病菌的灵敏度。PCR 反应体系、扩增程序同 1.4。
1.6 双重 PCR 体系的建立
1.6.1 双重 PCR 体系的建立
把设计的检测马铃薯晚疫病菌、环腐病菌的2对特异引物混合,构建双重 PCR 体系。对双重 PCR体系中的退火温度、循环次数、dNTP 浓度、酶量这4个参数设置单个因素梯度,在不改变其他因素条件下,分别对 PCR 反应体系中的各组分进行梯度试验,比较不同处理对扩增结果的影响。退火温度从 56~65 ℃变化10个温度,循环次数从25~35次变化10个梯度,dNTP浓度设置 0.4、0.6、0.8、1.0、1.2 mmol/L 5个浓度梯度,50 μL体系中酶量设置1、1.25、1.5、1.75、2.0 U 5个酶量梯度。设置2对引物在0.1、0.2、0.3 μmol/L 3个浓度水平上的组合试验,筛选双重PCR反应体系中引物的最佳配比方案。
1.6.2 双重PCR体系的特异性检测
应用P.IN1/P.IN2 和C.IN1/C.IN2 及建立并优化的双重 PCR 体系对晚疫病菌和环腐病菌及其他参试菌株进行扩增,检测双重 PCR 反应体系对马铃薯晚疫病菌和环腐病菌的特异性。反应体系及反应程序同 1.6.1。
1.6.3 双重PCR体系对感病马铃薯植株的检测
提取感染环腐病和晚疫病的马铃薯植株或薯块的DNA,应用P.IN1/P.IN2和C.IN1/C.IN2 及建立的双重 PCR 体系,进行双重 PCR 检测。
2 结果与分析
2.1 马铃薯晚疫病菌和环腐病菌 ITS 区段克隆及特异性引物的设计
根据 GenBank 数据库中马铃薯环腐病菌和晚疫病菌的基因组信息,利用 Primer 软件设计引物克隆晚疫病菌 18S 和28S 之间包含 ITS1 和 ITS2 两个内转录间隔区的片段,长 868 bp;克隆环腐病菌 16S 和23S 之间间隔区的片段,长 708 bp。克隆结果见图1,电泳检测条带大小与预期相符。
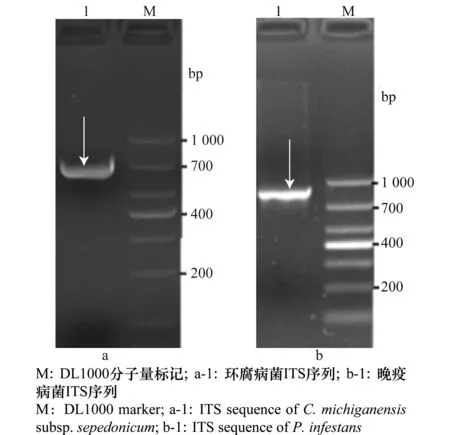
图1 马铃薯晚疫病菌和环腐病菌ITS序列的PCR扩增Fig.1 PCR products of ITS sequences of P.infestans and C.michiganensis subsp. sepedonicum
回收 DNA 并测序,结合 DNAMAN、Oligo、Primer 5.0及NCBI-BLAST功能对测序结果进行同源性比较,选取差异位点分别设计检测马铃薯环腐病菌和晚疫病菌的特异引物 C.IN1/C.IN2、P.IN1/P.IN2(表1),用于构建双重 PCR。

表1 本研究中双重 PCR 所用的引物
2.2 引物的特异性检测
以设计的检测马铃薯晚疫病菌和环腐病菌的特异引物 P.IN1/P.IN2、C.IN1/C.IN2 分别对马铃薯晚疫病菌和马铃薯环腐病菌以及参试的其他细菌和真菌进行 PCR 扩增,结果表明,只有在马铃薯晚疫病菌及其感染的马铃薯植株中能产生一条 363 bp 的条带(图2),只有在马铃薯环腐病菌及其感染的马铃薯植株中能产生一条218 bp 的条带(图3),其他参试菌株无扩增产物。说明这2对引物在该反应体系下分别对马铃薯晚疫病菌和环腐病菌具有较强的特异性。

图2 引物 P.IN1/P.IN2的特异性分子检测Fig.2 The specificity of the primers P.IN1/ P.IN2 in molecular detection

图3 引物 C.IN1/C.IN2的特异性分子检测Fig.3 The specificity of the primers C.IN1/ C.IN2 in molecular detection
2.3 引物的灵敏度检测
2.3.1 引物P.IN1/P.IN2的灵敏度
将提取的马铃薯晚疫病菌DNA浓度从1.8 μg/μL依次稀释10倍至1.8 fg/μL,分别取1 μL模板扩增,反应体系、反应程序同1.4,测定引物的灵敏度。结果(图4)表明,该PCR反应的最小检测浓度为18 fg/μL。

图4 引物P.IN1/P.IN2对晚疫病菌的灵敏度Fig.4 The sensitivity of the primers P.IN1/P.IN2 in molecular detection of P.infestans
2.3.2 引物C.IN1/C.IN2的灵敏度
将马铃薯环腐病菌悬浮液浓度从 1011cfu/mL依次稀释 10 倍至 102cfu/mL,利用 1.4 中的 PCR 反应体系、反应程序,对引物灵敏度进行测定。结果(图5)表明,该 PCR 反应的最小检测浓度为 104cfu/mL。

图5 引物 C.IN1/C.IN2 对环腐病菌悬浮液的灵敏度Fig.5 The sensitivity of the primers C.IN1/C.IN2 in molecular detection of C.michiganensis subsp. sepedonicum
2.4 双重 PCR 体系建立
分别以马铃薯晚疫病菌和环腐病菌的单一 DNA 以及2 种菌的混合 DNA 为模板,同时加入2 对引物进行扩增,对双重PCR体系中的退火温度、循环次数、dNTP浓度、酶的用量和2对引物的浓度等参数进行优化,最终优化PCR反应体系为25 μL:含2.5 μL 10×PCR buffer (Mg2+),0.1 mmol/L dNTP,0.75 U TaKaRaTaqDNA 聚合酶(大连宝生物工程有限公司),0.2 μmol/L引物,DMSO 0.3 μL,不足部分由无菌超纯水补足。最终优化的程序为:94 ℃ 5 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 40 s, 30个循环;72 ℃ 10 min。结果表明,该系统从单一菌株DNA和混合菌株DNA中均能灵敏准确地检测出马铃薯晚疫病菌(363 bp)和环腐病菌(218 bp)(图6)。

图6 双重引物 P.IN1/P.IN2、C.IN1/C.IN2对晚疫病菌和环腐病菌的 PCR 检测Fig.6 PCR detection of P.infestans and C.michiganensis subsp. sepedonicum by using P.IN1/P.IN2 and C.IN1/C.IN2
2.5 双重PCR体系的特异性
利用 1.6.1 中的PCR反应体系、反应程序,以马铃薯环腐病菌、晚疫病菌单一DNA,马铃薯环腐病菌和晚疫病菌混合DNA,感染马铃薯环腐病菌、晚疫病菌的马铃薯组织DNA及其他参试菌株DNA为模板,结果显示(图7)两种病原菌混合DNA及两种病原菌侵染的马铃薯DNA的检测中可检测到363 bp和218 bp的2条条带;在马铃薯晚疫病菌、环腐病菌单一DNA及分别感染晚疫病菌和环腐病菌的马铃薯组织中,可以分别检出晚疫病菌和环腐病菌的单一特异性条带,而以健康马铃薯及其他供试菌株DNA为模板进行的扩增,没有出现任何条带。
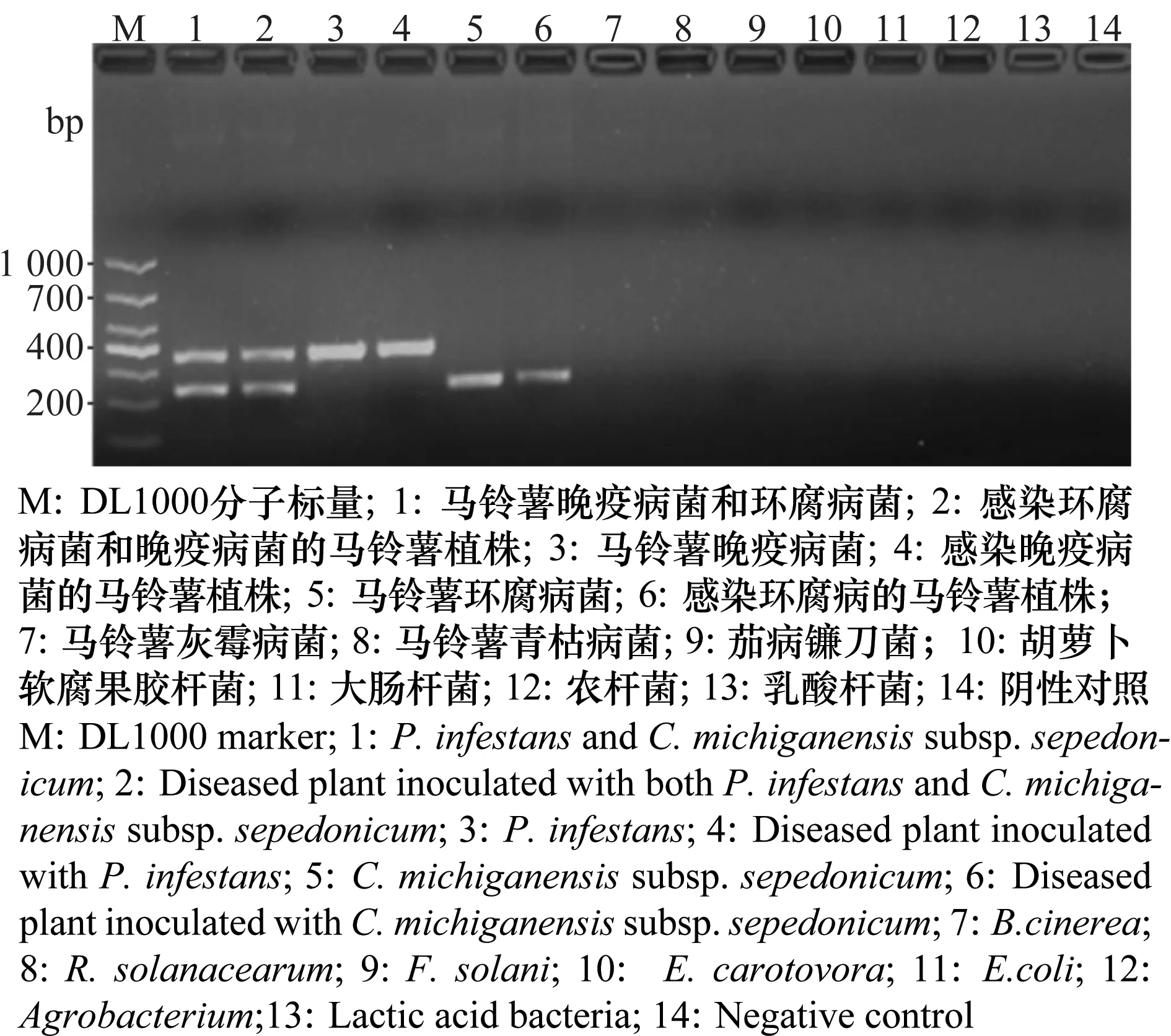
图7 双重PCR的特异性检测Fig.7 Specificity test of duplex PCR
2.6 双重PCR对感病马铃薯植株的检测
对接种了马铃薯环腐病菌和晚疫病菌的马铃薯植株以及根据症状选取的天然感病植株提取DNA,按照1.6.1的反应体系和反应程序,用双重引物P.IN1/P.IN2、C.IN1/C.IN2进行PCR扩增。结果显示(图8),从感染马铃薯环腐病和晚疫病的植株中均可扩增出218 bp和363 bp的特异性条带,从分别感染其中一种病原菌的马铃薯植株中,均能检测到相对应的218 bp或363 bp的特异性条带。

图8 双重PCR对感病马铃薯的检测Fig.8 Duplex PCR detection of diseased potatoes
3 讨论
核糖体基因转录间隔区ITS是自Gonzalea 1990年提出后逐步发展起来的全新的分子标记,其优点在于:①具有高拷贝数;②同时包含保守和变异序列;③能根据保守序列中的变异位点设计特殊引物进行特异性扩增[11]。近几年,利用ITS序列设计引物在棉花、番茄、西瓜等作物的病害的检测中得到了广泛的应用[12]。同时,利用细菌16S-23S rDNA序列对微生物进行种属分析的研究也有很多相关的报道[13-14],该段DNA序列的多态性弥补了16S序列高保守、分化程度不强的缺陷[15]。本研究通过对马铃薯晚疫病菌ITS序列和马铃薯环腐病菌16S-23S rDNA间隔区序列进行克隆,根据测序结果进行序列分析并设计引物,同时利用相关软件分析来确保引物的特异性,最终建立双重PCR检测体系,并对反应体系的各参数,包括退火温度、引物浓度、dNTP浓度、循环次数等进行优化,达到通过一个反应同时对两种病原菌进行高特异性、高灵敏度的检测。根据马铃薯晚疫病菌ITS序列设计的引物P.IN1/P.IN2可以针对马铃薯晚疫病菌特异地扩增出一条363 bp的片段,该引物的检测灵敏度在DNA水平上可达18 fg/μL。根据马铃薯环腐病菌16~23S间隔区设计的引物C.IN1/C.IN2可以针对马铃薯环腐病菌特异性地扩增出一条218 bp的片段,该引物的检测灵敏度可达104cfu/mL。由这两种引物构建的双重PCR体系对马铃薯环腐病菌和晚疫病菌混合DNA、感染环腐病菌和感染晚疫病菌马铃薯植株进行检测,都同时或分别得到了363 bp和218 bp的片段,而健康马铃薯植株无扩增产物。说明该检测体系成功地通过一个反应达到对两种病原菌的检测,为马铃薯晚疫病和环腐病的诊断和预防提供了技术支撑,同时也为其他作物的病原检测技术的开发提供了参考。
[1] Judelson H S, Tooley P W. Enhanced polymerase chain reaction methods for detecting and quantifyingPhytophthorainfestansin plants [J]. Phytopatholgy,2000, 90: 1112-1119.
[2] 徐安传,罗文富,杨艳丽,等. 马铃薯晚疫病种薯带菌的分子检测[J]. 中国马铃薯,2004,18 (2): 73-76.
[3] Mills D, Russell B W, Hanus J W. Specific detection ofClavibactermichiganensissubsp.sepedonicusby amplification of three unique DNA sequences isolated by subtraction hybridization [J]. Phytopathology, 1997, 87(8): 853-861.
[4] 韩广涛,杨志辉,朱杰华,等. 双重PCR技术检测马铃薯环腐病菌和黑胫病菌方法的建立[J].中国农业科学,2011,44(20):4199-4206.
[5] De Boer S H, Ward L J. PCR detection ofErwiniacarotovorasubsp.atrosepticaassociated with potato tissue [J]. Phytopathology, 1995, 85(8): 854-858.
[6] Price J A, Smith J, Simmons A, et al. Multiplex real-time RT-PCR for detection ofWheatstreakmosaicvirusandTritcummosaicvirus[J]. Journal of Virological Methods,2010, 165(2): 198-201.
[7] 张华. 水稻白叶枯病菌和细菌性条斑病菌的分子检测技术研究[D]. 南京: 南京农业大学,2004.
[8] Majumder S, Baranwal V K, Joshi S. Simultaneous detection ofOnionyellowdwarfvirusandShallotlatentvirusin infected leaves and cloves of garlic by duplex RT-PCR [J]. Journal of Plant Pathology,2008, 90(2): 371-374.
[9] 陈庆河,李本金,兰成忠,等. 双重 PCR检测马铃薯晚疫病菌和青枯病菌方法的建立及应用[J].植物病理学报,2009, 39(6): 578-583.
[10]李惠霞,刘永刚,王蒂,等. 马铃薯晚疫病菌培养条件的研究[J].中国马铃薯,2007,21(4):203-205.
[11]刘春来,文景芝,杨明秀,等. rDNA-ITS在植物病原真菌分子检测中的应用[J].东北农业大学学报,2007,38(1):101-106.
[12]王国芬,彭军,代鹏,等. 香蕉枯萎病镰刀菌ITS序列的PCR扩增及其分子检测[J].华南热带农业大学学报,2007,13(3):1-5.
[13]傅君芬,卢美萍,尚世强,等.16S-23S rRNA基因区间细菌鉴定实验研究[J].浙江大学学报(医学版),2002,31(6):448-452.
[14]傅君芬,徐美春,尚世强,等.应用 16S-23S rRNA 基因区间对败血症常见菌的鉴定[J]. 中华传染病杂志,2002,20(5):261-264.
[15]刘裕田. 分枝杆菌 16S-23S r RNA 基因转录间隔区序列分析的研究[D]. 沈阳:沈阳农业大学,2007.
Development of duplex PCR assay for detection of PhytophthorainfestansandClavibactermichiganensissubsp.sepedonicum
Liu Xiuli1,2, Pang Bo1, Zhang Jinwen1, Wang Di1, Zhang Junlian1
(1.Gansu Key Laboratory of Crop Improvement & Germplasm Enhancement,Gansu Provincial Key Laboratory of Aridland Crop Science,College of Agronomy, Gansu Agricultural University, Lanzhou 730070, China; 2. College of Life Science and Technology, Longdong University, Qingyang 745000, China)
Based on cloning and analysis of the internal transcribed spacer (ITS) sequences ofPhytophthorainfestansandClavibactermichiganensissubsp.sepedonicum,two specific pairs of primer, P.IN1/P.IN2 and C.IN1/C.IN2, were designed to establish a duplex PCR system, with the optimized PCR parameters to ensure the sensitivity and specificity. The system could simultaneously detect the two pathogens of potato. Using P.IN1/P.IN2, a single unique PCR band of 363 bp was amplified fromP.infestansand the sensitivity was 18 fg/μL of DNA. Using C.IN1/C.IN2, a single unique PCR band of 218 bp was amplified fromC.michiganensissubsp.sepedonicumand the sensitivity was 104cfu/mL of bacteria. With the duplex PCR system, the 363 bp and 218 bp PCR bands fromP.infestansandC.michiganensissubsp.sepedonicumcould be specifically amplified. So a duplex PCR system has been developed for simultaneously and rapidly detectingP.infestansandC.michiganensissubsp.sepedonicum.
potato; duplex PCR;Phytophthorainfestans;Clavibactermichiganensissubsp.sepedonicum
2014-02-23
2014-06-11
甘肃省科技重大专项(1102NKDA025 );国家自然科学基金(31260343)
S 435.32
A
10.3969/j.issn.0529-1542.2015.02.020
* 通信作者 E-mail:jwzhang305@163.com; wangd@gsau.edu.cn
