黄瓜绿斑驳花叶病毒山西西瓜分离物外壳蛋白基因序列分析
2015-11-25成媛媛牛二波牛颜冰
杜 江, 成媛媛, 牛二波, 牛颜冰
(山西农业大学生命科学学院,太谷 030801)
黄瓜绿斑驳花叶病毒山西西瓜分离物外壳蛋白基因序列分析
杜 江, 成媛媛, 牛二波, 牛颜冰*
(山西农业大学生命科学学院,太谷 030801)
通过病毒dsRNA分离技术、非序列依赖性PCR扩增(sequence-independent amplification, SIA)技术和RT-PCR等手段对采自山西太谷的西瓜病样进行了检测与鉴定,确定其为黄瓜绿斑驳花叶病毒(Cucumbergreenmottlemosaicvirus,CGMMV)所侵染。为明确CGMMV西瓜分离物(CGMMV-SXTG)的分类地位,本研究进一步克隆了CGMMV-SXTG的外壳蛋白基因(coat protein, CP)全序列并进行序列分析,系统进化树分析显示该分离物与亚洲分离物亲缘关系较近,而与欧洲分离物亲缘关系较远,表明该病毒的不同分离物在分组上可能与地域有一定的关系;接着对不同分离物的CP基因核苷酸序列和氨基酸序列进行同源性比对分析,结果表明该分离物与中国山东分离物(TANG)同源性最高,分别达到99.8%和99.6%。
黄瓜绿斑驳花叶病毒; 序列分析; 外壳蛋白基因
黄瓜绿斑驳花叶病毒(Cucumbergreenmottlemosaicvirus,CGMMV)是一种正单链RNA病毒,直杆状,大小为300 nm×18 nm,属烟草花叶病毒属(Tobamovirus)[1]。其危害多种葫芦科作物,是我国农业植物检疫性有害生物[2]。1935年,英国Ainsworth[3]首次报道了黄瓜绿斑驳花叶病毒危害黄瓜。我国自2004年首次从日本进口的南瓜种子中截获CGMMV以来已发生多起进口源性CGMMV[4],2005年,广西农业科学院从广西某农业展示中心观赏南瓜的叶片上分离到了CGMMV[5];2006年,陈红运等[6]从辽宁西瓜上检测到CGMMV;2007年,李红霞等[7]在甘肃南瓜上检测到CGMMV;2008年,秦碧霞等[8]从广西葫芦上检测到CGMMV;2009年,田永蕾等[9]又在北京甜瓜及山东西瓜上检测到CGMMV。
黄瓜绿斑驳花叶病毒严重危害葫芦科植物,不仅影响植物的正常生长,还给农民带来了巨大的经济损失。西瓜果实感染黄瓜绿斑驳花叶病毒后,种子周围的果肉变为紫红色或暗红色水渍状,成熟时变为暗褐色并出现空洞,呈丝瓜瓤状,俗称“血果肉”。严重时,变色部位软化溶解,呈脱落状,味苦不能食用,失去经济价值[10]。山西太谷西瓜闻名三晋,种植面积一度在全国达到最大,有1.73万hm2,成为当地农民增加收入、促进农村发展的重要产业之一。2013年笔者在山西太谷西瓜地发现疫情,发病率高达90%,病株绿色叶面上具有浅黄、浅绿相间的斑纹,或是叶片皱缩、卷曲。将明显花叶和蕨叶症状的病样采回,应用分子生物学方法,对其进行了病毒分离检测与鉴定,确定其被CGMMV所侵染,对CGMMV的外壳蛋白基因(CP)进行了克隆、测序与序列分析,为研究CGMMV的基因遗传和变异提供理论依据。
1 材料与方法
1.1 材料
病毒病样:病样叶片采集于山西太谷西瓜地,具有典型的花叶症状(图1)。

图1 病毒病在西瓜叶片上表现的症状Fig.1 Symptoms on leaves of watermelon infected by virus
主要试剂:莫洛尼鼠白血病病毒逆转录酶(M-MLV)购自Promega公司;Ribonuclease Inhibitor核酸酶抑制剂购自TaKaRa公司;克隆载体pUCm-T、Taqplus DNA polymerse和琼脂糖凝胶DNA回收试剂盒等购自上海生工(Sangon Biotech)公司。
引物设计与合成:本试验中所用的引物269和177由南京农业大学植保学院陶小荣老师惠赠,M4T为本实验室所有;根据GenBank数据库中公布的CGMMV基因组全序列(GenBank登录号AF417242)设计特异引物(XG-CP-F/R),序列如表1所示,由上海生工(Sangon Biotech)公司合成。

表1 PCR扩增所用引物序列1)
1)N=A,T,C or G。
1.2 方法
1.2.1 植物病原双链RNA(dsRNA)的提取
参照牛颜冰等[11-12]和Tzanetakis等[13]的方法并加以改进,提取dsRNA。
1.2.2 非序列依赖性扩增(SIA)检测
以提取的病样dsRNA为模板,随机锚定引物269为反转录引物进行反转录获得cDNA第一链,然后采用锚定引物177进行PCR扩增。
反应结束后,进行琼脂糖凝胶电泳检测。
1.2.3 特异引物PCR检测
以提取的病样dsRNA为模板,M4T为反转录引物进行反转录获得cDNA第一链,然后采用特异引物XG-CP-F/R进行PCR扩增。
反应结束后,进行琼脂糖凝胶电泳检测。
1.2.4 PCR产物克隆及序列分析
利用琼脂糖凝胶回收试剂盒回收目的片段,并将其与克隆载体pUCm-T进行连接转化,阳性克隆通过PCR和酶切鉴定后送至上海生工公司进行测序。登录GenBank对所得序列利用BLAST进行检索,结合NCBI-GenBank部分共享数据,利用DNAMAN软件将所测序列与已报道的分离物序列进行核苷酸序列、氨基酸序列的同源性比较分析,运用MEGA 4.1软件构建系统进化树,以同属的小西葫芦绿斑驳花叶病毒 (Zucchinigreenmottlemosaicvirus,ZGMMV)为外群。
2 结果与分析
2.1 SIA检测
以提取的dsRNA为模板,269/177为引物进行SIA鉴定,扩增产物进行琼脂糖凝胶电泳后得到大小为1 000 bp 左右的片段,而健康样品中未扩增出任何片段(图2)。经克隆、测序和序列比对发现,该部分序列与NCBI中多种黄瓜绿斑驳花叶病毒分离物相似度在88%~99%之间,其中与分离物JSHZ12(KC852073)、KW(AF417242)、TANG(HM008919)和C(FJ654658)相似度达到99%,由此初步认定其为CGMMV。

图2 西瓜病毒病SIA检测电泳图Fig.2 Electrophoresis of SIA products of watermelon virus
2.2 特异引物PCR检测
为了进一步明确引起西瓜病毒病病原的种类和分类地位,以提取的dsRNA为模板,M4T为反转录引物,XG-CP-F/R为PCR引物,进行特异引物PCR检测,扩增产物经琼脂糖凝胶电泳检测,得到大小为875 bp的目的片段,而健康样品中未扩增出片段(图3)。经序列比对分析,发现该部分序列与NCBI中多种CGMMV分离物同源性在91%~99%之间。说明西瓜病毒病为CGMMV侵染所致,并将该分离物命名为CGMMV-SXTG。

图3 特异引物扩增电泳图Fig.3 Electrophoresis of PCR products by specific primers
2.3 同源性与系统进化树分析
在GenBank上选择不同地区的23个CGMMV分离物,利用DNAMAN软件对这些分离物CP基因进行核苷酸序列和氨基酸序列同源性比对分析(表2)。结果表明,CGMMV-SXTG CP基因核苷酸序列与氨基酸序列同CGMMV其他株系序列同源性都高于90%,而与ZGMMV代表株系的序列同源性远远低于90%。对这些分离物CP基因的核苷酸序列进行系统进化树构建的结果见图4。
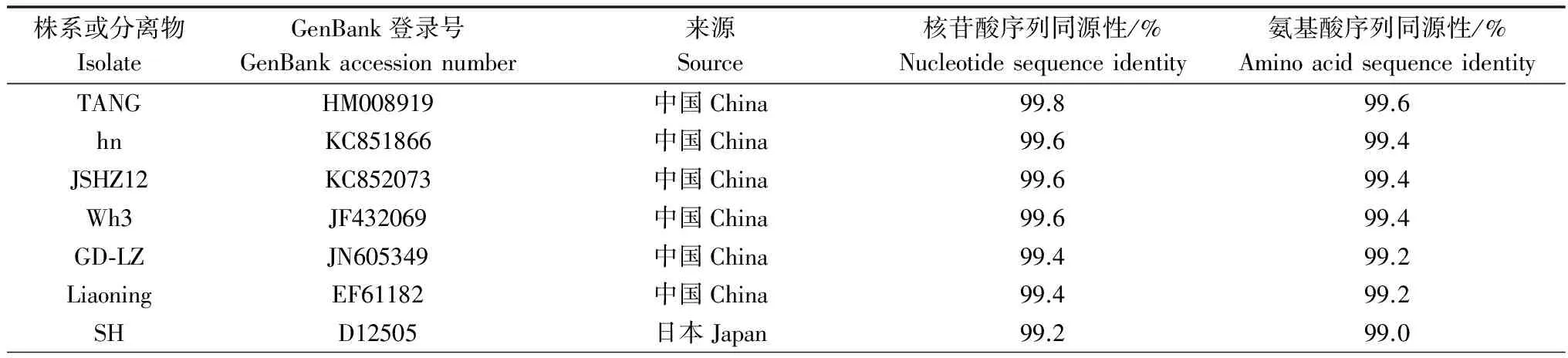
表2 CGMMV-SXTG CP 与已报道的CGMMV分离物核苷酸与氨基酸的相似性比对分析
续表2 Table 2(Continued)
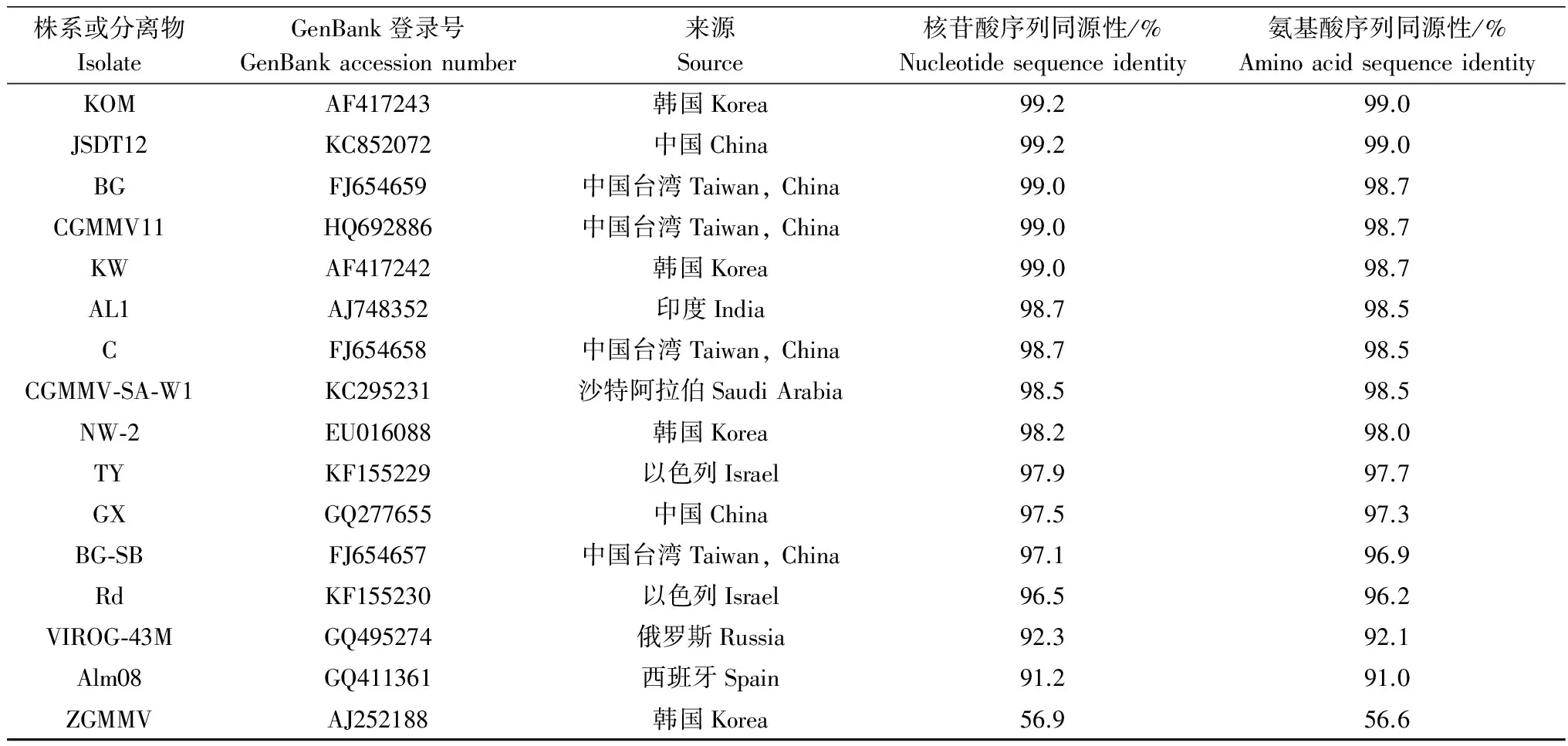
株系或分离物IsolateGenBank登录号GenBankaccessionnumber来源Source核苷酸序列同源性/%Nucleotidesequenceidentity氨基酸序列同源性/%AminoacidsequenceidentityKOMAF417243韩国Korea99.299.0JSDT12KC852072中国China99.299.0BGFJ654659中国台湾Taiwan,China99.098.7CGMMV11HQ692886中国台湾Taiwan,China99.098.7KWAF417242韩国Korea99.098.7AL1AJ748352印度India98.798.5CFJ654658中国台湾Taiwan,China98.798.5CGMMV⁃SA⁃W1KC295231沙特阿拉伯SaudiArabia98.598.5NW⁃2EU016088韩国Korea98.298.0TYKF155229以色列Israel97.997.7GXGQ277655中国China97.597.3BG⁃SBFJ654657中国台湾Taiwan,China97.196.9RdKF155230以色列Israel96.596.2VIROG⁃43MGQ495274俄罗斯Russia92.392.1Alm08GQ411361西班牙Spain91.291.0ZGMMVAJ252188韩国Korea56.956.6

图4 CGMMV-SXTG和其他相关病毒外壳蛋白核苷酸序列的系统进化树分析Fig.4 Phylogenetic tree analysis on nucleotide sequences of CGMMV-SXTG and other reported isolates
3 讨论
本试验首先通过非序列依赖性PCR扩增(SIA)技术,对染病西瓜进行病毒病病原的分子鉴定,序列分析发现染病症状是由CGMMV侵染所致。SIA技术是将随机引物加入dsRNA中,该引物5′端含有20个固定序列的核苷酸,3′端含有核苷酸随机简并序列,在逆转录酶的作用下延伸。在PCR延伸过程中加入固定序列部分作为引物,将扩增产物进行电泳分析、克隆和测序[14]。SIA的特点是试验时间短,步骤简单,得到病毒拷贝数高,不需特定试剂。
为了进一步确定CGMMV-SXTG的分类地位和进化关系,在SIA检测的基础上,依据待测病毒的保守序列设计引物,采用RT-PCR技术扩增该病毒的CP全序列,并将其测定结果进行同源关系和系统进化分析。通过系统进化树可以明确地看到CGMMV分离物大致可以分成两组,第Ⅰ组属于亚洲国家,第Ⅱ组属于欧洲国家。CGMMV-SXTG与亚洲国家(如:韩国、日本)分离物同源性较为相近,与我国内陆地区的分离物同源性最为相近;而与西班牙分离物和俄罗斯分离物相距较远,存在非常明显的进化差异。由此可以说明CGMMV不同分离物的基因组变异表现出一定的地域相关性。
通过进一步的序列比对发现与中国山东分离物TANG(HM008919)的核苷酸序列和氨基酸序列的同源性最高,分别为99.8%和99.6%;与韩国的分离物(AF417243)和日本的分离物(D12505)核苷酸序列同源性达到了99.2%,氨基酸序列同源性为99.0%。这说明CGMMV-SXTG与日、韩报道的CGMMV有共同的流行学意义上的侵染源,同时也进一步验证了我国的CGMMV可能由国外引种传入的论断[15]。本试验的研究方法可为后期病毒病原的分子鉴定提供借鉴,同时本文也为有效地预防和控制西瓜上CGMMV的流行提供了重要依据。
[1] 种焱.黄瓜绿斑驳花叶病毒导致的西瓜花叶病及其检疫性评估[J].植物检疫, 1993, 7(4): 325-326.
[2] 陈京, 李明福.新入侵的有害生物——黄瓜绿斑驳花叶病毒[J].植物检疫, 2007, 21(2): 94-96.
[3] Ainsworth G C.Mosaic diseases of the cucumber [J].Annals of Applied Biology,1935,22:55-67.
[4] 张永江,李明福.基于外壳蛋白核酸序列的中国黄瓜绿斑驳花叶病毒分离物起源分析[J].江西农业大学学报,2008,30(4):601-604.
[5] 秦碧霞,蔡健和,刘志明,等.侵染观赏南瓜的黄瓜绿斑驳花叶病毒的初步鉴定[J].植物检疫,2005,19(4):198-200.
[6] 陈红运,白静,朱水芳,等.黄瓜绿斑驳花叶病毒辽宁分离物外壳蛋白基因与3′非编码区的序列分析[J].中国病毒学,2006,21(5):516-518.
[7] 李红霞,白静,陈红运,等.南瓜果实中黄瓜绿斑驳花叶病毒的RT-PCR检测及cp基因序列分析[J].植物检疫,2007,21(5):268-270.
[8] 秦碧霞,蔡健和,刘志明,等.侵染葫芦的黄瓜绿斑驳花叶病毒广西分离物分子鉴定[J].植物保护,2008,34(1):116-118.
[9] 田永蕾,刘冬梅,张永江,等.黄瓜绿斑驳花叶病毒北京和山东分离物的生物学测定及其基因组比较[J].植物检疫,2009,23(6):1-6.
[10]李云明, 顾云琴, 项顺尧, 等.黄瓜绿斑驳花叶病毒病危害西瓜特点及防治技术[J].现代农业科技, 2012(7): 175.
[11]牛颜冰, 王德富, 姚敏, 等.侵染苘麻的烟草花叶病毒鉴定[J].植物保护学报, 2011, 38(2): 187-188.
[12]牛颜冰, 姚敏, 王德富, 等. 臭椿病毒病病原鉴定[J].植物病理学报, 2011, 41(4): 437-440.
[13]Tzanetakis I E, Martin R R. A new method for extraction of double-stranded RNA from plants[J]. Journal of Virological Methods, 2008, 149(1): 167-170.
[14]Stang A, Korn K, Wildner O, et al. Characterization of virus isolates by particle-associated nucleic acid PCR [J]. Journal of Clinical Microbiology, 2005, 43(2): 716-720.
[15]陈红运, 林石明, 陈青, 等.黄瓜绿斑驳花叶病毒辽宁分离物全基因组序列测定[J].病毒学报, 2009, 25(1): 68-72.
Sequence analysis of CP gene of Cucumber green mottle mosaic virus isolate infecting watermelon from Shanxi Province
Du Jiang, Cheng Yuanyuan, Niu Erbo, Niu Yanbing
(College of Life Science, Shanxi Agricultural University, Taigu 030801, China)
Based on dsRNA isolation, sequence-independent amplification (SIA) and Two-step RT-PCR methods, the pathogen infected watermelon in Taigu of Shanxi Province was identified to beCucumbergreenmottlemosaicvirus(CGMMV). To further characterize the CGMMV isolate on watermelon (CGMMV-SXTG), the coat protein gene(CP)coded by CGMMV-SXTG were cloned and sequenced. Phylogenetic tree analysis showed that CGMMV-SXTG had close relatives with Asia isolates and distant relatives with European isolates, suggesting that the classification of the CGMMV isolates may be related to the regions at some degree. Sequence alignments revealed that CGMMV-SXTG had the highest sequence identities with strain TANG by 99.8% in nucleotide and 99.6% in deduced amino acid identity, respectively.
CGMMV; sequence analysis; CP gene
2014-02-22
2014-07-28
公益性行业(农业)科研专项(201303028);山西省自然科学基金(2012011032-5)
S 432.41
A
10.3969/j.issn.0529-1542.2015.02.026
* 通信作者 E-mail:niuyanbingbest@163.com
