椰子木蛾幼虫龄期的划分
2015-11-25杨崇慧李朝绪黄山春马子龙覃伟权
杨崇慧, 阎 伟, 李朝绪, 黄山春,刘 丽, 马子龙, 覃伟权
(1. 海南大学环境与植物保护学院,海口 570228; 2. 中国热带农业科学院椰子研究所,文昌 571339; 3. 北京林业大学省部共建森林培育与保护教育部重点实验室,北京 100083; 4. 中国热带农业科学院热带生物技术研究所, 海口 571101)
椰子木蛾幼虫龄期的划分
杨崇慧1,2, 阎 伟2,3*, 李朝绪2, 黄山春2,刘 丽2, 马子龙4*, 覃伟权2
(1. 海南大学环境与植物保护学院,海口 570228; 2. 中国热带农业科学院椰子研究所,文昌 571339; 3. 北京林业大学省部共建森林培育与保护教育部重点实验室,北京 100083; 4. 中国热带农业科学院热带生物技术研究所, 海口 571101)
椰子木蛾是为害棕榈科植物的重要危险性林业有害生物,2013年8 月首次在我国海南发现,对我国椰子及棕榈产业造成严重的潜在威胁。龄期划分是深入研究椰子木蛾发生规律、生物学习性、预测预报以及防治适期的基础。头壳宽度可作为幼虫分龄的准确指标。本文通过林间收集椰子木蛾幼虫头壳和实验室饲养椰子木蛾并收集头壳的方法,通过测量与比较,运用频次分布与线性回归等,对椰子木蛾的龄期划分进行了研究,并依据Dyar法则和Crosby生长法则对划分结果进行了验证,确定其在林间和在实验室饲养条件下的龄数分别为5龄和5~8龄。室内饲养与室外相比,龄数增加,其原因可能是室内的环境条件如温度、湿度、光周期、食物营养等以及椰子木蛾自身遗传、种群密度等不同,室内环境条件不利而引起其龄期数增加。
椰子木蛾; 头壳宽度; 频次分布; 回归分析
椰子木蛾(OpisinaarenosellaWalker),又名椰子织蛾,属鳞翅目,木蛾科[1],是椰子等棕榈科植物的重要食叶害虫。该虫原产印度和斯里兰卡,现广泛分布于东南亚国家和地区[2-4]。我国于2013年8月在海南省万宁市首次发现椰子木蛾为害,该虫主要以幼虫取食椰子老叶,在叶片背面蛀虫道而使叶片呈焦枯状,为害严重时可使整个椰子树冠枯萎,造成严重的经济损失[4]。
国外对椰子木蛾的研究多集中在应用寄生蜂对其进行生物防治[5-6]、林间种群动态调查[2]、寄主偏好[7]等方面。目前国内关于该虫的研究主要在其风险性[3]、形态特征、分类地位[1]、简单的生物学特征与为害方式[8]等方面。而对该虫幼虫龄期的确定在国外有所提及(在林间调查分为 5 龄,在室内饲养最多可达 8 龄)[2],但未见详细报道。椰子木蛾是新入侵我国的外来有害生物,对其幼虫龄期的确定是深入研究其发生规律、生物学习性、预测预报以及防治适期的基础[9]。幼虫的头壳宽度是确定龄期的准确标准[10],已经广泛应用于鳞翅目和鞘翅目的许多物种[10-14]。为此,本试验采用测量头壳宽度的方法研究了椰子木蛾的幼虫龄期,以期为该虫防治适期的确定提供基础科学依据。
1 材料与方法
本试验采用林间收集椰子木蛾头壳用频次分布法确定龄期和实验室饲养观察其蜕皮次数并测量头壳宽度两种方法进行比较来最终确定该虫幼虫的龄期。
1.1 供试昆虫
实验室幼虫和蛹采自海南省三亚市周边乡镇受害椰林,将受害的椰子叶片采回后,轻轻拨开虫道,用细毛笔将幼虫挑至放有新鲜椰子叶片的养虫盒(24.2 cm×16.8 cm×8.8 cm)内放入恒温气候箱中饲养,温度:(28±1)℃,RH: 饱和湿度,光周期: L∥D=12 h∥12 h。用剪刀将蛹连叶片一起剪下放入养虫盒待其羽化,羽化后的成虫放于瓶顶开放的饲养瓶(内径14 cm, 高度24.9 cm)中,顶部用扎有小孔的保鲜膜覆盖(通风),提供10%蜂蜜水作为营养。养虫瓶为透明的玻璃瓶,其中套有保鲜袋(防初孵幼虫逃逸)并在周围放置叶片供其产卵。卵通常产于叶片与保鲜袋之间的缝隙中。卵孵化后将初孵幼虫用细毛笔轻轻挑至试管中放入恒温气候箱(与上述条件相同)中单头饲养,每日定时更换叶片并观察其蜕皮情况,收集头壳。
1.2 试验方法
1.2.1 林间头壳收集
林间幼虫头壳收集自海南省三亚市周边乡镇椰林中受害的椰子叶片。该虫蜕皮后的头壳埋藏于幼虫虫道的粪便中或在虫道口。检查采回的受害椰子叶片上的虫粪仔细寻找头壳,用细毛笔轻轻挑出后放入培养皿中。共收集到头壳556 粒,收集到的头壳均完整、无破损。
1.2.2 实验室观察方法
将初孵幼虫每10 头分别放入装有叶片的试管中饲养,共40 管。饲养条件为:温度(28±1)℃,相对湿度:饱和湿度(由于气候箱湿度不能控制,在气候箱内放入一托盘清水以确保湿度饱和), 光周期:L∥D=12 h∥12 h。用150 目纱布和橡皮筋封口防逃逸,每日定时更换叶片并观察其蜕皮情况,如有蜕皮即收集头壳并立即测量其头壳宽度。待第一次蜕皮后将2龄幼虫分别挑出单头饲养。从茧中寻找末龄幼虫的头壳并测量。每日更换叶片,观察蜕皮情况,收集头壳并测量。
1.2.3 测量
头壳测量均用数显游标卡尺,精确到0.01 mm。测量头壳侧边沿最远端之间的距离为头壳宽度。
1.3 数据处理与验证
所测数据应用Microsoft Excel 2013分析。鳞翅目幼虫相邻龄期的头壳宽度存在一定的几何级数关系,称作Dyar法则[15]。本文对椰子木蛾幼虫的头壳宽度进行了测量和频次分布分析,绘制头壳宽度分布图并对幼虫进行分龄。根据Dyar法则和Crosby生长法则,应用 Brooks 指数、 Crosby 指数以及线性回归来验证分龄的合理性[16]。
Brooks指数=Xn/Xn-1(Xn和Xn-1分别指第n龄幼虫和第n-1龄幼虫各自头壳宽度的平均值);
Crosby指数=(bn-bn-1)/bn-1(bn和bn-1分别指第n和n-1个Brooks指数)。
回归分析利用SAS 9.1.3进行。所做指数曲线图用Microsoft Excel 2013进行拟合。
2 结果分析
2.1 林间采集幼虫头壳宽度频次分布
根据测定的原始资料,幼虫的头壳宽度按照一定组距,整理成由小到大的频次分布表,绘制成频次分布图,如图1所示。
从图1可以看出,幼虫的头壳宽度具有5个明显的分布区和聚集区。根据Dyar定律可将幼虫分为5龄,各龄幼虫头壳宽度和相关参数见表1。结果显示Crosby指数均小于10%,表明在林间将幼虫分为5龄是合理的。

图1 林间采集幼虫头壳宽度频次分布图Fig.1 Frequency histograms of head capsule widths of O.arenosella collected from the field

龄数Instars均值/mmMeanBrooks指数BrooksindexCrosby指数Crosbyindex10.45--20.631.4000-30.801.2698-0.093041.071.33750.053351.361.2710-0.0497
2.2 实验室饲养幼虫头壳宽度
根据室内饲养幼虫的头壳宽度分布图(图2),其头壳宽度分为8个分布聚集区,说明室内饲养的椰子木蛾幼虫最多可达8龄,根据室内饲养观察发现幼虫在室内发育为蛹会有不同的蜕皮次数,最少为4次,最多7次。即幼虫龄数为5~8龄。各龄幼虫的头壳宽度均值、分布范围等见表2。各龄幼虫在所设条件下(见1.2.2)的发育历期见表3。幼虫化蛹率为35.0%。
在实验室饲养椰子木蛾过程中发现,达到5、6、7、8龄后化蛹的幼虫所占比例分别为4.29%、40.00%、25.71%及30.00%。表明椰子木蛾在室内幼虫发育龄数不统一。从试验中达到5、6、7、8龄后化蛹并羽化后成虫性别的统计结果显示,达到各自龄数化蛹的幼虫中雌雄虫均有,可以得出该虫幼虫龄期差异并非由性别不同引起。
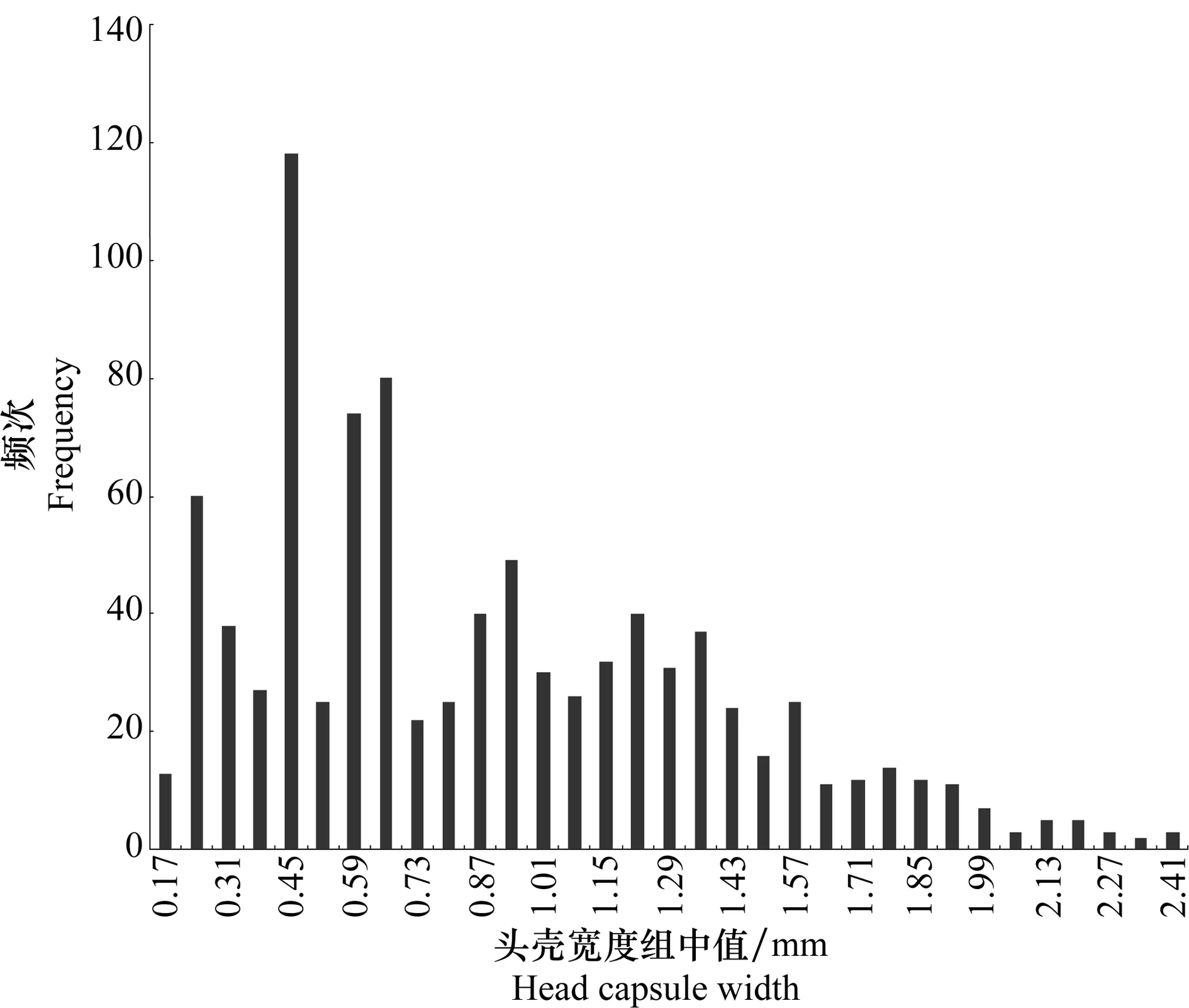
图2 室内饲养椰子木蛾头壳宽度频次分布图Fig.2 Frequency histograms of head capsule widths of O.arenosella reared in the laboratory
从表2可看出,Crosby指数均小于10%,符合Dyar法则。说明椰子木蛾在实验室内分为5~8龄是合理的。

表2 室内饲养椰子木蛾幼虫所得头壳宽度及其统计参数

表3 室内饲养各龄幼虫发育历期统计
2.3 幼虫虫龄和头壳宽度回归分析

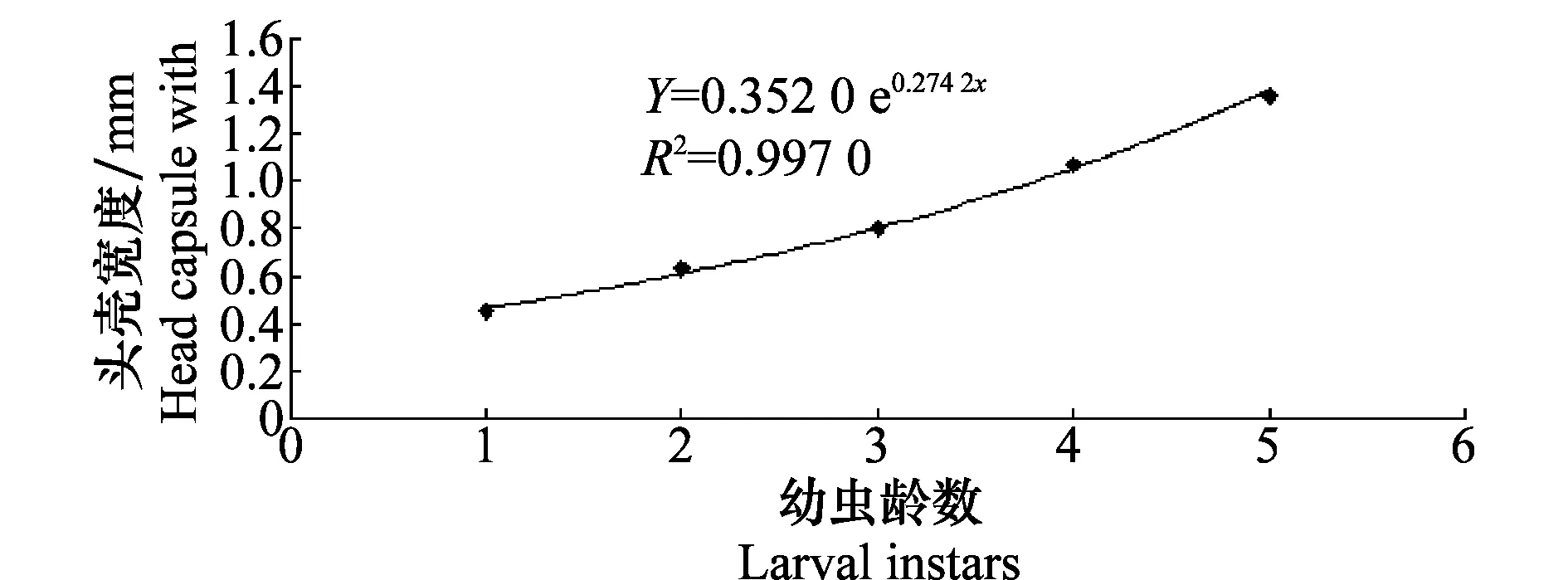
图3 林间收集椰子木蛾幼虫头壳宽度与虫龄级数的回归关系Fig.3 The regression relationship between larval instars and the head capsule widths of O.arenosella collected from the field

图4 实验室饲养椰子木蛾幼虫头壳宽度与虫龄级数的回归关系Fig.4 The regression relationship between larval instars and the head capsule widths of O.arenosella reared in the laboratory
3 讨 论
昆虫幼虫头壳宽度的增长是间断式的,每蜕一次皮便显著增大一次,相邻龄期幼虫的头壳宽度存在一定的几何级数关系,因此,头壳宽度可作为幼虫龄期划分的指标[18]。目前,在国内有关椰子木蛾龄期划分的研究未见报道。在国外, Hassell等[2]报道了椰子木蛾在林间分为5龄,在实验室条件下最高可达8龄,这与本研究的结果相吻合。Babu 和Prabhu[19]报道了椰子木蛾在实验室条件下分为8龄,而本试验中椰子木蛾的龄数不统一,5~8龄均有。这种在不同环境条件下龄数不同的现象在其他鳞翅目昆虫中也有发生[20]。Esperk等[21]根据以往的文献资料得出,昆虫幼虫的龄数具有种内差异性并广泛发生于完全变态和不完全变态昆虫中,温度、光周期、食料品质和数量、湿度、饲养密度、物理状态、遗传和性别等是影响幼虫龄数的最普遍因素。在环境条件不利的情况下,昆虫幼虫的龄数会增加(直翅目和鞘翅目中某些特殊种类除外)。Morita和Tojo[22]报道了斜纹夜蛾幼虫的龄数从6龄到8龄不等,龄数增加的原因是饲养密度不同和营养不良。由此可知,在本试验中,在林间调查和实验室饲养所得幼虫龄数不同的原因可能是温度、光周期、营养成分以及昆虫种群密度等在室内和林间存在明显的差异。室内环境条件不利,增加了椰子木蛾幼虫的龄数。
本研究通过实验室饲养和林间调查对比,分别对椰子木蛾幼虫头壳进行了收集并测量了其宽度,运用频次分布法、Dyar法则、线性回归等方法进行分析,运用头壳宽度指标对椰子木蛾幼虫的龄期进行划分和验证,得出椰子木蛾幼虫在林间可分为5龄,而在实验室饲养条件下可分为5~8龄。
[1] 李后魂, 尹艾荟,蔡波,等.重要入侵害虫—椰子木蛾的分类地位和形态特征研究(鳞翅目,木蛾科)[J].应用昆虫学报,2014,51(1):283-291.
[2] Perera P,Hassell M P, Godfray H C J. Population dynamics of coconut caterpillarOpisinaarenosellaWalker (Lepidoptera: Xyloryctidae), in Sri Lanka [J]. Bulletin of Entomological Research,1988,78:479-492.
[3] 阎伟,吕宝乾,李洪,等.椰子织蛾传入中国及其海南省的风险性分析[J].生物安全学报,2013,22(3):163-168.
[4] Mohan C, Nair C P R, Nampoothiri C K, et al. Leaf-eating caterpillar (Opisinaarenosella)-induced yield loss in coconut palm[J]. International Journal of Tropical Insect Science, 2010, 30:132-137.
[5] Venkatesan T, Jalali S K, Murthy K S, et al. A novel method of field release ofGoniozusnephantidis(Muesebeck), an important primary parasitoid ofOpisinaarenosellaWalker on coconut [J]. Journal of Biological Control, 2003, 17(1):79-80.
[6] Mohan C, Sathiamma B. Potential for lab rearing ofApantelestaragamae, the larval endoparasitoid of coconut pestOpisinaarenosella, on the rice mothCorcyracephalonica[J]. Biocontrol, 2007, 52:747-752.
[7] Murthy K S, Gour T B, Reddy D D R, et al. Host preference of coconut black headed caterpillarOpisinaarenosellaWalker for oviposition and feeding[J]. Journal of Plantation Crops, 1995, 23(2):105-108.
[8] 吕宝乾,严珍,金启安,等.警惕椰子织蛾Opisinaarenosella(鳞翅目:织蛾科)传入中国[J].生物安全学报,2013,22(1):17-22.
[9] 孙艳娟,韦金英,杨振德,等. 油桐尺蠖幼虫龄期的划分[J].昆虫知识,2009,46(6):892-895.
[10]Daly H V. Insect morphometrics [J]. Annual Review of Entomology, 1985, 30:415-438.
[11]Caltagirone L E, Getz W, Meals D W. Head capsule width as an index of age in larvae of navel orangeworm,Amyeloistransitella(Lepidoptera: Pyralidae)[J]. Environmental Entomology, 1983, 12:219-221.
[12]Got B. Determination of instar of the European corn borer (Lepidoptera: Pyralidae) based on a distribution model of head capsule widths [J]. Annals of the Entomological Society of America, 1988, 81:91-98.
[13]Beaver R J, Sanderson J P. Classifying instars of the navel orangeworm (Lepidoptera: Pyralidae) based on observed head capsule widths[J]. Journal of Economic Entomology, 1989, 82:716-720.
[14]Jobin L, Hebert C, Bourassa J P. Head capsule width of larval populations of the gypsy moth (Lepidoptera: Lymantriidae) in Quebec, with reference to Dyar’s hypothesis [J]. Environmental Entomology, 1992, 21:89-93.
[15]Dyar H G. The number of molts of lepidopterous larvae [J]. Psyche, 1890, 5:420-422.
[16]魏书军,郑宏海,皇甫伟国,等. 柑桔爆皮虫幼虫龄期的划分[J].昆虫学报,2006,49(2):302-309.
[17]陈永年,潘栋.也谈昆虫幼虫头宽及摄食量的增长规律[J].昆虫知识,1988,25(4):235-240.
[18]董易之,陈炳旭,徐淑,等. 荔枝大造桥虫幼虫龄数的划分[J].环境昆虫学报,2011,33(4):552-556.
[19]Babu P B S, Prabhu V K K. Spermatogenesis during ontogeny in the black-headed caterpillarOpisinaarenosellaWalker (Lepidoptera: Xylorytinae)[J].Current Science,1989,58(11):645-646.
[20]Mo H, Jang K B, Park J et al. Interactive effect of diet and temperature on instar numbers inSpodopteralitura, with reference to head capsule width and weight [J].Journal of Asia-Pacific Entomology, 2013, 16:521-515.
[21]Esperk T, Tammaru T, Nylin S. Intraspecific variability in number of larval instars in insects [J]. Journal of Economic Entomology, 2007, 100(3):627-645.
[22]Morita M, Tojo S. Relationship between starvation and supernumerary ecdysis and recognition of the penultimate-larval instar in the common cutworm,Spodopteralitura[J]. Journal of Insect Physiology, 1985, 31:307-313.
Division of larval instars of the coconut black-headed caterpillar,Opisinaarenosella
Yang Chonghui1,2, Yan Wei2,3, Li Chaoxu2, Huang Shanchun2, Liu Li2,Ma Zilong4, Qin Weiquan2
(1.College of Environment and Plant Protection, Hainan University, Haikou 570228,China;2. Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences,Wenchang 571339,China; 3. Key Laboratory for Silviculture and Conservation of Ministry of Education, Beijing Forestry University, Beijing 100083,China; 4. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101,China)
The coconut black-headed caterpillarOpisinaarenosellaWalker (Lepidoptera: Oceophoridae) is an important risky forest pest that infests many kinds of palm trees. It was first discovered in Hainan, China in August, 2013 and may bring great potential threats to the coconut and other palm plant production. The division of the larval instars is the foundation for deep research on the coconut black-headed caterpillar on the occurrence, biological characteristics, forecast and determination of the optimum control period. The capsule width is an accurate index that can be used to divide the larval instars. This study was conducted to determine the larval instars of the coconut black-headed caterpillar collected from the field and laboratory by the head-capsules. The head-capsule widths obtained from the experiment were then analyzed using the frequency distribution and the linear regression. The Dyar rule and the Crosby rule were used to validate the rationality of the division. The results showed that the caterpillar could be divided into 5 instars in the field and 5-8 instars under laboratory conditions. Compared with the results in the field, the instars increased in the laboratory. The reason is probably that the environmental conditions in the laboratory, such as temperature, moisture, photoperiod, food population density, and heredity, were different from those in the field, and the conditions in the laboratory were not good enough to maintain the development of the instars.
Opisinaarenosella; head-capsule width; frequency distribution; linear regression
2014-09-22
2014-12-04
海南省重点科技计划(ZDXM20130049);海南省重大科技专项(ZDZX2013008-2);中央级公益性科研院所基本科研业务费(1630042014009)
Q 964,S 436.679
A
10.3969/j.issn.0529-1542.2015.02.012
* 通信作者 E-mail:andy206@126.com; mzl1964@126.com
