番茄斑萎病毒4种检测方法比较
2015-11-25赵巍巍杨家强周小毛吴青君
赵巍巍,杨家强,周小毛*,吴青君*
(1.湖南农业大学农药研究所,长沙 410128;2.中国农业科学院蔬菜花卉研究所,北京 100081)
番茄斑萎病毒4种检测方法比较
赵巍巍1,杨家强2,周小毛1*,吴青君2*
(1.湖南农业大学农药研究所,长沙 410128;2.中国农业科学院蔬菜花卉研究所,北京 100081)
本研究根据番茄斑萎病毒(TSWV)S RNA上的核衣壳蛋白(N)基因保守序列设计特异性引物,比较了4种检测方法的灵敏度。结果表明,特异性引物可扩增出397 bp的片段,序列和已发表的TSWV核苷酸序列同源性高达99%,可用于常规PCR和荧光定量RT-PCR(qRT-PCR)检测。qRT-PCR的灵敏度比快速检测试纸条、双抗体夹心酶联免疫吸附法(DAS-ELISA)和常规PCR分别高出15 625倍、3 125倍和125倍,且能够准确定量;常规PCR 灵敏度较高,但不能准确定量;DAS-ELISA方法适用于批量定性测定,但检测时间较长;试纸条法检测速度最快,但灵敏度最低,使用时可根据症状程度和试验条件选择适宜的检测方法。
番茄斑萎病毒; DAS-ELISA; 常规PCR; 快速检测试纸条; qRT-PCR; 灵敏度
番茄斑萎病毒(Tomatospottedwiltvirus,TSWV)是布尼亚病毒科(Bunyaviridae),番茄斑萎病毒属(Tospovirus)代表性成员[1],病毒粒子近似球形[2],寄主植物广泛,主要侵染番茄、烟草、花生、辣椒、莴苣、大豆等蔬菜作物和数以千计的观赏植物[3-5]。目前在世界多个国家和地区广泛分布,在夏威夷,生菜、番茄和胡椒上由其造成的损失达60%~70%[6-7];在法国和西班牙等欧洲国家和地区,曾因该病毒大量扩散而引起番茄、辣椒等作物感病,造成毁灭性损失,重病地块损失达100%;20世纪90年代末期,TSWV 在日本的菊花上严重发生,因其广泛的寄主范围和造成的巨大经济损失已被列为世界危害最大的十种植物病毒之一[8]。自然界中TSWV主要通过蓟马传播,并以一种持久性循环增殖的方式传播[9],其中西花蓟马是其最有效的传播载体。国外的许多研究表明,TSWV总是伴随西花蓟马的暴发而发生。自2003年西花蓟马在北京首次发现,目前已分布于山东、广东、云南、广西、西藏等地区[10-12]。我国首次于1984年在广州发现TSWV,并得到其分离物[13]。2006年,我国首次将TSWV列为全国农业植物检疫性有害病毒[14],2008年,在云南蝴蝶兰上检测到TSWV[15], 2009—2010年,董家红等在云南昆明的多个地区检测到TSWV[16],2012年广州检验检疫中心首次在美国进境生菜种子中截获TSWV[17],李飞等2012年在北京检测到TSWV[18]。自1915年首次在澳大利亚发现TSWV到现在已有近百年的历史[19],除使用抗病毒品种和对传播介体进行防治外,预防该病毒病的发生也很重要。快速、准确地检测TSWV是预防工作的重要前提。
番茄斑萎病毒的检测方法主要包括生物学检测、电子显微镜检测、血清学检测以及分子生物学检测等技术。生物学检测依靠寄主植物上的典型症状来判断,该方法直观便捷,但对于其他具有类似症状的病毒较难分辨[20]。电镜检测可以直接观察病毒的形态结构以及病毒侵染寄主植物后所引起的植物超微结构变化,是一种最直接的观察工具[21],但该方法对于病毒的分类和归属较难判定。血清学检测是将免疫反应和酶的高效催化反应有机结合的方法,目前该方法被广泛用于植物病毒检测[22]。1977年,Clark和Adams采用DAS-ELISA的方法检测出TSWV,INSV和WSMOV[22]。分子生物学检测主要包括常规PCR、免疫捕捉RT-PCR和qRT-PCR[23]。分子生物学检测灵敏度高,Roberts等应用qRT-PCR技术从植物叶片总RNA中检测到TSWV,灵敏度可达500 fg[24],2002年,Boonham等利用Taq-Man的qRT-PCR技术成功检测单头西花蓟马成虫体内的TSWV病毒[25]。不同方法在使用成本、操作难易和灵敏度方面均存在差异[26]。
近年来,随着我国进出口贸易频繁,存在TSWV暴发的潜在威胁,常规PCR和qRT-PCR在植物病毒检测中具有灵敏度高、准确快速等优点备受青睐。本研究针对TSWV核衣壳蛋白(N)基因保守序列设计常规PCR和qRT-PCR新的特异引物,并建立了适宜的反应体系和扩增程序,同时比较了快速检测试纸条、DAS-ELISA、常规PCR和qRT-PCR 4种方法检测番茄斑萎病毒的灵敏度,旨在为国内TSWV的检验检疫提供快速、准确和灵敏的检测技术,同时也为防控TSWV提供更好的技术支撑。
1 材料与方法
1.1 供试材料
1.1.1 病毒
TSWV(TSWV-YN)病毒毒源由浙江省农科院植物保护与微生物研究所张治军博士提供,通过人工摩擦的方法接种于曼陀罗(Daturastramonium)上活体保存[27],然后再转接到试验寄主植株上。
1.1.2 植物材料
辣椒(CapsicumannuumL.)品种为‘中椒6号’,在温室(27±1)℃、相对湿度70%±5%、光照周期L∥D=16 h∥8 h条件下培养至2~3片真叶期时用于测试,保持无虫为害状态。
1.2 材料处理
以具有疑似TSWV症状的田间辣椒植株为待测样品;以改进的人工摩擦法接种TSWV的辣椒植株为阳性对照(缓冲液为0.1 mol/L磷酸盐缓冲液,pH=7.0,0.2%NaSO3,0.01 mol/L巯基乙醇)[27];健康辣椒植株为阴性对照,共3个处理,每处理3次重复。所有处理的植株均在(27±1)℃,RH70%±5%,L∥D=16 h∥8 h的光照培养箱中培养。经DAS-ELISA检测确认发病后备用。
分别选取不同处理的辣椒叶片,剪碎混匀并等重称取4份,分别用快速检测试纸条、DAS-ELISA、常规PCR和qRT-PCR 4种方法进行检测。
1.3 主要仪器
SANYO MLR-351植物培养箱,日本SANYO公司;SpectraMax M 2酶标仪,美国分子仪器公司;S-1000 Thermal Cycler PCR 仪, Molecular Imager ChemiDoc凝胶成像系统,美国Bio-Rad公司;ABI 7500 real time PCR仪,美国ABI公司;冷冻离心机3K15,美国Sigma公司。
1.4 主要试剂
快速检测试纸条,DAS-ELISA TSWV试剂盒,安德珍生物技术(北京)有限公司;华越洋超快型植物RNA提取试剂盒,北京华越洋生物科技有限公司;TaKaRa PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒、琼脂糖,pMDTM18T Vector Cloning Kit,宝生物工程(大连)有限公司;DNA纯化回收试剂盒,上海捷瑞生物工程有限公司;快速质粒小提取试剂盒,SuperReal PreMix Plus(SYBR Green I),天根生化科技(北京)有限公司;EcoR V限制性内切酶,NEB(北京)有限公司; 2×ESTaqMaster Mix,北京康为世纪生物科技有限公司。
1.5 快速检测试纸条检测TSWV
参照安德珍快速检测试纸条说明书,将待测样品提取液5倍梯度稀释(51~54倍),取100 μL到试纸条的点样孔中,30 s后若对照线(C)不显色,则结果无效;若观察孔内C线和待测(T)线同时显色,该样品呈阳性;若C线显色而T线不显色,则该样品为阴性,T线的颜色深浅可粗略判断病毒含量的高低。
1.6 DAS-ELISA检测TSWV
参照安德珍TSWV DAS-ELISA试剂盒说明书进行,待测样品置于常规提取缓冲液中碾碎,样品和提取液比例是1 g/10 mL,然后将上清液按5倍梯度稀释51~55倍后进行后续试验,并在405 nm波长下读取吸光值,每个浓度3次重复。
1.7 常规PCR检测TSWV
样品总RNA提取参照华越洋超快型植物RNA提取试剂盒说明书,1%琼脂糖凝胶电泳检测RNA完整性,Nanodrop 2000 c分光光度计检测RNA纯度,A260/A280比值在1.9~2.0之间可进行下一步试验。使用TaKaRa PrimerScriptTMRT Reagent Kit with gDNA Eraser合成cDNA第一链,定量到1 ng/μL,-20 ℃保存备用。
根据NCBI中GenBank数据库已登录的不同分离株的TSWV 核衣壳蛋白基因(N)序列(TSWV-N),经序列多重比对,根据保守序列设计扩增产物为397 bp的特异性引物:TSWV-F:5′-CAGGATTGGAGCCACCGACAT-3′,TSWV-R:5′-AGCATACTCTTTCCCTTTCT-3′,并根据此扩增产物设计片段大小为113 bp的定量引物:TSWV-113F:5′-CTTGCCATAATGCTGGGAGGTAG-3′,TSWV-113R:5′-ATCC-CGAGGTCTTTGTATTTTGC-3′,引物均由上海生工有限公司合成。
将待测样品的cDNA用DEPC处理的去离子水按5倍梯度稀释51~58倍,以不同稀释倍数的cDNA作为模板进行常规PCR,以检测其灵敏度。PCR反应体系为20 μL:模板2 μL、TSWV-F 0.5 μL、TSWV-R 0.5 μL、2×ESTaqMasterMix 10 μL、ddH2O 7 μL。PCR程序为94 ℃预变性5 min; 94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸45 s,35个循环;72 ℃延伸5 min。扩增产物用2%琼脂糖凝胶电泳检测,并由北京擎科新业生物技术有限公司测序,测序后的序列通过BLAST进行序列比对分析。
1.8 qRT-PCR检测
将常规PCR扩增产物连接至pMDTM18T载体,方法参照载体说明书。挑取阳性克隆于含氨苄青霉素的LB液体培养基中37 ℃培养过夜,按照天根快速质粒小提取试剂盒说明书提取质粒,提取完后用限制性内切酶EcoR V将质粒线性化并鉴定,测定质粒浓度,-20 ℃备用。
参照SuperReal PreMix Plus(SYBR Green I)试剂盒说明书加样,反应体系为20 μL:cDNA 1 μL,TSWV-113F 0.5 μL,TSWV-113R 0.5 μL,2×SuperReal PreMix Plus 10 μL,50×ROX Reference Dye 1 μL,ddH2O 7 μL。最佳反应程序为95 ℃预变性15 min;95 ℃变性10 s、60 ℃退火32 s、72 ℃延伸32 s,40个循环每个模板4次技术重复。样品加完后放置于ABI 7500 Real Time PCR仪中进行扩增。以质粒标准品为模板(91.7 ng/μL)按5倍梯度稀释成8个不同浓度,利用荧光定量引物TSWV-113F/TSWV-113R进行qRT-PCR,生成外部标准曲线。
为检测qRT-PCR灵敏度,将待测样品的cDNA用DEPC处理的去离子水以5倍梯度稀释51~59倍,以稀释的cDNA为模板进行qRT-PCR。
1.9 数据分析
DAS-ELISA数据由SpectraMax M 2仪器的SoftMax Pro软件导出,实时荧光定量PCR数据由ABI 7500 Real Time PCR仪软件7500 software v 2.0.1获取,数据分析使用SPSS 18.0,图表使用SigmaPlot 12.5软件制作。
2 结果与分析
2.1 快速检测试纸条检测TSWV
梯度稀释的待测样品进行快速试纸条检测结果显示,样品在51倍稀释后窗口区C线和T线均出现明显的条带,在52倍稀释后条带微弱、模糊,表明52倍稀释达到快速检测试纸条灵敏度的极限(图1)。

图1 不同稀释倍数待测样品快速检测试纸条检测结果Fig.1 Detection of TSWV samples at different dilution ratios with rapid detection test strip
2.2 DAS-ELISA检测TSWV
根据安德珍DAS-ELISA TSWV诊断试剂盒说明书,若样品颜色为明显黄色且2孔的吸收值均高于该板阴性平均值的3倍,该样品计为阳性;若样品仅1孔高于阴性平均值3倍,则该样品不参与统计。根据图2结果显示,当待测样品连续进行5个梯度稀释后, 稀释倍数为51~53的3个样品A405 nm平均值高于阴性3倍,54低于3倍,接近阴性对照,表明54倍稀释达到DAS-ELISA检测的极限。

图2 不同稀释倍数样品DAS-ELISA检测结果Fig.2 Detection of TSWV samples at different dilution ratios with DAS-ELISA
2.3 常规PCR检测TSWV
采用TSWV-F/TSWV-R对待测样品进行常规PCR扩增,在400 bp左右可以看到与预期片段大小一致的目标条带(图3),将获得的目的条带进行测序,并通过BLAST比对发现待测样品序列与阳性对照序列一致,大小为397 bp,且该病毒的核衣壳蛋白基因(N)序列和已发表的番茄斑萎病毒核苷酸序列(KC294570.1)同源性高达99%,表明该样品携带番茄斑萎病毒。
待测样品cDNA按照5倍梯度稀释后进行常规PCR,结果显示(图4),稀释倍数为51~53的3个样品能扩增出明显的靶带,稀释倍数为54~55的2个样品条带微弱、模糊,当cDNA稀释倍数大于55时,扩增不出任何条带,表明55倍稀释已达到常规PCR检测极限。

图3 常规PCR产物电泳图Fig.3 Electrophoresis of conventional PCR products
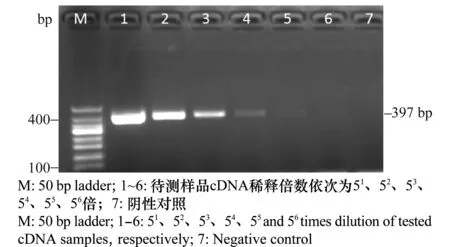
图4 不同稀释倍数样品常规PCR检测结果Fig.4 Detection of TSWV samples at different dilution ratios with conventional PCR
2.4 qRT-PCR检测TSWV
以基因起始拷贝数的对数值为横坐标,以Ct值为纵坐标建立标准曲线。回归方程为:y=-3.459 2x+43.47,相关系数为0.998 7,扩增效率为94.57%,Ct值范围在16.25~33.37(图5),斜率值范围在-3.0~-3.6之间即可满足qRT-PCR对扩增效率的要求。本次试验制备标准曲线的斜率为-3.459 2,完全符合试验要求,表明该标准曲线可以用于TSWV定量检测分析。质粒的拷贝数(copies/μL)=6.02×1023(copies/mol)×质粒浓度(g/μL)/质粒分子量 (g/mol)[28]。
待测样品5倍梯度稀释后,qRT-PCR检测结果显示,cDNA稀释至58倍时仍可有效检测,TSWV-N拷贝数为3.08×102copies/μL,而当cDNA稀释至59时(表1),Ct值接近阴性对照,说明qRT-PCR只能检测到58倍稀释。
2.5 4种检测方法灵敏度汇总
试验结果显示,4种不同检测方法的灵敏度由高到低依次为qRT-PCR>常规PCR>DAS-ELISA>快速检测试纸条(表2),其中DAS-ELISA和快速检测试纸条的检测灵敏度接近,DAS-ELISA的灵敏度略高,而qRT-PCR的灵敏度比快速检测试纸条、DAS-ELISA和常规PCR分别高出15 625倍、3 125倍和125倍。

表2 4种TSWV检测方法灵敏度汇总1)
1)“+”表示能有效检测;“-”代表未能有效检测。
+, Effectively detected;-, Ineffectively detected.
3 讨论
番茄斑萎病毒是世界范围内一种非常重要且极具破坏性的危险性植物病毒病害,能感染多种花卉及蔬菜作物,造成严重的经济损失。早期快速、特异性检测是植物病毒病害防控研究中最为重要的一个环节,对防止该病害的传播蔓延具有极其重要的意义。虽然早在1984年我国就已报道发现该病毒,但随后的10多年并未有大量报道。近年来随着我国与其他国家花卉苗木贸易频繁,加上西花蓟马危害范围逐步扩大,该病毒已在我国多个地区检测到,为我国贸易生产带来严重的安全隐患。
不同寄主植物上TSWV症状表现不尽相同,给病毒的检测带来困难,本研究比较了4种番茄斑萎病毒检测方法的灵敏度,灵敏度由高到低依次为:qRT-PCR>常规PCR>DAS-ELISA>快速检测试纸条。快速检测试纸条是一种简便快捷的胶体金免疫层析技术,适合基层推广使用,该方法由于检测灵敏度和定量水平低,只适合在病毒浓度较高的情况下检测;DAS-ELISA技术目前是我国进出口检验检疫病毒的主要方法,也是病毒诊断与检测的一种常规手段,该方法具有方法简便,成本低,能批量检测等优点,但是检测时间较长且存在非特异性颜色反应干扰,容易出现假阳性而不能满足特异性和高灵敏度等的需要;常规PCR和qRT-PCR比快速检测试纸条和DAS-ELISA特异性和灵敏度更高,但常规PCR不能准确定量,也易出现交叉污染,产生假阳性;qRT-PCR检测灵敏度远高于常规PCR,为常规PCR 的近125 倍,qRT-PCR不仅能定性,更能直接定量,因其加样只需打开一次盖子,随后完全是闭管操作,可以有效地防止扩增过程中出现交叉污染和假阳性且整个过程只需1~2 h,该技术不仅加快了检测速度也有效地提高了检测的灵敏度和准确度,特别适用于在早期病毒含量较低时检测,这项技术已成为植物病原鉴定和病害诊断的标准方法。但是由于对核酸质量要求高,仪器设备昂贵等因素影响了该技术的广泛应用。建议在检测TSWV 时应根据实际情况选用适宜的方法,或将上述多种方法综合使用,以避免错过防治的最佳时机。通常在检测时,可先用快速检测试纸条或DAS-ELISA对症状明显的植株进行初步鉴定,用常规PCR或qRT-PCR进行最后的确诊以得出更加准确的检测结果。
[1] Mason G, Roggero P, Tavella L. Detection ofTomatospottedwiltvirusin its vectorFrankliniellaoccidentalisby reverse transcription-polymerase chain reaction [J]. Journal of Virological Methods, 2003, 109(1): 69-73.
[2] Mohamed N A, Randles J W, Francki R I B. Protein composition ofTomatospottedwiltvirus[J]. Virology,1973,56(1):12-21.
[3] Pappu H R, Jones R A C, Jain R K. Global status ofTospovirusepidemics in diverse cropping systems: successes achieved and challenges ahead [J]. Virus Research,2009,141:219-236.
[4] Riley D G, Joseph S V, Srinivasan R, et al. Thrips vectors ofTospoviruses[J]. Journal Integrated Pest Management,2011,1(2):11-110.
[5] Parrella G, Gognalons P, Gebre-Selassie K, et al. An update of the host range ofTomatospottedwiltvirus[J]. Journal of Plant Pathology, 2003, 85(4): 227-264.
[6] Cho J J, Mau R F L, German T L, et al. A multidisciplinary approach to management ofTomatospottedwiltvirusin Hawaii [J]. Plant Disease, 1989, 73(5): 375-383.
[7] Cho J J,Mitchell W C,Mau R F, et al. Epidemiology ofTomatospottedwiltvirusdisease on crisphead lettuce in Hawaii [J]. Plant Disease, 1987,71(6):505-508.
[8] Scholthof K B G, Adkins S, Czosnek H, et al. Top 10 plant viruses in molecular plant pathology [J]. Molecular Plant Pathology, 2011, 12 (9): 938-954.
[9] Wijkamp I, Peters D. Determination of the median latent period of twoTospovirusesinFrankliniellaoccidentalis, using a novel leaf disk assay [J]. Phytopathology,1993,83:986-991.
[10]张友军,吴青君,徐宝云,等.危险性外来入侵生物—西花蓟马在北京发生危害[J].植物保护,2003,29(4):58-59.
[11]吕要斌, 张治军, 吴青君, 等. 外来入侵害虫西花蓟马防控技术研究与示范[J]. 应用昆虫学报, 2011, 48(3): 488-496.
[12]王海鸿,雷仲仁,李雪,等.西藏发现重要外来入侵害虫—西花蓟马[J].植物保护,2013,39(1):181-183.
[13]许永泽,张宗义,陈金香.番茄斑枯萎病毒(TSWV)广州分离物生物学特征研究[J].植物病理学报,1989,19(4):198.
[14]于翠, 杨翠云, 印丽萍. 番茄斑萎病毒—一种值得重视的植物检疫病毒[J]. 植物检疫,2006(S1):47-50.
[15]程晓非, 董家红, 方琦, 等. 从云南蝴蝶兰上检测到番茄斑萎病毒属病毒[J]. 植物病理学报, 2008, 38(1): 31-34.
[16]董家红,尹跃艳,徐兴阳,等.番茄斑萎病毒在云南的发生为害[C]∥吴孔明.公共植保与绿色防控-中国植物保护学会2010年学术年会.北京:中国农业科学技术出版社,2010:765.
[17]冯黎霞, 章柱. 从美国进境生菜种子中首次截获番茄斑萎病毒[J]. 植物检疫, 2013,27(1):57.
[18]李飞, 吴青君, 徐宝云, 等. 北京地区发现番茄斑萎病毒[J]. 植物保护, 2012, 38(6): 186-188.
[19]Brittlebank C C. Tomato diseases [J]. Journal of the Department of Agriculture in Victoria,1919,17:231-235.
[20]郑元仙, 刘雅婷. 番茄斑萎病毒属病毒检测技术研究进展[J]. 云南农业大学学报(自然科学版), 2009, 24(4): 607-613.
[21]张仲凯, 方琦, 丁铭,等.侵染烟草的番茄斑萎病毒(TSWV)电镜诊断鉴定[J]. 电子显微学报, 2000, 19(3): 339-340.
[22]Clark M F, Adams A N. Characteristics of the microplate method of enzyme-linked immunosorbent assay for the detection of plant viruses [J]. Journal of General Virology, 1977, 34(3): 475-483.
[23]Weekes R J, Mumford R A, Barker I, et al. Diagnosis ofTospovirusesby reverse-transcription polymerase chain reaction[J].Acta Horticulturae, 1996(431): 159-166.
[24]Roberts C A, Dietzgen R G, Heelan L A, et al. Real-time RT-PCR fluorescent detection ofTomatospottedwiltvirus[J]. Journal of Virological Methods, 2000, 88(1): 1-8.
[25]Boonham N, Smith P, Walsh K,et al. The detection ofTomatospottedwiltvirus(TSWV) in individual thrips using real time fluorescent RT-PCR (TaqMan) [J]. Journal of Virological Methods, 2002, 101: 37-48.
[26]习凤妮, 谭新球, 朱春晖, 等. 番茄斑萎病毒检测技术发展趋势概述[J]. 湖南农业科学, 2013 (5): 77-79.
[27]Mandal B, Pappu H R, Culbreath A K. Factors affecting mechanical transmission ofTomatospottedwiltvirusto peanut (Arachishypogaea)[J]. Plant Disease,2001,85(12):1259-1263.
[28]李慧锋,李丽,张丽娟,等.PepT1基因绝对荧光定量PCR标准曲线的建立[J].山西农业大学报(自然科学版),2010,30(4):332-335.
Comparison of four methods for detecting Tomato spotted wilt virus
Zhao Weiwei1,Yang Jiaqiang2,Zhou Xiaomao1,Wu Qingjun2
(1. Institute of Pesticide Science, Hunan Agricultural University,Changsha 410128, China;2. Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Specific primers were designed according to the conserved sequence of the nucleocapsid protein (N) gene ofTomatospottedwiltvirus(TSWV) S RNA, and the sensitivities of four methods for detecting TSWV were compared. The results showed that a 397 bp fragment was amplified with the specific primers, and the sequence showed a homology of 99% with the published TSWV nucleotide sequence. The designed primers could be used for conventional PCR and quantitative reverse transcription-PCR (qRT-PCR) methods. The sensitivity of qRT-PCR for detecting TSWV was 15 625 fold, 3 125 fold and 125 fold higher than that of the rapid detection test strip (RDTT), double sandwich enzyme-linked immunosorbent assay (DAS-ELISA) and conventional PCR, respectively. Moreover, qRT-PCR method can be accurately quantified. Conventional PCR showed a higher sensitivity, but it cannot be accurately quantified. DAS-ELISA is suitable for batch qualitative detection but it needs a longer detection time. RDTT is the fastest method, but the sensitivity is the lowest. Suitable detection methods can be selected according to the symptom degree and the experimental conditions.
Tomatospottedwiltvirus; DAS-ELISA; conventional PCR; rapid detection test strip; qRT-PCR; sensitivity
2014-07-04
2014-10-09
国家科技支撑计划(2012BAD19B06);北京市自然科学基金(6122028);现代农业产业技术体系北京市叶类蔬菜创新团队建设专项资金(blvt-15);北京市科委课题(Z121100001212006);蔬菜有害生物控制与优质栽培北京市重点实验室
S 432.41
A
10.3969/j.issn.0529-1542.2015.02.019
* 通信作者 E-mail:zhouxm1972@126.com;wuqingjun@caas.cn
