解淀粉芽胞杆菌MH71的生防活性及脂肽类抗生素基因检测
2015-11-25卢彩鸽张殿朋董红平王俊丽刘伟成
卢彩鸽, 张殿朋, 刘 霆, 董红平, 王俊丽, 刘伟成*
(1. 北京市农林科学院植物保护环境保护研究所, 北京 100097; 2. 广东海洋大学农学院, 湛江 524088)
研究报告ResearchReports
解淀粉芽胞杆菌MH71的生防活性及脂肽类抗生素基因检测
卢彩鸽1, 张殿朋1, 刘 霆1, 董红平1, 王俊丽2, 刘伟成1*
(1. 北京市农林科学院植物保护环境保护研究所, 北京 100097; 2. 广东海洋大学农学院, 湛江 524088)
从漠河多年永冻土层采集的冻土样品中分离的拮抗菌解淀粉芽胞杆菌MH71,对多种植物病原真菌和细菌具有较强的拮抗作用。本文对该菌株的生防活性相关特性及其对番茄灰霉病的离体防效进行了研究,同时,应用特异性引物对MH71中脂肽类抗生素合成有关基因进行检测。结果表明,该拮抗菌产生嗜铁素、蛋白酶、纤维素酶和吲哚-3-乙酸(IAA),不产生磷酸酯酶和几丁质酶;番茄离体叶片第5天调查结果表明该菌发酵液对番茄灰霉病的防效为92.8%,而在番茄果实上第7天和第11天调查的结果表明,与清水对照对比,发酵原液、发酵液5倍稀释液与50%啶酰菌胺1 000倍液化学农药对番茄灰霉病均有良好的防治效果,防效均为100%;从该菌的基因组DNA中扩增得到了fenB、mycB、ituA、sfp等脂肽类抗生素合成酶基因。此研究结果为该拮抗菌生防潜力的深入评价及活性物质的分离、鉴定和番茄灰霉病的生物防治提供了重要的参考资料。
解淀粉芽胞杆菌; 番茄灰霉病; 脂肽类抗生素; 生防活性
由非核糖体途径合成的脂肽类抗生素是芽胞杆菌产生的抑菌物质中最常见的一类,主要包括surfactins、iturins和fengycins 3个家族[1-3],由于脂肽类物质为亲油亲水的两亲分子,对其他细菌为非特定作用模式,因此不会产生抗药性细菌,可作为新一代抗生素,已经成为当今研究开发的热点[4],且这些抗生素由于具有抑菌谱广、热稳定性强、持效期长等优点,在植物病害防治中具有重要的作用[5]。
北京市农林科学院植保所的生防微生物研究室自2011年9月份从中国黑龙江省漠河北极村附近的多年永冻土层采集的冻土样品中分离出一株拮抗细菌MH71,经鉴定该菌株为解淀粉芽胞杆菌(Bacillusamyloliquefaciens),该菌株已于2012年12月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏编号为CGMCC 6978。该菌株具有广谱抗菌活性,对镰刀病菌、褐腐病菌、灰霉病菌等植物病原真菌和平菇褐斑、黄瓜角斑、大白菜黑腐病菌等植物病原细菌等均具有较强的抑菌活性[6]。
本研究以农业生产上发生严重的番茄灰霉病为靶标病害,主要报道解淀粉芽胞杆菌MH71生防相关性状测定及生防效果评价研究结果,即利用平板活性检测生防相关特性,PCR检测基因组中脂肽类抗生素合成相关基因,以及在番茄叶片和果实上离体检测对番茄灰霉病的防治效果,该研究结果将为进一步认识产脂肽菌株在植病生防领域的应用潜力和深入开发利用该菌株提供有益的参考。
1 材料与方法
1.1 供试菌株和培养基
拮抗菌解淀粉芽胞杆菌(Bacillusamyloliquefaciens)MH71和靶标指示菌番茄灰霉病原菌(BotrytiscinereaPers.)均由北京市农林科学院植保所生防微生物研究室自行分离和保存。
番茄灰霉病菌和MH71活化和保存分别用PDA培养基和LB固体培养基,参考文献[7]的方法配制。MH71发酵采用改良的LB液体培养基(葡萄糖10.0 g,蛋白胨 10.0 g,NaCl 5.0 g,牛肉膏 3.0 g,MnSO4·H2O 5.0 mg,蒸馏水 1 000 mL,pH 7.2~7.4)。
CAS培养基[8]:溶液1(CAS/HDTMA溶液),把CAS溶液(60.5 mg铬天青溶解在50 mL水中)与10 mL铁溶液(1 mmol/L FeCl3·6H2O溶解于10 mmol/L HCl中,pH为2.0)混合后加入HDTMA溶液(72.9 mg溴化十六碳烷基三甲氨溶解于40 mL水中)并搅拌均匀后灭菌,得到的蓝黑色液体即CAS/HDTMA溶液;溶液2(Salts/Buffer溶液),将30.24 g PIPES溶解于750 mL Salts溶液(KH2PO40.3 g,NaCl 0.5 g,NH4Cl 1.0 g)中,以50%(W/V)KOH调节pH 至6.8,加入15.0 g琼脂定容至800 mL,高压灭菌;溶液3(750 mL),葡萄糖 2.0 g,甘露醇 2.0 g,MgSO4·7H2O 493.0 mg,CaCl211.0 mg,H3BO31.4 mg,ZnSO4·7H2O 1.2 mg,MnSO4·2H2O 1.17 mg,Na2MoO4·2H2O 1 mg,CuSO440 μg,高压灭菌。溶液3冷却至50 ℃后加入溶液2与30 mL经过0.22 μm微孔膜过滤除菌的10%(W/V)casamino acid混合,再加入溶液1,缓慢摇匀后铺平板。
胶态几丁质培养基[9]:胶体几丁质 2.5 g,K2HPO40.7 g,KH2PO40.3 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,琼脂15.0 g,蒸馏水1 000 mL,pH 7.0。
脱脂牛奶琼脂培养基:进口脱脂奶粉40.0 g,琼脂15.0 g,蒸馏水1 000 mL,115 ℃高压灭菌20 min,与LB固体培养基1∶9混匀后铺平板。
纤维素刚果红培养基[10]:MgSO4·7H2O 0.25 g,K2HPO40.5 g,纤维素1.88 g,刚果红0.2 g,琼脂14.0 g,明胶2.0 g,蒸馏水1 000 mL,pH 7.0。
Pikovskaya’s 琼脂培养基[11]:酵母提取物0.5 g,葡萄糖10.0 g,Ca3(PO4)25.0 g,(NH4)2SO40.5 g,KCl 0.2 g,MgCl20.1 g,MnSO4·H2O 0.1 mg,FeSO40.1 mg,琼脂15.0 g,蒸馏水1 000 mL,pH 7.0。
DF培养基[12]:蛋白胨5.0 g,酵母提取物1.5 g,牛肉膏1.5 g,NaCl 5.0 g,色氨酸0.5 g,蒸馏水1 000 mL,pH 7.0;DF-培养基中不含色氨酸。
除特别标注外,培养基均经121 ℃高压灭菌20 min后备用。
1.2 拮抗菌MH71与生防相关的产素/酶的检测
将拮抗菌MH71经28 ℃在LB培养基上活化培养24 h后,以无菌牙签接种于1.1中制备好的各种产素/酶检测培养基(包括嗜铁素、几丁质酶、蛋白酶、纤维素酶和磷酸酯酶)平板上,28 ℃培养48~72 h后,直接观察拮抗菌MH71菌落周围是否产生晕圈或水解透明圈,若有晕圈或透明圈的产生,表明产素阳性,以晕圈或透明圈直径的大小来初步判断拮抗菌产素能力的大小。
吲哚-3-乙酸(IAA)检测:配制IAA纯品水溶液,检测不同浓度IAA溶液在A530nm处吸光值,绘制IAA含量标准曲线。将活化的MH71菌株接种于IAA检测培养基(DF+和DF-)中,于30 ℃ 180 r/min摇培至少48 h,吸取5 mL培养液,10 000 r/min离心15 min,取2 mL上清液于试管中,加入100 μL 10 mmol/L磷酸及4 mL反应液(1 mL 0.5 mol/L FeCl3溶于50 mL 35% HClO4中)。混合液于室温下反应25 min,检测A530nm的吸光值并根据标准曲线计算IAA产量。
1.3 脂肽类抗生素合成酶相关基因PCR检测
采用细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司)提取MH71菌株的基因组DNA。扩增所选基因的引物序列及PCR扩增程序等见表1。本研究中的引物合成和序列测定均由中美泰和生物技术(北京)有限公司完成。PCR均采用25 μL扩增体系:10 pmol/L上下游引物各1 μL,超纯dNTP mixture(10 mmol/L)1 μL,2.5 UTaqDNA聚合酶0.5 μL,10×PCR buffer 2.5 μL,基因组DNA模板(10 ng)1 μL,ddH2O 18 μL。PCR扩增产物用1%的琼脂糖凝胶电泳检测,目标条带经切胶回收后,将各目的基因插入pMD18-T载体上,获得的阳性克隆送往公司测序。所得序列利用DNAMAN 5.2.2软件和NCBI数据库的相关在线软件进行同源性检索和序列分析。

表1 扩增基因及引物序列
1.4 离体叶片和果实上的生防效果测定
番茄叶片上的离体检测。选用叶龄相同的新鲜健康番茄叶片(品种为‘佳粉19’),将叶片用自来水流水清洗干净后放入铺有3~5层吸水滤纸的培养皿(d=270 mm)中。将拮抗菌MH71在LB固体培养基上28 ℃活化培养24 h,接种一环于改良LB液体培养基(100 mL装量/500 mL三角瓶)中30 ℃ 180 r/min摇培48~72 h,然后用无菌生理盐水将发酵液稀释到A=0.6,制备成约 1.0×108cfu/mL的菌悬液,用无菌小型喷雾器在番茄叶片上均匀喷洒菌悬液,静止20 min待叶片上菌悬液晾干后,将在PDA平板上25 ℃培养了4~5 d的番茄灰霉病菌(B.cinerea)制备成d=5 mm的菌饼,将B.cinerea菌饼菌丝面朝下接种在番茄叶片上。以不接种拮抗菌,只接种B.cinerea菌饼作阳性对照,以只接种无菌水不接B.cinerea菌饼的为空白对照,共设3个处理,每处理至少3次重复。
番茄果实上的离体检测。挑选成熟度、物理状态尽量一致的新鲜番茄果实,用无菌水冲洗果实表面后再用75%乙醇棉球对果实表面消毒,待晾干后,先用无菌接种针在每个番茄果实腰周围等距离刺4个约4 mm(深)×3 mm(宽)的伤口,待伤口晾干后,每个果实上的4个伤口处分别接种10 μL的MH71发酵液、5倍稀释发酵液、50%啶酰菌胺水分散粒剂1 000倍液及清水对照,待发酵液及处理液被完全吸收后,所有处理均接种10 μL浓度为106个孢子/mL的番茄灰霉病菌孢子悬浮液,以清水处理做空白对照,50%啶酰菌胺水分散粒剂(德国巴斯夫股份有限公司)1 000倍液为化学农药对照。共设4个处理,每处理至少选择3个番茄果实。
将处理过的番茄叶片和果实均放置在20~22 ℃、昼夜光照、湿度为90%以上的环境条件下保湿培养,一般根据清水对照的发病情况,在第5~7天开始调查,用带有1 mm2小格的标尺测量病斑的直径,用病斑的面积计算对番茄灰霉病的防效。计算公式如下:防效=(C-T/C)×100%,其中C为清水对照病斑的平均面积,T为各处理的病斑平均面积。
1.5 数据处理
采用SPSS 11.5进行数据统计,用Duncan’s新复极差多重比较法进行显著差异性分析(P<0.05)。
2 结果与分析
2.1 拮抗菌MH71生防相关性状测定结果
在检测的生防相关性状中,拮抗菌MH71能够产生嗜铁素、蛋白酶和纤维素酶(见图1),不产生几丁质酶和磷酸酯酶。且随着培养时间延长,产素的有色晕圈或透明圈的直径也在持续增加。MH71菌株在含有色氨酸的培养基中产生IAA的量为4.098 μg/mL,在不含有色氨酸的培养基中产生IAA的量为1.559 μg/mL。
2.2 离体生防效果测定结果
在离体番茄叶片上检测了拮抗菌MH71对番茄灰霉病的防治效果,在检测的90片番茄叶片中(30片叶子拮抗菌MH71发酵液处理后接种番茄灰霉病菌,30片叶子清水处理后接种番茄灰霉病菌,30片叶子只用清水处理),结果表明,在接种后第5天调查时,经过拮抗菌MH71发酵液处理的番茄叶片上出现较小的水渍状病斑(病斑平均直径在0.3 cm以下)甚至没有病斑,而对照组叶片发病严重,凡病原菌菌丝触及的地方叶片表现出皱缩和腐烂的症状,病斑平均直径达1.0 cm以上,表明MH71的发酵液能够明显抑制番茄灰霉病病斑的扩展,对番茄灰霉病叶部防效达到92.8%(表2和图2)。
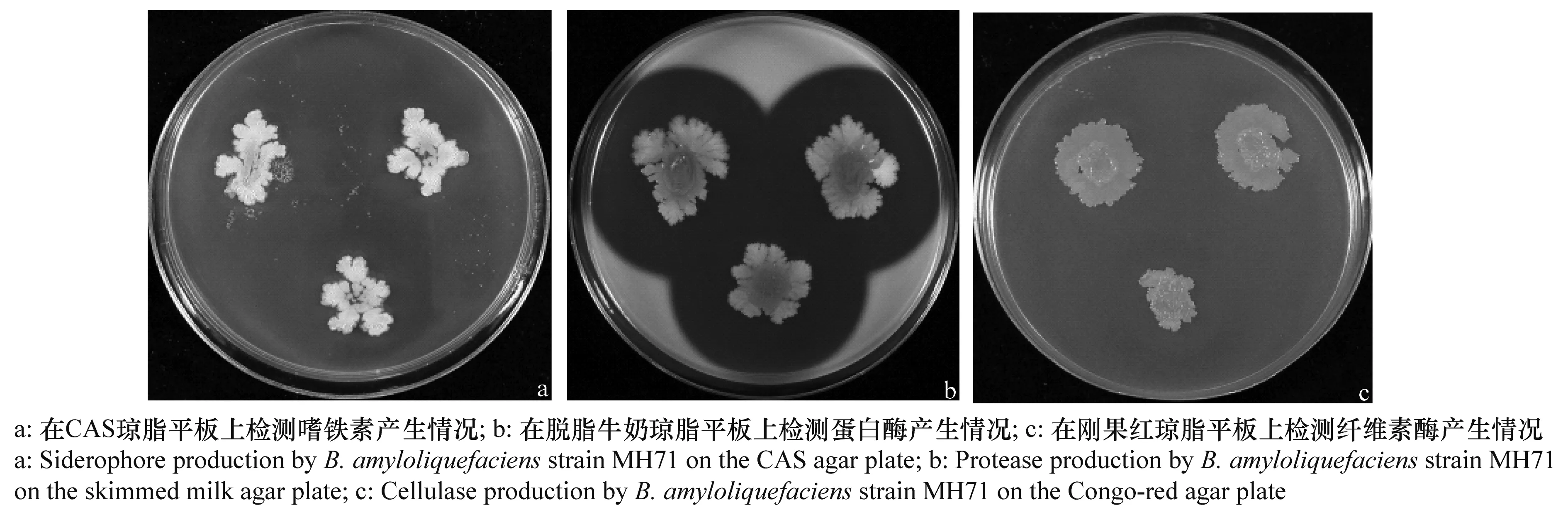
图1 MH71菌株生防相关性状检测结果(培养72 h)Fig.1 Biocontrol-related traits of strain MH71 (culture for 72 h)

处理Treatment5d时病斑平均面积/cm2Averageareaoflesion5daysaftertreatment防效/%Controlefficiency喷施清水后接种病原菌Inoculationafterwaterspraying0.06b-喷施MH71发酵液后接种病原菌InoculationaftersprayingwiththefermentationbrothofstrainMH710.83a92.8
1) 表中数据为3次重复的平均值,同列数据后不同小写字母表示差异显著(P<0.05)。
The data in the table are the average of three replicates; values followed by the different letters are significantly different (P<0.05).

图2 在离体叶片上对番茄灰霉病的防效测定(第5天调查结果)Fig.2 The efficacy of fermentation broth of Bacillus amyloliquefaciens strain MH71 in controlling Botrytis cinerea on tomato leaves
在番茄果实上检测了MH71菌株的发酵液对番茄灰霉病的防治效果,在检测的12个番茄果实中,MH71菌株的发酵液和5倍稀释发酵液能够明显地抑制番茄灰霉病病斑的扩展,具体见表3和图3。其中,在接种后的第7天调查时,MH71菌株的发酵原液、5倍稀释发酵液和50%啶酰菌胺水分散粒剂1 000倍液处理后的番茄均未出现病斑,而清水对照(病斑平均直径达2.57 cm以上)中在每个番茄的多个接种处出现明显的病斑和灰霉病菌的霉层。在接种后的第11天调查时,MH71菌株的发酵原液、5倍稀释液和50%啶酰菌胺水分散粒剂1 000倍液处理过的所有番茄仍未出现任何病斑,每个番茄上的接种处已经完全皱缩为一个干的小孔,而经清水对照处理过的番茄果实上大多接种处的周围几乎已经完全被浓密灰色的灰霉病菌霉层覆盖,有的接种处病斑十分明显且呈水渍状和凹陷状态。由上述结果可以看出,MH71的发酵液对灰霉病的发生和蔓延起到了有效的控制作用,其防治效果等同于目前生产上公认的应用较为广泛且效果较优的化学农药,即巴斯夫公司的50%啶酰菌胺水分散粒剂。

表3 不同处理在番茄果实上对番茄灰霉病的离体防效测定结果1)
1) 表中数据为3次重复的平均值,同列的相同小写字母表示差异不显著(P>0.05)。
The data in the table are the average of three replicates; values followed by the same letters are not significantly different (P>0.05).
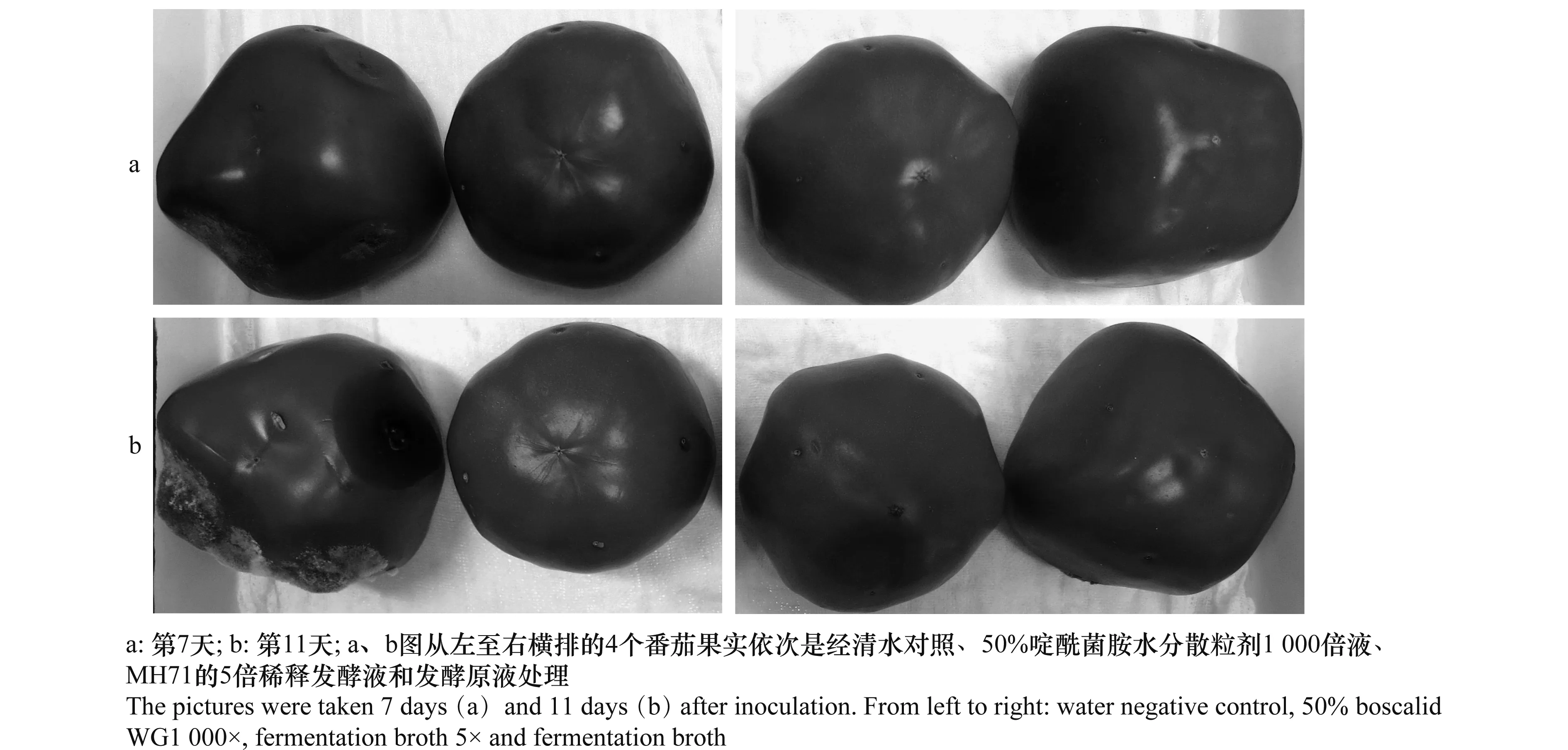
图3 MH71菌株发酵液对番茄灰霉病的防效测定结果Fig.3 The efficacy of fermentation broth of Bacillus amyloliquefaciens strain MH71 in controlling Botrytis cinerea on tomatoes
2.3 PCR检测脂肽类抗生素合成相关基因
利用4对引物,分别对解淀粉芽胞杆菌(B.amyloliquefaciens)MH71的基因组DNA进行PCR扩增,获得各目标片段(图4)。将目标片段分别回收纯化后送至公司测序,将测序获得的部分序列在NCBI上分别进行BLAST同源性分析。比对分析的结果表明,从解淀粉芽胞杆菌MH71中扩增的fenB基因,经测序获得该部分基因片段序列(GenBank基因登录号:KJ452559)与Bacillussp.916(WP007408572.1)、B.amyloliquefaciens(AER29830.1, AFP20616.1, ACE68434.1等)的fengycin synthetase B合成酶基因同源性均为98%;扩增的mycB基因部分片段(GenBank基因登录号:KJ452561)与B.amyloliquefaciensAS43.3(CP003838.1)中的IturinA 合成酶基因ituB同源性为95%,同时与B.amyloliquefaciensFZB42(CP000560.1)中的BmyB合成酶基因bmyB同源性为95%;扩增的ituA部分基因(GenBank基因登录号:KJ452560)与B.subtilisstrain 916(FJ194462.1)中的bacillorin operon基因同源性为97%,同时与B.amyloliquefaciensYAU B9601-Y2(HE774679.1)中的bacillomycin D 合成酶基因bamA同源性也为97%;扩增的sfp基因(GenBank基因登录号:KJ452562)与B.amyloliquefaciensstrain 96-79(EU882344.1)的sfp基因同源性为99%,与B.amyloliquefaciensCAU B946(HE617159.1)的sfp基因同源性也为99%。
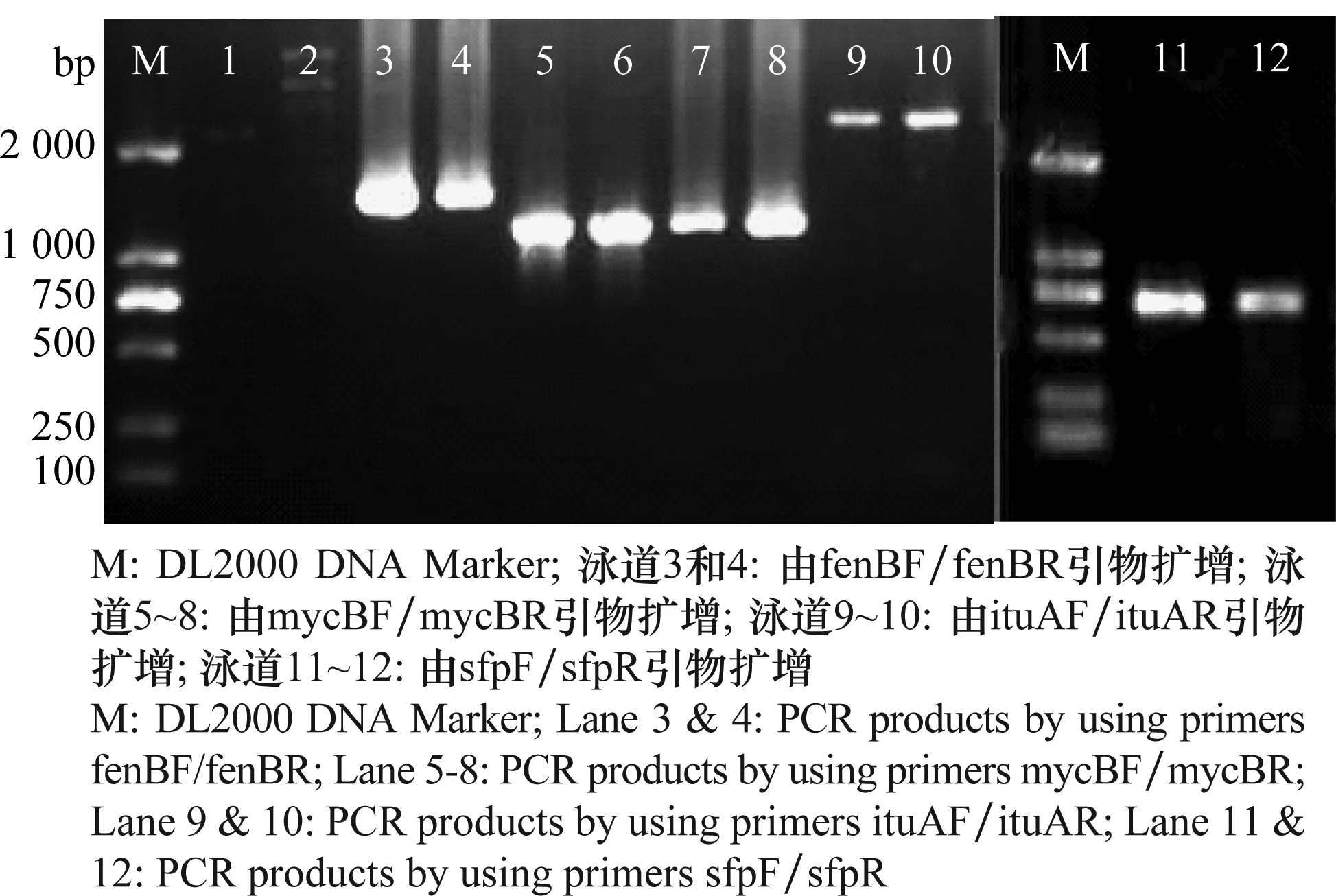
图4 PCR检测脂肽类抗生素基因Fig.4 PCR detection of lipopeptide antibiotics-related genes
3 结论与讨论
通过平板产素或产酶的活性定性测定,结果表明解淀粉芽胞杆菌(B.amyloliquefaciens)MH71能够分泌嗜铁素、蛋白酶、纤维素酶和IAA,不产几丁质酶和磷酸酯酶。生防菌MH71具有嗜铁菌的功能,嗜铁素(siderophore)是由嗜铁菌产生的一种小分子量、能特异螯合Fe3+的一种螯合因子,已有许多研究报道利用嗜铁菌产生的嗜铁素来防治植物病害和促进植物生长[15-19];MH71菌株还具有较强的分泌蛋白酶和纤维素酶的能力,辛雅芬等[20]指出,大量证据已表明许多由真菌和细菌产生的胞外酶都参与了微生物在植物病害生物防治的生防活动,为了获得有效的生物防治效果,通常需要酶和其他次生代谢物,尤其是抗生素的协同作用。这些酶除了在农业生产上的应用,在工业、医药、食品、饲料等多个行业都有应用,这也可以说明MH71菌株具有在多个研究领域开发的潜力。而关于定量检测MH71菌株的嗜铁素、蛋白酶和纤维素酶的产量及其各自在抑菌作用中发挥了多大的作用,尚需进一步研究。而且生防菌MH71在有无色氨酸的培养基中都能检测到IAA的产生,且在有色氨酸的培养基中产量比无色氨酸培养基中产量提高了近3倍,IAA是通过促进植物根系的生长从而提高植物生长量的[12],这需要进一步研究来验证生防菌MH71所产IAA对植物是否有真正的促生长作用。
解淀粉芽胞杆菌MH71的发酵液在离体番茄叶片和果实上对番茄灰霉病均有较明显的抑制效果,表明该菌在番茄灰霉病的防治方面具有较大生防潜力。国外已有解淀粉芽胞杆菌的成熟产品用于植物病害的生防上,如由美国Taensa公司开发已商品化的B.amyloliquefaciensFZBZ24,施用于温室或室内栽培树苗、灌木和装饰植物根部可防治Fusarium和Rizoctonia引起的根腐病[21]。目前国内利用解淀粉芽胞杆菌来防治番茄灰霉病有较多报道,但大多也是处于实验室研究阶段,如钱英等[22]报道解淀粉芽胞杆菌BW-13的发酵液对啤酒酵母和植物病原真菌灰霉菌具有显著的平板抑菌活性。宗志友等[23]报道解淀粉芽胞杆菌IMAUB1034活性物质的理化性质和盆栽试验中对甜瓜疫霉菌引起的病害的防治效果进行研究,其中该菌发酵液能够明显抑制灰葡萄孢的生长。而对于解淀粉芽胞杆菌MH71在温室和田间对番茄灰霉病稳定的防治效果以及对其发酵工艺、制剂生产及应用方式等多个方面尚需进行更为深入的研究。
利用抗生素合成基因的特异性引物PCR扩增目标菌株的基因组DNA,可以快速明确该菌株是否含有产生脂肽类抗生素的基因,基因克隆测序的结果可以为后期研究脂肽类抗生素提供重要的参考依据。根据本研究结果推测,解淀粉芽胞杆菌MH71的基因组中可能存在丰原素、杆菌抗霉素D、伊枯草菌素A和表面活性素的代谢合成操纵子序列,该菌株可能代谢产生上述几类脂肽类抗生素。这对后续的活性物质分离、纯化鉴定及作用机制等的相关研究提供了重要数据。而解淀粉芽胞杆菌MH71对灰霉病菌的生防抑制作用中,对于其分泌的嗜铁素、各种酶类及脂肽类抗生素,是其中的某一种类单独在起作用,抑或是多个种类在协同起作用,这需要进一步设计试验来验证。
[1] Thimon L, Peypoux F, Wallach J, et al. Effect of the lipopeptide antibiotic, iturin A, on morphology and membrane ultrastructure of yeast cells [J].FEMS Microbiology Letters, 1995, 128(2):101-106.
[2] Deleu M, Paquot M, Nylander T.Effect of fengycin, a lipopeptide produced byBacillussubtilis, on model biomembranes [J].Biophysical Journal, 2008, 94(7):2667-2679.
[3] 侯红漫, 靳艳, 金美芳, 等. 环脂肽类生物表面活性剂结构, 功能及生物合成[J].微生物学通报,2006, 33(5):122-128.
[4] Christofi N, Ivshina I B.Microbial surfactants and their use in field studies of soil remediation [J].Journal of Applied Microbiology, 2002, 93(6):915-929.
[5] Montesinos E.Antimicrobial peptides and plant disease control[J].FEMS Microbiology Letters, 2007, 270(1):1-11.
[6] 卢彩鸽,张殿朋,刘伟成,等.一株甘蓝枯萎病拮抗细菌的筛选、鉴定及其抑菌活性测定[J].华北农学报,2014,29(1):195-202.
[7] 方中达.植病研究方法[M].北京:中国农业出版社,1998:243-249.
[8] Schwyn B, Neilands J B.Universal chemical assay for the detection and determination of siderophores[J].Analytical Biochemistry,1987,160(1): 47-56.
[9] 陈天寿. 微生物培养基的制造与应用[M].北京:中国农业出版社,1995:494.
[10]Teather R M, Wood P J.Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen [J].Applied and Environmental Microbiology,1982,43(4):777-780.
[11]Pikovskaya R I. Mobilization of phosphorus in soil in connection with vital activity of some microbial species [J].Microbiologiya, 1948,17: 362-370.
[12]Patten C L, Glick B R.Role ofPseudomonasputidaindoleacetic acid in development of the host plant root system [J].Applied and Environmental Microbiology,2002,68(8):3795-3801.
[13]邓建良. 解淀粉芽孢杆菌YN-1抑制植物病原真菌活性物质研究[D].武汉: 华中农业大学,2009: 17-19.
[14]Hsieh F C, Li M C, Lin T C, et al. Rapid detection and characterization of surfactin-producingBacillussubtilisand closely related species based on PCR [J].Current Microbiology, 2004, 49(3):186-191.
[15]Miethke M, Marahiel M A.Siderophore-based iron acquisition and pathogen control [J].Microbiology and Molecular Biology Reviews, 2007, 71(3):413-451.
[16]Hotta K, Kim C Y, Fox D T, et al. Siderophore-mediated iron acquisition inBacillusanthracisand related strains [J].Microbiology, 2010,156(7):1918-1925.
[17]Hider R C, Kong X.Chemistry and biology of siderophores[J].Natural Product Reports, 2010, 27(5):637-657.
[18]Chu B C, Garcia-Herrero A, Johanson T H, et al. Siderophore uptake in bacteria and the battle for iron with the host; a bird’s eye view [J].Biometals, 2010, 23: 601-611.
[19]Lin S Y, Hameed A, Liu Y C, et al.Pseudomonassagittariasp. nov., a siderophore-producing bacterium isolated from oil-contaminated soil[J].International Journal of Systematic and Evolutionary Microbiology, 2013,63(7):2410-2417.
[20]辛雅芬, 刘晓光, 朱俊华, 等. 微生物酶及其在植物病害生物防治中的作用[J].安徽农业科学,2009, 37(7):3059-3062.
[21]Zhang H, Ma L, Wang L, et al. Biocontrol of gray mold decay in peach fruit by integration of antagonistic yeast with salicylic acid and their effects on postharvest quality parameters [J].Biological Control, 2008, 47(1):60-65.
[22]钱英, 汪琨, 章小洪, 等. 解淀粉芽孢杆菌 BW-13产生的抗真菌物质特性研究与初步分离纯化[J].浙江工业大学学报,2012,40(1):42-45.
[23]宗志友, 王海宽, 肖瑞峰, 等. 解淀粉芽孢杆菌IMAUB1034抗真菌活性物质的初步研究[J].天津科技大学学报,2012 (1):5-8.
(责任编辑:田 喆)
Detection of the genes encoding lipopeptide antibiotics and biocontrol activity ofBacillusamyloliquefaciensMH71
Lu Caige1, Zhang Dianpeng1, Liu Ting1, Dong Hongping1, Wang Junli2, Liu Weicheng1
(1. Institute of Plant and Environmental Protection, Beijing Academy of Agricultural and Forestry Sciences, Beijing 100097, China; 2.College of Agriculture, Guangdong Ocean University, Zhanjiang 524088, China)
An antagonisticBacillusamyloliquefaciensMH71, originally isolated from the permafrost soil samples collected from Mohe, showed a strong biocontrol activity against a large number of phytopathogenic fungi and bacteria. In this study, the biocontrol activity ofB.amyloliquefaciensMH71 was characterized and the effects of the strain in controlling grey mold on tomato leaves and fruits were examined by treating them with the fermentation broth of MH71. Moreover, the lipopeptide synthesis-related genes were detected by using specific primers. The results showed that the strain had the capability of producing siderophore, protease, cellulase and IAA, but not phosphatase and chitinase. Biocontrol tests indicated that, compared with water-control, the biocontrol efficacy of the fermentation broth of strain MH71 was 100% on tomato fruits 7 days and 11 days after inoculation, the same as that of 50% boscalid chemical control, but the biocontrol efficacy of the fermentation broth of strain MH71 was 92.8% on tomato leaves 5 days after inoculation. The lipopeptide synthase genesfenB,mycB,ituA,sfpwere successfully amplified from genomic DNA of the strain MH71. These results may provide an important reference for further evaluating the biocontrol potential ofB.amyloliquefaciensMH71, and for guiding the separation and identification of the active substances from MH71.
Bacillusamyloliquefaciens;Botrytiscinerea; lipopeptide antibiotics; biocontrol activity
2014-03-26
2014-07-21
北京市农林科学院植物保护环境保护研究所创新基金(CXJJ2012A04);北京市科技计划课题(Z121100001212002);北京市农林科学院科技创新专项(KJCX20140101);北京市农林科学院科技创新基金(CXJJ2013-13)
S476
A
10.3969/j.issn.0529-1542.2015.03.003
* 通信作者 E-mail: liuwich@163.com
