雷奈酸锶对大鼠应力缺失性骨丢失的防治作用
2015-11-24冯云波刘小坡曹国龙田发明
冯云波,刘小坡,曹国龙,田发明
雷奈酸锶对大鼠应力缺失性骨丢失的防治作用
冯云波1,刘小坡1,曹国龙1,田发明2
目的探讨雷奈酸锶对尾悬吊导致的应力缺失性大鼠骨质疏松的防治效果。方法6月龄SD大鼠30只,随机均分为3组:正常对照组(A组)、尾悬吊组(B组)、雷奈酸锶干预组(C组)。B、C两组大鼠采用尾悬吊法制备应力缺失型骨质疏松大鼠模型,C组给予1 g/(kg·d)雷奈酸锶干预,4周后处死所有大鼠,取左侧股骨检测骨密度,取左侧胫骨制备非脱钙组织切片并行骨形态计量学检测,取右侧股骨和胫骨骨髓细胞体外培养并向成骨细胞诱导分化,取第4代细胞及血清检测骨钙素(OCN)的表达。结果B组骨密度低于A组,C组高于B组(P<0.05)。B组骨小梁体积(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)低于A、C组,破骨细胞数(Oc.N)、骨吸收长度比(Er. Pm)高于A组,C组骨形成率(BFR/BV)、矿化长度比(L.Pm)高于B组,Er.Pm、Oc.N低于B组(P<0.05)。B、C组OCN mRNA表达水平高于A组,但血清中OCN水平B组低于A、C组(P<0.05)。结论尾悬吊4周可造成大鼠骨丢失,雷奈酸锶可抑制其骨量丢失,作用机制可能与其通过上调OCN的表达促进骨形成有关。
骨质疏松;有机金属化合物;噻吩类;大鼠,Sprague-Dawley;雷奈酸锶
骨质疏松以骨量减少、微观结构退变、脆性增加、易于发生骨折为其主要特点,以往研究认为失重或应力降低可导致机体骨形成能力下降,进而诱发骨丢失乃至骨质疏松。有研究表明,局部注射硫酸钙可显著改善骨质疏松椎体的微观结构和生物力学性能,降低潜在的骨折风险[1]。雷奈酸锶是新型抗骨质疏松药物,由一个有机酸及两个非放射性锶原子组成,锶参与骨的矿化,具有促进成骨细胞增殖和抑
制破骨细胞活性的功能,进而表现出同时促进骨形成和抑制骨吸收的双重作用功效。本研究旨在探讨雷奈酸锶对应力缺失性骨质疏松的防治效果及其作用机制。
1 材料与方法
1.1 材料6月龄雄性SD大鼠30只,体质量(400±20)g,购自北京维通利华有限公司,自由进食水。雷奈酸锶,国药准字J20080098,购自施维雅(天津)制药有限公司。北京博麦德生物技术公司Rotor-Gene 3000荧光定量PCR系统产自澳大利亚。
1.2 动物分组及处理所有大鼠采用随机数字表法随机分为正常对照组(A组)、尾悬吊组(B组)、雷奈酸锶干预组(C组),每组10只。B、C两组大鼠采用悬吊法制备应力缺失型骨质疏松大鼠模型,C组给予1 g/(kg·d)雷奈酸锶干预,实验持续4周,大鼠处死前10 d和4 d分别给予皮下注射30 mg/ kg四环素和5 mg/kg钙黄绿素。
1.3 标本的采集和处理取左侧股骨采用双能X线法检测骨密度;取左侧胫骨保存于70%乙醇中,制备非脱钙组织切片并行骨形态计量学检测;取右侧股骨和胫骨骨髓细胞体外培养并向成骨细胞诱导分化,取第4代细胞采用Real-time PCR法检测骨钙素(OCN)mRNA的表达,Western blot分析OCN蛋白的表达水平,取血清采用ELISA法检测OCN含量。
1.4 检测指标
1.4.1 骨密度检测将左侧股骨用包被软组织剔除,应用Norland-XR36双能X线骨密度测量仪(DEXA,美国),采用小动物模式测量骨密度。
1.4.2 骨组织形态计量学骨标本制作和测量方法骨组织不脱钙制片:处死大鼠后截取左侧胫骨近端固定于70%乙醇,经甲基丙烯酸酯包埋、制备不脱钙切片,行Giemsa染色,观察动态荧光标记情况的切片不作染色。用Leica DM LB2荧光/光学显微镜及Leica DC300数码摄像系统进行观察与摄取图像。骨计量学测量范围为胫骨近端干骺端生长板下1~4 mm内的次级松质骨,分内、中、外三点随机录入微机,每个标本采取6个图像,然后采用Leica QWin多功能彩色病理图像分析软件进行骨组织形态计量学参数测定,包括静态参数:骨小梁体积(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp);动态参数:矿化长度比(L. Pm)、骨形成率(BFR/BV)、骨吸收长度比(Er.Pm)、单位面积破骨细胞数(Oc.N)。
1.4.3 骨髓基质干细胞的提取和诱导培养无菌条件下取大鼠右侧股骨和胫骨,用完全DMEM培养液(青霉素100 U/ mL,链霉素100 mg/L,胎牛血清100 mL/L,)反复冲洗骨髓腔,收集骨髓细胞,接种于培养瓶中(2瓶/只),CO250 mL/L,37℃温箱中培养。24 h后换液,以后每2~3 d更换培养液,弃掉未贴壁的悬浮细胞。第2次换液后加入条件培养基,向成骨细胞(50 mg/L维生素C,10 mmol/L β-甘油磷酸钠)诱导。
1.4.4 Real-time PCR检测OCN的表达第4代细胞长满瓶底后,采用Trizol一步法提取细胞总RNA,定量后反转录合成第一链cDNA,行Real-time PCR反应。PCR反应体系:总体积50 μL,包括Real-time PCR MasterMix 25 μL,引物(10 μmol/L)各2 μL,cDNA模板5 μL,去DEPC水16 μL。反应条件:50℃2 min,95℃10 min;95℃15 s,60℃1 min,50个循环。溶解曲线法分析产物特异性引物由北京博麦德生物技术公司合成。GAPDH:上游5′-TGCTGAGTATGTCGTG⁃GAG-3′,下游5′-GTCTTCTGAGTGGCAGTGAT-3′;OCN:上游5′-CCATGAGGACCCTCTCTCTGC-3′,下游5′-AAACG⁃GTGGTGCCATAGATGC-3′。通过Rotor-Gene 3000软件运用ΔΔCt法分析OCN mRNA的表达。
1.4.5 Western blot分析OCN的蛋白表达水平提取第4代细胞总蛋白,BCA法测定蛋白浓度,根据测得的蛋白含量,计算含30µg蛋白的溶液体积即为上样量,常规电泳及转膜后,将PVDF膜在TBST中漂洗3次,每次10 min,然后移至含有BSA的平皿中室温摇动封闭2 h,以封闭非特异性抗原。封闭结束后将膜与OCN抗体4℃孵育过夜。次日加入二抗(1∶1 000)稀释液中,37℃摇床孵育2 h,TBST缓冲液洗膜后,加入适量BCIP/NBT显色液显色,在避光环境下进行显色。待蛋白条带清晰后立刻取出PVDF膜,置于清水中终止显色,并以GAPDH为内参。
1.4.6 ELISA法检测血清OCN的含量经大鼠心脏取血2 mL/只,静置30 min后,4℃2 000 r/min离心10 min,取血清。采用双抗体夹心酶标免疫分析法测定标本中OCN的水平,操作过程严格按照说明书,酶标仪进行光密度定量测定。
1.5 统计学方法实验数据建立EXCEL数据库,采用SPSS 13.0进行统计学分析,实验数据以均数±标准差表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 骨密度检测结果A、B、C组左侧股骨骨密度分别为(0.200 1±0.003 7)、(0.185 9±0.006 4)和(0.192 7±0.005 2)g/cm2,差异有统计学意义(F= 14.758,P<0.05),B、C组低于A组,C组高于B组(P<0.05)。
2.2 骨组织形态计量学检测结果B组的BV/TV、Tb.Th、Tb.N低于A、C组,Tb.Sp高于A、C组,C组BV/TV低于A组(P<0.05);B、C组Er.Pm、Oc.N高于A组,且C组低于B组(P<0.05);C组L.Pm和BFR/BV高于B组(P<0.05),见图1、表1。
2.3 细胞培养结果细胞接种初期可见大量悬浮细胞,24 h换液后可见少数细胞伸角变形。随成骨诱导培养时间延长,细胞由典型梭形或多角形的成纤维细胞样生长,逐渐生长变大并变形为三角形或多边形,传至第4代时可见细胞外基质分泌,见图2。
2.4 OCN的表达B、C组OCN mRNA表达水平高于A组(A组设定为1,B组1.74±0.35,C组2.38± 0.49),C组高于B组(F=26.541,P<0.05)。B、C组OCN蛋白表达水平低于A组(A组0.208±0.020,B
组0.107±0.016,C组0.142±0.016),C组OCN的表达高于B组(F=52.055,P<0.05),见图3。A、B、C组OCN的含量分别为(0.947±0.154)、(0.572±0.124)和(0.787±0.083)µg/L,B、C组低于A组,C组高于B组(F=7.509,P<0.05)。

Fig.1Fluorescence observation in unstained section(×200)图1 未染色切片行荧光观察(×200)
Tab.1Results of bone histomorphometry analysis表1 骨组织形态计量学检测结果(n=10,)
Tab.1Results of bone histomorphometry analysis表1 骨组织形态计量学检测结果(n=10,)
*P<0.05;a与A组比较,b与B组比较,P<0.05
Tb.Th(μm)80.91±10.24 51.32±8.19a 69.13±9.92ab 18.232*BFR/BV(%/年)46.38±3.79 51.92±7.25 68.33±7.21ab 26.263*组别A组B组C组F组别A组B组C组F BV/TV(%)34.28±3.90 20.80±3.19a 26.80±3.71ab 27.894*L.Pm(%)10.04±1.24 11.14±1.62 15.83±1.85ab 29.868*Tb.N(个/mm)3.20±0.63 1.78±0.36a 2.74±0.28b 20.872*Er.Pm(%)6.36±0.97 17.10±2.91a 10.53±2.21ab 48.957*Tb.Sp(μm)399.47±91.83 882.63±127.85a 553.72±158.28ab29.744*Oc.N(个/mm2)0.11±0.04 0.37±0.08a 0.20±0.06ab 37.434*

Fig.2The primary(A)and 2nd(B)passage of BMSCs(×200)图2 体外培养的骨髓基质干细胞(×200)(A:原代细胞;B:第2代细胞)
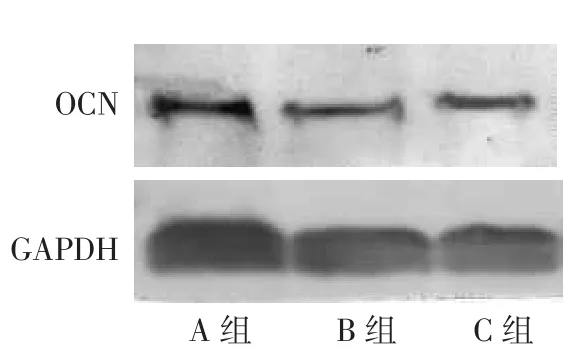
Fig.3Western blot of OCN图3 Western blot检测OCN表达结果
3 讨论
本研究采用尾悬吊造成6月龄大鼠后肢失负重引起应力缺失4周,经骨密度检测及骨组织形态计量学分析确实发生骨质疏松。而雷奈酸锶全程干预可显著提高尾悬吊大鼠股骨骨密度,一定程度上阻止其骨量的丢失,但不能使其恢复至正常组大鼠水平。
尾悬吊是公认的模拟应力缺失导致的骨质疏松模型的制作方法,以往研究中多以3月龄甚至更小的大鼠为干预对象[2-4],虽然3月龄随激素水平趋于稳定,但生长过于旺盛,有潜在影响实验结果的可能,因此本研究选用6月龄大鼠为干预对象。
骨密度是临床诊断骨质疏松症的金标准,基础研究中也多以此作为判断动物模型制作成功与否的技术手段。骨组织形态计量学是基于体视学原理用于分析骨组织骨量、微结构、骨吸收、类骨质形成、矿化等多个指标的检测手段。本研究将两者有机结合,一方面观察尾悬吊大鼠骨量、微结构以及骨转换参数变化,另一方面判断雷奈酸锶对尾悬吊大鼠骨量丢失的干预效果及机制。结果发现尾悬吊4周后大鼠骨量丢失明显,但松质骨的骨形成参数与正常对照组无显著差别,但骨吸收参数显著高于对照组,这与先前报道的拟失重造成的骨量丢失主要是源于骨形成能力的下降[5-6]似乎不符,但经过仔细分析数据后发现,骨量下降后,计算骨形成率的基数也随之下降,在矿化能力(即单位天数的双荧光标记间距)相同的情况下,骨量越小骨形成率也越高,即在尾悬吊与正常对照组骨量有显著差异的基础上,骨形成率的相近仍然提示尾悬吊组骨形成能力的下降。
雷奈酸锶全程干预结果是显著提高骨量,改善骨小梁微结构,促进骨形成,抑制骨吸收,这也与先前报道的雷奈酸锶同时具有促进骨形成和抑制骨吸收作用功效的结论一致[7-9]。
骨钙素是骨代谢标志物之一,主要反映骨形成能力。骨髓基质干细胞具有多方向分化潜能[10-11],在体内体外环境中均可在适宜刺激下向成骨细胞分化。为验证在体刺激对骨髓基质干细胞成骨分化的影响,本研究成功诱导骨髓基质干细胞向成骨细胞分化,并于分化晚期检测了OCN的mRNA表达水平,结果发现尾悬吊大鼠OCN mRNA的表达高于对照组。而蛋白水平的研究结果却发现尾悬吊组和雷奈酸锶干预组大鼠OCN的表达均低于对照组,mRNA水平和蛋白水平表达的差异可能提示尾悬吊
后大鼠自身反馈激发了骨形成潜能,但由于力学刺激不足或其他原因导致OCN的翻译或合成分泌受阻,最终分泌到外周血中的OCN水平也随之下降。雷奈酸锶则在提高OCN mRNA表达水平的同时也促进OCN蛋白水平的表达,但其作用机制有待进一步研究。
综上,尾悬吊可造成大鼠骨量丢失,雷奈酸锶可通过提高骨髓基质干细胞OCN的表达,促进骨形成、抑制骨吸收、改善松质骨微结构部分组织其骨量丢失,改善骨质量。
[1]Liu D,Zhang Y,Liao DF,et al.The effect of intraosseous injection of calcium sulfate on microstructure and biomechanics of osteoporot⁃ic lumbar vertebrae in sheep[J].Med J Chin PLA,2014,39(9):685-689.[刘达,张译,廖冬发,等.硫酸钙强化对骨质疏松绵羊腰椎微观结构和生物力学的影响[J].解放军医学杂志,2014,39(9): 685-689].doi:10.11855/j.issn.0577-7402.2014.09.02.
[2]Zhang R,Gong H,Zhu D,et al.Seven day insertion rest in whole body vibration improves multi-level bone quality in tail suspension rats[J].PLoS One,2014,9(3):e92312.doi:10.1371/journal. pone.0092312.eCollection 2014.
[3]Hashemian SJ,Rismanchi M,Esfahani EN,et al.Effect of calcitriol supplementation and tail suspension on serum biomarkers of bone formation in rats[J].J Diabetes Metab Disord,2015,14:14.doi: 10.1186/s40200-015-0142-5.eCollection 2015.
[4]Xu D,Zhao X,Li Y,et al.The combined effects of X-ray radiation and hindlimb suspension on bone loss[J].J Radiat Res,2014,55(4): 720-725.doi:10.1093/jrr/rru014.
[5]Vandamme K,Holy X,Bensidhoum M,et al.Impaired osteoblasto⁃genesis potential of progenitor cells in skeletal unloading is associat⁃ed with alterations in angiogenic and energy metabolism profile[J]. Biomed Mater Eng,2012,22(4):219-226.doi:10.3233/BME-2012-0711.
[6]Macias BR,Swift JM,Nilsson MI,et al.Simulated resistance training, but not alendronate,increases cortical bone formation and suppresses sclerostin during disuse[J].J Appl Physiol(1985),2012,112(5):918-925.doi:10.1152/japplphysiol.00978.2011.Epub 2011 Dec 15.
[7]Reginster JY,Kaufman JM,Goemaere S,et al.Maintenance of anti⁃fracture efficacy over 10 years with strontium ranelate in postmeno⁃pausal osteoporosis[J].Osteoporos Int,2012,23(3):1115-1122.doi: 10.1007/s00198-011-1847-z.Epub 2011 Nov 29.
[8]Cianferotti L,D′Asta F,Brandi ML.A review on strontium ranelate long-term antifracture efficacy in the treatment of postmenopausal osteoporosis[J].Ther Adv Musculoskelet Dis,2013,5(3):127-139. doi:10.1177/1759720X 13483187.
[9]Fernández JM,Molinuevo MS,McCarthy AD,et al.Strontium ranelate stimulates the activity of bone-specific alkaline phospha⁃tase:interaction with Zn(2+)and Mg(2+)[J].Biometals,2014,27(3): 601-607.doi:10.1007/s10534-014-9733-8.
[10]Yamaguchi DT."Ins"and"Outs"of mesenchymal stem cell osteo⁃genesis in regenerative medicine[J].World J Stem Cells,2014,6(2): 94-110.doi:10.4252/wjsc.v6.i2.94.
[11]Sassoli C,Pini A,Chellini F,et al.Bone marrow mesenchymal stro⁃mal cells stimulate skeletal myoblast proliferation through the para⁃crine release of VEGF[J].PLoS One,2012,7(7):e37512.doi: 10.1371/journal.pone.0037512.
(2015-03-16收稿 2015-05-12修回)
(本文编辑 魏杰)
Effect of Strontium ranelate on stress-absence induced osteoporosis
FENG Yunbo1,LIU Xiaopo1,CAO Guolong1,TIAN Faming2
1 Department of Orthopedic Surgery of Tangshan Gongren Hospital,Tangshan 063000,China;2 Medical Research Center of Hebei United University
ObjectiveTo investigate the preventive effect of Strontium ranelate on stress-absence induced osteoporo⁃sis in tail-suspended rat.MethodsA total of 30 SD rats with average age of 6 month were randomly divided into 3 groups(n=10 in each group):Group A was normal control group while rats in group B and C were subjected to tail suspension test to establish stress absence models.Rats in group C were administered with Strontium ranelate[1 g/(kg·d)].All rats were sacri⁃ficed 4 weeks later.Left femurs were harvested for bone mineral density(BMD)test and prepared for undecalcified tissue sec⁃tion and thereby bone histomorphometry assessment.Bone marrow from right femurs and tibias were cultured and induced to⁃wards osteogenic-differentiation.The expression levels of osteocalcin in the fourth-passage cultured bone marrow cells and in blood serum were detected separately.ResultsRats in group B showed markedly decreased BMD comparing to those in group A and C(P<0.05).Trabecular volume(BV/TV),number(Tb.N)and thickness(Tb.Th)in group B were lower than those in group A and C;erosion percentage(Er.Pm)and osteoclast number(Oc.N)in group B and C were higher than those in group A;comparing to those in group B,bone formation rate(BFR/BV),labeled percentage(L.Pm),were higher in group C, coupled with decreased Er.Pm and Oc.N(P<0.05).mRNA expression levels of OCN in group B and C were higher than those of group A.But its level in plasma were lower in group B than those in group A and C(P<0.05).ConclusionTail suspension could induce osteosporosis.Strontium ranelate prevent bone loss in stress-absence osteoporosis in rat induced by tail-suspension for 4 weeks,which might be partially through upregulating the expression of OCN,thereby promoting bone formation.
osteoporosis;organometallic compounds;thiophenes;rats,Sprague-Dawley;Strontium ranelate
R681
A
10.11958/j.issn.0253-9896.2015.10.023
1唐山市工人医院骨外科(邮编063000);2河北联合大学医学实验研究中心
冯云波(1971),男,硕士,副主任医师,主要从事骨质疏松防治方面研究
