饮水铅暴露对大鼠脑组织过氧化氢、羟自由基和脂质过氧化的影响
2015-11-24肖元梅徐群英张中伟李伟冯建高任清风任晓慧李炜娟
肖元梅,徐群英,张中伟,李伟,冯建高,任清风,任晓慧,李炜娟
饮水铅暴露对大鼠脑组织过氧化氢、羟自由基和脂质过氧化的影响
肖元梅,徐群英,张中伟,李伟,冯建高,任清风,任晓慧,李炜娟
目的探讨乙酸铅对大鼠大脑皮质、小脑、海马组织自由基和脂质过氧化的影响。方法48只刚断乳雄性SD大鼠,按体质量采用随机区组法分为4组(对照组和低、中、高剂量组),对照组大鼠饮用去离子水,低、中、高剂量组分别饮用200、400、800 mg/L的乙酸铅溶液。连续染毒60 d后,取血进行血铅测定,取各组脑组织(大脑皮质、小脑和海马)进行羟自由基抑制活力、过氧化氢(H2O2)水平及丙二醛(MDA)含量的测定。结果与对照组相比,各染铅组大鼠血铅含量显著升高,大脑皮质、小脑和海马组织羟自由基抑制活力明显下降,且随染铅剂量的升高呈逐渐下降趋势(P<0.05);大脑皮质、小脑和海马组织H2O2水平及MDA含量高于对照组,并随着染铅剂量的升高呈逐渐升高趋势(P<0.05);大脑皮质、小脑和海马组织的羟自由基抑制活力与血铅含量呈负相关(r分别为-0.505、-0.414、-0.448,P<0.05),H2O2和MDA含量均与血铅含量呈正相关(r分别为0.301、0.411、0.378和0.404、0.324、0.510,P<0.05)。结论铅可通过诱发自由基产生,导致大鼠脑组织发生脂质过氧化反应。
铅;过氧化氢;丙二醛;羟自由基;脂质过氧化作用;脑组织;大鼠,Sprague-Dawley
铅对环境和人群健康的危害越来越大,已成为一个全球性的公共卫生问题[1],它是一种对人体没有任何生理功能、反而具有毒性的非必需重金属元素,越来越多的研究表明铅毒性没有安全阈值[2]。但铅损伤的确切机制至今尚不十分清楚。随着自由基研究的不断进展,从自由基方面探讨铅毒性机制受到广泛关注。神经系统是铅毒性作用的重要靶器官,本文通过给予大鼠饮用不同剂量乙酸铅溶液后,全面研究其大脑皮质、小脑、海马组织自由基和脂质过氧化水平的变化及其与血铅水平的关系,为进一步
探讨铅神经毒性机制提供科学依据。
1 材料与方法
1.1 主要试剂与仪器三水合乙酸铅(分析纯,西陇化工厂);羟自由基、过氧化氢(H2O2)及丙二醛(MDA)测定试剂盒(南京建成生物工程研究所生产);组织蛋白质测定试剂盒(碧云天生物技术研究所);铅溶液标准物质(国家标准物质信息平台,标准号GBW08619);QYDO-10A去离子水系统(重庆前沿水处理设备有限公司);722可见分光光度计(上海兴茂仪器公司);BS124S万分之一电子天平(北京赛多利斯科学仪器有限公司);SORVALL LEGEND MICRO.17R低温离心机(美国Thermo公司);AAS SOLAAR M6石墨炉原子吸收分光光度计(美国Thermo公司)。
1.2 实验动物分组及处理刚断乳雄性、健康SPF级SD大鼠48只,体质量100~120 g(购自北京维通利华实验动物有限公司),适应性喂养1周后按体质量采用随机区组法分为对照组和低、中、高剂量组,每组12只:采用自由饮水的方式进行染毒,对照组大鼠饮用去离子水;低、中、高剂量组分别饮用200、400、800 mg/L的乙酸铅溶液,连续染毒60 d。最后一次染毒后第2天,以60 mg/kg体质量戊巴比妥钠腹腔注射麻醉动物,取股动脉血40 μL进行血铅测定,之后在冰上迅速取出全脑,并用冰冷的生理盐水冲净血液,分离出左侧大脑皮质、小脑和海马,称质量后置于液氮中保存备用。
1.3 检测指标及其方法(1)全血铅含量测定:用石墨炉原子吸收分光光度法,按国家标准规定[3]的方法进行测定。(2)脑组织羟自由基抑制活力、H2O2水平及MDA含量测定:在冰浴中用冰生理盐水将脑组织制成10%的组织匀浆,4℃4 500 r/min离心10 min后吸取上清液,置于冰浴中待用。各指标的测定均按照试剂盒所示方法进行。
1.4 统计学方法采用SPSS 13.0软件进行数据的整理和统计处理,各组比较采用单因素方差分析,组间多重比较采用LSD-t法,指标间的关联性分析用Pearson直线相关。以P<0.05为差异有统计学意义。
2 结果
2.1 各组血铅含量比较饮入乙酸铅溶液后,大鼠血铅水平均高于对照组(P<0.01),并随饮水乙酸铅浓度的升高,血铅含量逐渐增加,有较好的剂量反应关系,两两比较除低、中剂量两组间外,其余各两组间差异均有统计学意义,见表1。
2.2 各组大鼠脑组织羟自由基抑制活力比较饮用乙酸铅后,各剂量组大鼠大脑皮质、小脑和海马组织的羟自由基抑制活力均低于对照组(P<0.05),随着染铅剂量的升高,各脑组织羟自由基抑制活力基本呈逐渐下降趋势,见表1。
2.3 各组大鼠脑组织H2O2含量比较各染铅组大鼠大脑皮质、小脑和海马组织H2O2水平高于对照组(P<0.05),并随着染铅剂量的升高,各脑组织H2O2水平基本呈逐渐升高趋势,见表2。
Tab.1Comparison of blood lead levels and hydroxyl free radical inhibiting activity in rat brain tissue between four groups表1 各组大鼠血铅含量及脑组织羟自由基抑制活力比较(n=12)
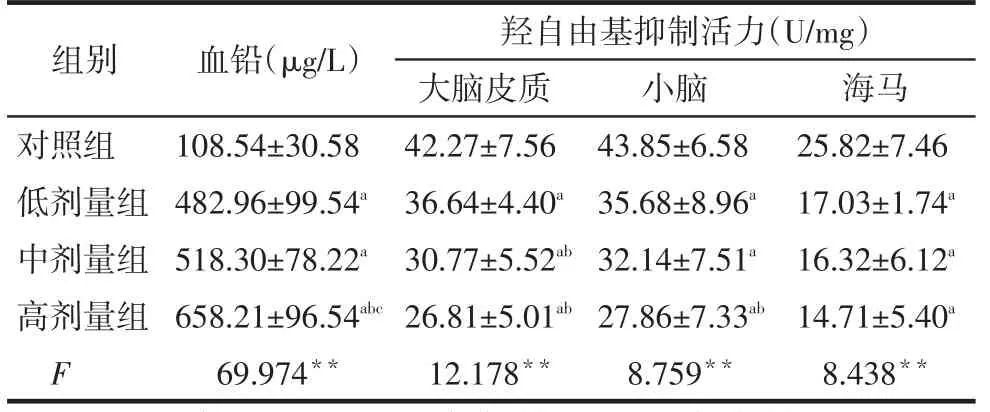
Tab.1Comparison of blood lead levels and hydroxyl free radical inhibiting activity in rat brain tissue between four groups表1 各组大鼠血铅含量及脑组织羟自由基抑制活力比较(n=12)
**P<0.01;a与对照组相比,b与低剂量组比,c与中剂量组比,P<0.05;表2、3同
血铅(μg/L)108.54±30.58 482.96±99.54a 518.30±78.22a 658.21±96.54abc 69.974**组别对照组低剂量组中剂量组高剂量组F羟自由基抑制活力(U/mg)大脑皮质42.27±7.56 36.64±4.40a 30.77±5.52ab 26.81±5.01ab 12.178**小脑43.85±6.58 35.68±8.96a 32.14±7.51a 27.86±7.33ab 8.759**海马25.82±7.46 17.03±1.74a 16.32±6.12a 14.71±5.40a 8.438**
Tab.2Comparison of levels of hydrogen peroxide(H2O2)in rat brain tissue between four groups表2 各组大鼠脑组织H2O2水平比较(n=12,mmol/g)

Tab.2Comparison of levels of hydrogen peroxide(H2O2)in rat brain tissue between four groups表2 各组大鼠脑组织H2O2水平比较(n=12,mmol/g)
大脑皮质17.51±3.43 21.96±4.38a 22.04±4.63a 24.27±7.46a 5.998**组别对照组低剂量组中剂量组高剂量组F小脑9.44±0.93 15.78±1.85a 15.94±2.62a 17.99±2.55abc 28.006**海马11.28±1.83 14.58±1.73a 14.95±2.50a 15.98±1.71a 7.025**
2.4 各组大鼠脑组织MDA含量比较各染铅组大鼠大脑皮质、小脑和海马组织MDA含量均高于对照组(P<0.05),并随着染铅剂量的升高,各脑组织MDA水平基本呈逐渐升高趋势,见表3。
Tab.3Contents of malondialdehyde in rat brain tissue in all four groups表3 不同染铅剂量组大鼠脑组织MDA含量(n=12,μmol/g)
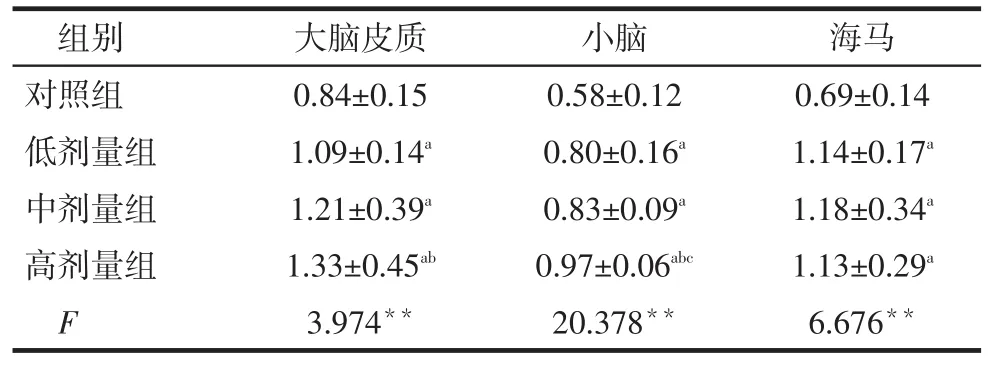
Tab.3Contents of malondialdehyde in rat brain tissue in all four groups表3 不同染铅剂量组大鼠脑组织MDA含量(n=12,μmol/g)
大脑皮质0.84±0.15 1.09±0.14a 1.21±0.39a 1.33±0.45ab 3.974**组别对照组低剂量组中剂量组高剂量组F小脑0.58±0.12 0.80±0.16a 0.83±0.09a 0.97±0.06abc 20.378**海马0.69±0.14 1.14±0.17a 1.18±0.34a 1.13±0.29a 6.676**
2.5 脑组织各指标与血铅含量的相关性不同部位脑组织羟自由基抑制活力与大鼠血铅含量呈显著负相关,而H2O2和MDA含量均与血铅含量呈正相关(均P<0.05),见表4。
3 讨论
目前认为,诱导产生自由基、导致氧化应激增强在铅毒性机制中发挥着重要作用,可能是铅致毒的
主要机制之一[4]。Shakoor等[5]将油菜幼苗暴露于不同浓度铅溶液后,其H2O2和MDA水平升高并致植物生长受到抑制。有研究将PC12细胞用铅处理后,细胞内活性氧自由基(ROS)明显增加[6]。以上研究提示铅可能一方面能作为自由基的启动剂而诱发ROS的产生,另一方面可能通过抑制体内抗氧化系统的活力,使机体处于氧化应激状态[7-8]。本研究结果显示,大鼠饮用含铅溶液后,大脑皮质、小脑和海马组织H2O2含量显著升高,其羟自由基抑制活力明显下降,并与血铅水平呈剂量-反应关系,提示铅可导致大鼠脑组织自由基水平增加,这可能是其毒性作用的机制之一。
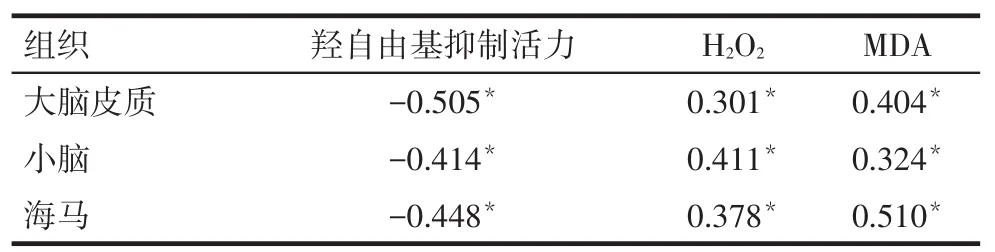
Tab.4Correlation coefficients between hydroxyl free radical inhibiting activity,H2O2level,MDA level and blood lead level表4 脑组织羟自由基抑制活力、H2O2和MDA含量与血铅的相关系数(r)
活性氧自由基对机体造成的重大损害之一是攻击细胞膜上的多不饱和脂肪酸,使其氧化而致脂质过氧化[9]。MDA是主要的脂质过氧化产物之一,是目前反映机体氧化损伤最具代表性的指标,它能结合细胞膜上的蛋白质、酶或者受体使其功能发生改变最终导致细胞损伤,严重时可导致细胞死亡[10-11]。脑组织中含有大量的不饱和脂肪酸[12-13],因而具有高水平的氧化代谢能力,容易遭受自由基的侵袭,从而发生脂质过氧化反应。此次实验显示,各染铅组大鼠大脑皮质、小脑和海马组织MDA含量明显高于对照组,并与血铅含量呈剂量-反应关系,提示铅可致大鼠脑组织发生脂质过氧化。
综上,饮水染铅可致大鼠脑组织清除自由基能力下降而致自由基和脂质过氧化水平升高。铅可能通过诱发自由基产生,导致脂质过氧化反应,产生MDA等一系列对机体有害的产物,从而对大鼠脑组织造成损伤,其具体的分子机制有待于进一步深入研究。
[1]Tong S,von Schirnding YE,Prapamontol T.Environmental lead ex⁃ posure:a public health problem of global dimensions[J].Bull World Health Organ,2000,78(9):1068-1077.
[2]Needleman H.Low level lead exposure:history and discovery[J].Ann Epidemiol,2009,19(4):235-238.doi:10.1016/j.annepidem.2009.01.022.
[3]Determination of blood lead by graphite furnace atomic absorption spectrometric method.Health industrial standard of the People's Republic of China[S].WS/T 20-1996.[血中铅的石墨炉原子吸收光谱测定方法[S].中华人民共和国卫生行业标准.WS/T 20-1996].
[4]Lee DH,Lim JS,Song K,et al.Graded associations of blood lead and urinary cadmium concentrations with oxidative-stress-related markers in the U.S.population:results from the third National Health and Nutrition Examination Survey[J].Environ Health Per⁃spect,2006,114(3):350-354.
[5]Shakoor MB,Ali S,Hameed A,et al.Citric acid improves lead(pb)phytoextraction in brassica napus L.by mitigating pb-induced mor⁃phological and biochemical damages[J].Ecotoxicol Environ Saf, 2014,109:38-47.doi:10.1016/j.ecoenv.2014.07.033.
[6]Guo S,Zhou J,Chen X,et al.Bystander effects of PC12 cells treat⁃ed with Pb²+depend on ROS-mitochondria-dependent apoptotic signaling via gap-junctional intercellular communication[J].Toxi⁃col Lett,2014,229(1):150-157.doi:10.1016/j.toxlet.2014.05.026.
[7]Saxena G,Flora SJ.Lead-induced oxidative stress and hematologi⁃cal alterations and their response to combined administration of cal⁃cium disodium EDTA with a thiol chelator in rats[J].J Biochem Mol Toxicol,2004,18(4):221-233.
[8]El-Nekeety AA,El-Kady AA,Soliman MS,et al.Protective effect of Aquilegia vulgaris(L.)against lead acetate-induced oxidative stress in rats[J].Food Chem Toxicol,2009,47(9):2209-2215.doi: 10.1016/j.fct.2009.06.019.
[9]Tian HY,Li ZX,Wang HJ,et al.Effect of caprine testicular extract on acrosome formation of spermatids of lead-injured mice[J].Med J Chin PLA,2012,37(11):1040-1043.[田洪艳,李质馨,王弘珺,等.羊睾丸提取液对铅损伤小鼠精子顶体形成的影响[J].解放军医学杂志,2012,37(11):1040-1043].
[10]Nourazarian AR,Kangari P,Salmaninejad A.Roles of oxidative stress in the development and progression of breast cancer[J].Asian Pac J Cancer Prev,2014,15(12):4745-4751.
[11]Ho E,Karimi Galougahi K,Liu CC,et al.Biological markers of oxi⁃dative stress:Applications to cardiovascular research and practice[J]. Redox Biol,2013,1(1):483-491.doi:10.1016/j.redox.2013.07.006.
[12]Xiong ZY.Research on biology of sport-related free radical[M].Bei⁃jing:Science press,2010:241.[熊正英.运动自由基生物学研究[M].北京:科学出版社,2010:241].
[13]HE P,GUO JG.Effects and mechanism of erythropoietin on the cog⁃nitive function of kainic acid-induced epileptic rats[J].Chin J Con⁃temp Neurol Neurosurg,2015,15(5):401-405.[赫鹏,郭金刚.红细胞生成素对海人酸致痫大鼠认知功能影响及作用机制[J].中国现代神经疾病杂志,2015,15(5):401-405].
(2015-04-15收稿 2015-05-15修回)
(本文编辑 闫娟)
Effects of lead exposure in drinking water on hydrogen peroxide,hydroxyl free radicals and lipid peroxidation levels in brain tissues of rats
XIAO Yuanmei,XU Qunying,ZHANG Zhongwei,LI Wei,FENG Jiangao,REN Qingfeng,REN Xiaohui,LI Weijuan
School of Public Health,Nanchang University,Nanchang 330006,China
ObjectiveTo explore the effects of lead acetate on free radicals and lipid peroxidation in the cerebral cor⁃tex,cerebellum,and hippocampus in rat brains.MethodsSD rats(n=48),who were just weaned,were randomly divided in⁃to 4 groups base on their weight.Then the rats were fed with lead acetate in drinking water at the final concentrations of 0 mg/L(deionized water),200 mg/L,400 mg/L,800 mg/L respectively.Blood lead level as well as the hydroxyl free radical inhibiting activity,the levels of hydrogen peroxide(H2O2)and malondialdehyde(MDA)in cerebral cortex,cerebellum,and hippocam⁃pus were measured 60 days after lead contamination in water.ResultsUpon lead exposure,blood lead levels increased sig⁃nificantly as compared with the control.The hydroxyl free radical inhibiting activity in cerebral cortex,cerebellum,and hip⁃pocampus decreased significantly in a dose dependent manner of lead(P<0.05).And they all correlated negatively with blood lead level(r=-0.505,-0.414,-0.448,P<0.05).By contrast,blood lead level was positively correlated with H2O2and MDA in these brain tissues(r=0.301,0.411,0.378,and 0.404,0.324,0.510,P<0.05).ConclusionLead exposure can lead to lipid peroxidation of rat brain tissues through inducing free radicals.
lead;hydrogen peroxide;malondialdehyde;hydroxyl radical;lipid peroxidation;brain tissue;rats,Sprague-Dawley
R994.4
A
10.11958/j.issn.0253-9896.2015.10.009
国家自然科学基金资助项目(81160342);江西省自然科学基金项目(20122BAB205047);江西省教育厅科技项目(GJJ11312)
南昌大学公共卫生学院(邮编330006)
肖元梅(1972),女,副教授,博士,主要从事重金属中毒机制与防治研究
