Exendin-4对大鼠脊髓损伤后氧化应激和神经细胞凋亡的影响
2015-11-24赵兴长李昊天王继权孙平褚鑫吕刚范仲凯
赵兴长,李昊天,王继权,孙平,褚鑫,吕刚,范仲凯
实验研究
Exendin-4对大鼠脊髓损伤后氧化应激和神经细胞凋亡的影响
赵兴长,李昊天,王继权,孙平,褚鑫,吕刚,范仲凯△
目的研究Exendin-4对大鼠脊髓损伤后氧化应激和神经细胞凋亡的作用。方法成年雄性SD大鼠36只(体质量200~250 g)随机分为3组(n=12):假手术组(Sham组)、单纯脊髓损伤组(SCI组)、Exendin-4组(Ex-4组)。Sham组只暴露脊髓,不打击;SCI组和Ex-4组均采用Allen′s重物打击法制作脊髓损伤模型;Ex-4组在脊髓损伤后立即腹腔内注射Exendin-4溶液,剂量10µg/只;SCI组和Sham组均注射等体积生理盐水。在24 h后检测各组脊髓组织中丙二醛(MDA)含量和过氧化氢酶(CAT)活性,TUNEL法检测神经细胞凋亡情况,Western blot检测caspase-9和凋亡诱导因子(AIF)的表达情况。结果与Sham组相比,SCI组脊髓组织中的MDA含量明显增加,caspase-9和AIF表达水平明显增加,神经细胞凋亡比例明显升高,CAT活性明显降低(P<0.01)。与SCI组相比,Ex-4组脊髓组织中MDA含量明显降低,caspase-9和AIF表达水平明显降低,神经细胞凋亡比例明显降低,CAT活性明显升高(P<0.01)。结论大鼠脊髓损伤后,Exendin-4可通过减轻氧化损伤抑制神经细胞凋亡。
脊髓损伤;氧化性应激;细胞凋亡;胰高血糖素样肽1;大鼠,Sprague-Dawley;Exendin-4
脊髓损伤(spinal cord injury,SCI)是一种严重的创伤性疾病,其治疗与康复一直是研究热点。脊髓损伤分为原发损伤和继发损伤两个阶段,原发损伤主要是机械性组织损伤和急性细胞坏死,继发性损伤则包括氧化应激反应、炎症反应、钙离子调动等一系列病理生理过程。其中,氧化应激是脊髓损伤后神经细胞凋亡和功能紊乱的重要诱导因素[1-2]。因此,脊髓损伤后减轻氧化损伤成为治疗的关键。胰
高血糖素样肽-1(GLP-1)是由小肠L细胞分泌的一种血糖依赖性促胰岛激素[3],临床上已经用于治疗2型糖尿病[4]。但GLP-1在体内半衰期短,易被降解而失去生物学活性[5],其应用受到明显限制。Exendin-4是一种长效GLP-1受体激动剂[6],已经被美国食品药品监督管理局(FDA)批准用于2型糖尿病的治疗。有研究表明,Exendin-4对心肌缺血再灌注损伤[7]和周围神经损伤具有治疗作用[8]。但目前尚鲜见Exendin-4作用于脊髓损伤的研究。本研究旨在观察Exendin-4对脊髓损伤后氧化应激和神经细胞凋亡的影响,初步探讨其作用机制。
1 材料与方法
1.1 实验动物及分组SPF级健康成年雄性SD大鼠36只(辽宁医学院实验动物中心提供),体质量200~250 g。应用随机数字表法将大鼠分为3组,每组12只。SCI组:采用Allen′s重物打击法制作脊髓损伤模型。对照组(Sham组):暴露脊髓后不打击,其他手术操作同SCI组。Exendin-4(Ex-4)组:制备脊髓损伤模型后立刻腹腔内注射Exendin-4溶液(Exendin-4溶于无菌生理盐水),剂量为10µg/只,SCI组和Sham组均注射等体积生理盐水。
1.2 主要试剂与仪器Exendin-4(美国sigma公司);丙二醛(MDA)测定试剂盒、过氧化氢酶(CAT)测定试剂盒(南京建成生物工程研究所);RIPA裂解液(强)、BCA蛋白浓度测定试剂盒和超敏ECL化学发光试剂盒均购自碧云天生物技术研究所;In Situ Cell Death Detection Kit,TMR red(Roche公司);兔抗鼠凋亡诱导因子(AIF)一抗、兔抗鼠caspase-9一抗、小鼠抗大鼠β-actin一抗、山羊抗兔IgG二抗(ab175773)和山羊抗大鼠IgG二抗(ab175751)均购自美国abcam公司。电泳仪和酶标仪(Bio-Rad公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);HC-3018高速冷冻离心机(科大创新股份有限公司);BT100-1L蠕动泵(保定兰格恒流泵有限公司);冰冻切片机和荧光显微镜DMI4000B(Leica公司);721分光光度计(上海精密科学仪器有限公司)。
1.3 模型制备大鼠腹腔内注射10%水合氯醛3 mL/kg,充分麻醉后,将大鼠固定于手术台,常规消毒后背皮肤。定位T9棘突,以此为中心逐层切开皮肤、皮下组织、肌层,用咬骨钳去除T9、T10棘突及椎板,充分暴露脊髓。参照Allen′s法重物打击脊髓,打击后脊髓充血肿胀,大鼠双后肢痉挛性抽动,尾巴痉挛性摆动,视为模型制备成功。再次消毒切口后逐层缝合皮肤,分笼饲养,自由摄取食物和水,间断按摩膀胱协助排尿。
1.4 检测样品制备各组大鼠接受预处理24 h后,取出脊髓组织用于制备蛋白样品,参照RIPA裂解液(强)说明书进行操作:将新鲜脊髓组织剪碎,加入RIPA裂解液和苯甲基磺酰氟(PMSF)并混匀,用超声波细胞粉碎机粉碎30 s,以上操作在冰浴条件下进行,将混悬液置于高速冰冻离心机4℃、12 000×g离心5 min,取上清液备用。
1.5 MDA和CAT活性检测将新鲜蛋白样品按照MDA、 CAT检测试剂盒使用说明书进行检测。
1.6 Western blot检测制备的蛋白样品按照BCA蛋白浓度测定试剂盒的说明进行检测,根据标准曲线计算出样品的蛋白浓度。将适当比例的蛋白样品、TBS、RSB混合煮沸,冷却至室温后按照每个孔道30µg蛋白量加样品,进行聚丙烯酰胺凝胶电泳;然后转印至PVDF膜,封闭液室温浸泡1 h,分别用caspase-9一抗(1∶500)、β-actin一抗(1∶1 000)和AIF一抗(1∶1 000)浸泡PVDF膜,4℃摇床孵育过夜;洗膜液洗膜3次,5 min/次;二抗室温孵育1 h,洗膜液洗膜3次,5 min/次;超敏ECL化学发光试剂盒中Beyo ECL Plus A液和Beyo ECL Plus B液等体积混合后滴加于PVDF膜,曝光显像。用Image J软件分析图像,计算出caspase-9和AIF蛋白相对表达量(AIF/β-actin,caspase-9/β-actin)。
1.7 TUNEL检测大鼠接受处理条件24 h后,腹腔内注射10%水合氯醛3 mL/kg,充分麻醉后开胸暴露心脏;将蠕动泵细针穿入主动脉,止血钳固定;依次用生理盐水和4%多聚甲醛溶液灌注20 min;固定后迅速取出T9、T10节段脊髓组织,4%多聚甲醛溶液4℃固定24 h,30%蔗糖溶液浸泡脱水24 h。将处理后的组织在-20℃条件下用OCT包埋,冰冻切片机连续切取组织切片,厚度为5 μm。按照TUNEL试剂盒说明书进行染色,在荧光显微镜下观察。在400倍视野下,打击部位周边组织切片随机读取6个不重叠的区域,观察并计数TUNEL阳性细胞(胞核呈红色)和细胞总数(胞核呈蓝色),以细胞凋亡比例(红色细胞数/蓝色细胞数)表示神经细胞凋亡情况。
1.8 统计学方法采用SPSS 16.0统计学软件进行分析,计量数据均采用均数±标准差()表示,组间比较采用单因素方差分析,多重比较采用LSD-t检验,Р<0.01为差异有统计学意义。
2 结果
2.1 MDA含量和CAT活性比较与Sham组相比,SCI组、Ex-4组MDA含量明显增加而CAT活性明显降低(P<0.01);与SCI组相比,Ex-4组MDA含量明显降低而CAT活性明显增加,差异均有统计学意义(P<0.01),见表1。
Tab.1MDA level and CAT activity in spinal cord in different groups表1 各组脊髓中MDA含量和CAT活性比较(n=6,)

Tab.1MDA level and CAT activity in spinal cord in different groups表1 各组脊髓中MDA含量和CAT活性比较(n=6,)
**P<0.01;a与Sham组比较,b与SCI组比较,P<0.01;表2同
组别S h a m组S C I组E x -4组F C A T(U / m g)3 . 7 4 5 ± 0 . 3 3 3 1 . 5 6 4 ± 0 . 1 5 5a2 . 4 6 8 ± 0 . 2 0 8ab1 2 1 . 3 0 3**M D A(μ m o l / g)0 . 8 2 1 ± 0 . 0 7 4 2 . 4 7 2 ± 0 . 2 3 0a1 . 4 9 4 ± 0 . 2 8 4ab8 9 . 1 9 4**
2.2 caspase-9和AIF蛋白表达水平比较SCI组caspase-9和AIF蛋白相对表达量较Sham组明显增加,Ex-4组caspase-9和AIF蛋白相对表达量较
SCI组明显降低,较Sham组明显增加,差异均有统计学意义(均P<0.01),见图1、表2。
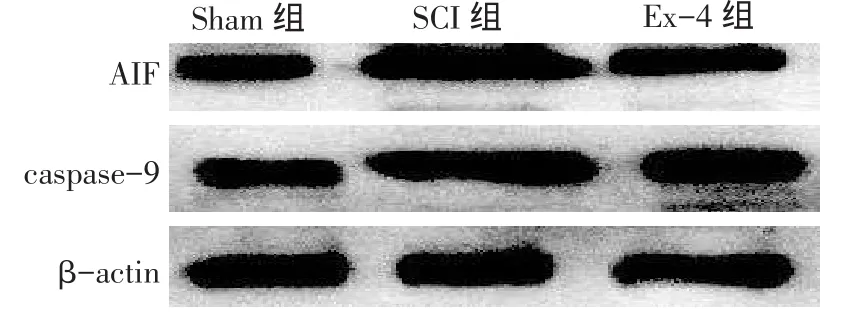
Fig.1Expressions of caspase-9 and AIF protein shown by Western blot图1 Western blot检测caspase-9蛋白和AIF蛋白表达
Tab.2The relative expressions level of caspase-9 and AIF as well as neuronal apoptosis rate表2 caspase-9蛋白和AIF蛋白相对表达水平和神经细胞凋亡比例比较(n=6,)

Tab.2The relative expressions level of caspase-9 and AIF as well as neuronal apoptosis rate表2 caspase-9蛋白和AIF蛋白相对表达水平和神经细胞凋亡比例比较(n=6,)
组别S h a m组S C I组E x -4组F c a s p a s e -9 0 . 6 7 6 ± 0 . 0 5 4 1 . 3 3 4 ± 0 . 1 0 4a1 . 0 2 4 ± 0 . 0 7 3ab1 0 2 . 0 5 3**A I F 0 . 5 8 1 ± 0 . 0 5 2 1 . 2 4 7 ± 0 . 1 0 9a0 . 9 2 8 ± 0 . 0 7 1ab1 0 2 . 8 0 9**神经细胞凋亡比例0 . 0 2 3 ± 0 . 0 1 0 0 . 3 1 4 ± 0 . 0 3 8a0 . 1 9 9 ± 0 . 0 3 9ab1 2 4 . 8 6 9**
2.3 各组神经细胞凋亡结果比较SCI组与Sham组相比,神经细胞凋亡比例明显增加(P<0.01),Ex-4组神经细胞凋亡比例明显低于SCI组而高于Sham组,差异均有统计学意义(均P<0.01),见图2、表2。

Fig.2TUNEL staining in each group(Fluorescence Microscope,×400)图2 各组TUNEL染色图像(荧光显微镜,×400)
3 讨论
脊髓损伤是一种严重的外科疾病,影响患者的生存质量甚至导致患者死亡。脊髓损伤分为两个阶段:早期机械性原发损伤和中晚期炎症反应、氧化应激、细胞凋亡等一系列继发性损伤[2]。脊髓损伤后,氧化活性物质大量产生,超过机体的代偿能力,氧化损伤与抗氧化损伤的平衡被打破,最终引起神经细胞DNA损伤和蛋白表达异常,产生细胞毒效应,诱导神经细胞凋亡[9-11]。因此,脊髓损伤后减轻氧化损伤对于脊髓损伤的治疗具有重要的意义。
GLP-1是一种包含30个氨基酸的肠促激素,由胰高血糖素原基因转录、翻译后加工修饰形成[3]。研究证实,GLP-1对神经系统损伤有保护作用[12]。Exendin-4作为一种长效GLP受体激动剂,已经在临床上用于治疗2型糖尿病[13]。实验研究表明,Exendin-4能够抑制氧化应激诱导的胰腺β细胞凋亡[14],促进神经再生[8],对脑缺血再灌注损伤具有保护作用[15]。因此,笔者推测Exendin-4对脊髓损伤的治疗也有重要意义。
本研究首先检测氧化损伤,SCI组MDA含量较Sham组明显增加,Ex-4组MDA含量较SCI组明显降低;SCI组CAT活性较Sham组明显降低,Ex-4组CAT活性较SCI明显升高,与以往研究相同[16]。MDA是脂质过氧化的终产物,其含量直接反映组织氧化损伤的程度;CAT是过氧化物酶系的标志酶,其活性是组织抗氧化能力的重要标志[10]。脊髓损伤后,大量氧化活性物质堆积,超过机体代偿能力,氧化损伤加重,抗氧化能力明显降低。Exendin-4明显降低脊髓组织中MDA含量、增加抗氧化酶CAT的活性,减轻氧化损伤,促进机体抗氧化能力的恢复。进一步检测神经细胞凋亡情况,Western blot结果显示:SCI组凋亡相关蛋白caspase-9和AIF相对表达量较Sham组明显增加,而Ex-4组caspase-9和AIF相对表达量较SCI组明显降低。TUNEL结果显示:SCI组神经细胞凋亡比例明显高于Sham组,结果同以往研究[9]。Ex-4组神经细胞凋亡比例较SCI组明显降低。脊髓损伤后,各种刺激因素破坏线粒体膜,通过激活内源性细胞凋亡途径和非caspase依赖的细胞凋亡途径诱导神经细胞凋亡。内源性细胞凋亡途径:线粒体释放的细胞色素c与凋亡蛋白酶激活因子相互作用,顺序激活caspase-9、caspase-3及caspase-7,最终诱导神经细胞凋亡[17]。非caspase依赖的细胞凋亡途径:线粒体释放AIF,AIF转移到细胞核后导致染色体凝集和DNA断裂,最终诱导神经细胞凋亡[18]。脊髓损伤后腹腔内注射Exendin-4,caspase-9、AIF相对表达量和神经细胞凋亡比例明显降低,其机制可能是Exendin-4减少过氧化物质的产生,提高机体的抗氧化能力,抑制内源性细胞凋亡途径和非caspase依赖的细胞凋亡途径,减少神经细胞凋亡。
综上所述,大鼠脊髓损伤后,Exendin-4可通过
减轻氧化损伤抑制神经细胞凋亡。本研究只是初步探讨了Exendin-4对脊髓损伤的保护作用及机制,今后还需要进一步研究脊髓损伤的机制,探索治疗脊髓损伤的新药物、新方法。
[1]Wang W,Shen H,Xie JJ,et al.Neuroprotective effect of ginseng against spinal cord injury induced oxidative stress and inflammatory responses[J].Int J Clin Exp Med,2015,8(3):3514-3521.
[2]Ambrozaitis KV,Kontautas E,Spakauskas B,et al.Pathophysiology of acute spinal cord injury[J].Medicina(Kaunas),2006,42(3):255-261.
[3]Holst JJ.The physiology of glucagon-like peptide1[J].Physiol Rev,2007,87(4):1409-1439.
[4]Calanna S,Christensen M,Holst JJ,et al.Secretion of glucagonlike peptide-1 in patients with type 2 diabetes mellitus:systematic review and meta-analyses of clinical studies[J].Diabetologia,2013,56(5):965-972.doi:10.1007/s00125-013-2841-0.
[5]Cao Y,Gao W,Jusko WJ.Pharmacokinetic/pharmacodynamic modeling of GLP-1 in healthy rats[J].Pharm Res,2012,29(4):1078-1086.doi:10.1007/s11095-011-0652-x.
[6]Bhavsar S,Mudaliar S,Cherrington A.Evolution of exenatide as a diabetes therapeutic[J].Curr Diabetes Rev,2013,9(2):161-193.
[7]Timmers L,Henriques JPS,de Kleijn DPV,et al.Exenatide reduces infarct size and improves cardiac function in a porcine model of ischemia and reperfusion injury[J].J Am Coll Cardiol,2009,53(6): 501-510.doi:10.1016/j.jacc.2008.10.033.
[8]Yamamoto K,Amako M,Yamamoto Y,et al.Therapeutic effect of exendin-4,a long-acting analogue of glucagon-like peptide-1 receptor agonist,on nerve regeneration after the crush nerve injury[J]. Biomed Res Int,2013,2013:315848.doi:10.1155/2013/315848.
[9]Jia ZQ,Wang YS,Li G,et al.The protective effect of ebselen on mitochondrial damage after spinal cord injury in rats[J].Tianjin Med J,2014,42(8):765-768.[贾志强,王岩松,李刚,等.依布硒啉对大鼠急性脊髓损伤后线粒体的保护作用[J].天津医药,2014,42(8):765-768].doi:10.3969/j.issn.0253-9896.2014.08.009.
[10]Morsy MD,Mostafa OA,Hassan WN.A potential protective effect of α-tocopherol on vascular complication in spinal cord reperfusion injury in rats[J].J Biomed Sci,2010,17(1):55.doi:10.1186/1423-0127-17-55.
[11]Yang YH,Wang Z,Zheng J,et al.Protective effects of gallic acid against spinal cord injury-induced oxidative stress[J].Mol Med Rep,2015,12(2):3017-3024.doi:10.3892/mmr.2015.3738.
[12]Hölscher C.Potential role of glucagon-like peptide-1(GLP-1)in neuroprotection[J].CNS Drugs,2012,26(10):871-882.doi: 10.2165/11635890-000000000-00000.
[13]Garber AJ.Novel GLP-1 receptor agonists for diabetes[J].Expert Opin Investig Drugs,2012,21(1):45-57.doi:10.1517/13543784.201 2.638282.
[14]Li Z,Zhou Z,Huang G,et al.Exendin-4 protects mitochondria from reactive oxygen species induced apoptosis in pancreatic beta cells[J]. PLoS One,2013,8(10):e76172.doi:10.1371/journal.pone.0076172.
[15]Teramoto S,Miyamoto N,Yatomi K,et al.Exendin-4,aglucagonlike peptide-1 receptor agonist,provides neuroprotection in mice transient focal cerebral ischemia[J].J Cereb Blood Flow Metab,2011,31(8):1696-1705.doi:10.1038/jcbfm.2011.51.
[16]Cavus G,Altas M,Aras M,et al.Effects of montelukast and methylprednisolone on experimental spinal cord injury in rats[J].Eur Rev Med Pharmacol Sci,2014,18(12):1770-1777.
[17]Wu CC,Bratton SB.Regulation of the intrinsic apoptosis pathway by reactive oxygen species[J].Antioxid Redox Signal,2013,19(6): 546-558.doi:10.1089/ars.2012.4905.
[18]Sevrioukova IF.Apoptosis-inducing factor:structure,function,and redox regulation[J].Antioxid Redox Signal,2011,14(12):2545-2579.doi:10.1089/ars.2010.3445.
(2015-06-22收稿 2015-07-30修回)
(本文编辑 李国琪)
Effect of Exendin-4 on oxidative stress and neural apoptosis following spinal cord injury
ZHAO Xingzhang,LI Haotian,WANG Jiquan,SUN Ping,CHU Xin,LYU Gang,FAN Zhongkai△
Department of Orthopedics,First Affiliated Hospital of Liaoning Medical College,Jinzhou,Liaoning 121001,China△
ObjectiveTo study the effect of Exendin-4 on oxidative stress and neural apoptosis following spinal cord injury(SCI).MethodsAdult male SD rats,with weight between 200-250 g,were randomly divided into three groups(12 in each group):Sham group,SCI group and Exendin-4 group(Ex-4 group).Rats in Sham group achieved spinal cord exposure. SCI group and Ex-4 group were induced according to Allen′s test(using a weight-drop device).Rats in Ex-4 group were administrated with Exendin-4(10µg/rat)through intraperitoneal injection immediately after establishment of SCI models.Rats in Sham group and SCI group were given the same volume of normal saline solution instead.Level of malondialdehyde(MDA)and the activity of catalase(CAT)were assessed in spinal cord tissues 24 hour after drug administrations.Neural apoptosis was detected by TUNEL staining and the expression levels of caspase-9 and AIF were determined using Western blot.ResultsCompared with Sham group,the levels of MDA,caspase-9 and AIF as well as neuronal apoptosis rate increased obviously,while activity of CAT decreased markedly in SCI group(P<0.01).Compared with SCI group,the levels of MDA,caspase-9 and AIF as well as the neuronal apoptosis rate decreased obviously,while activity of CAT increased remarkably in Exendin-4 group(P<0.01).ConclusionExendin-4 restrain neural apoptosis following spinal cord injury through relieving oxidative damage.
spinal cord injuries;oxidative stress;apoptosis;glucagon-like peptide 1;rats,Sprague-Dawley;Exendin-4
R681.54
A
10.11958/j.issn.0253-9896.2015.12.008
国家自然科学基金资助项目(81272074);辽宁省高等学校优秀人才支持计划项目(LJQ2014091);辽宁医学院校长基金(AH2014012)
辽宁医学院附属第一医院骨科(邮编121001)
赵兴长(1989),男,硕士在读,主要从事脊髓损伤的机制及修复研究
△通讯作者E-mail:flanzz@163.com
