表没食子儿茶素没食子酸酯与西妥昔单抗联用体内外抗食管癌细胞Eca-109的作用研究
2015-11-24商悦刘旭杰陈淑珍
商悦,刘旭杰,陈淑珍
·论著·
表没食子儿茶素没食子酸酯与西妥昔单抗联用体内外抗食管癌细胞Eca-109的作用研究
商悦,刘旭杰,陈淑珍
目的研究表没食子儿茶素没食子酸酯(EGCG)与西妥昔单抗联用体内外抗食管癌Eca-109的作用。
方法采用MTT法检测化合物对肿瘤细胞增殖的影响;采用克隆形成法检测EGCG对肿瘤细胞克隆形成的影响;采用流式细胞术检测化合物对肿瘤细胞凋亡的影响;采用动物实验评价药物或EGCG对移植于裸鼠的移植瘤的生长抑制作用;同时采用免疫组化的方法检测药物或EGCG对血管形成的影响。
结果EGCG能够剂量依赖性地抑制Eca-109细胞增殖,其IC50值为43.22 μmol/L。经克隆形成法检测结果表明,EGCG能够明显抑制Eca-109细胞的克隆形成,IC50值为28.49 μmol/L。EGCG能够显著引起Eca-109细胞凋亡,60和80 μmol/L EGCG诱导的凋亡百分率分别为(21.70± 0.62)%、(57.13±9.09)%。EGCG和西妥昔单抗联用对Eca-109细胞的增殖抑制作用较单独用药组强,具有相加作用。体内实验结果表明,EGCG和西妥昔单抗均能抑制Eca-109裸鼠移植瘤的生长,两者联用存在增强作用。EGCG和西妥昔单抗均能抑制裸鼠移植瘤的血管形成,两者联用血管形成抑制作用较单用组更强。
结论EGCG能够抑制食管癌Eca-109的细胞增殖和克隆形成,具有诱导Eca-109细胞凋亡作用,与西妥昔单抗联用在体内外均具有增强作用。
儿茶酚类;药物筛选试验,抗肿瘤;食管肿瘤;西妥昔单抗
世界范围内,食管癌的发病率在肿瘤发病率中排名第六,每年新发病例约为450 000[1]。我国是世界上食管癌相对高发的地区。对食管癌的预防和治疗进行研究将具有重要意义。
茶多酚是绿茶的主要活性成分,主要以儿茶素的单体形式存在,而表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)在儿茶素中含量最高,活性最大[2]。EGCG单用具有中度的抗肿瘤活性,能够增强抗肿瘤药物的抗肿瘤活性、降低抗肿瘤药物的毒性、逆转耐药性等[3],如EGCG与紫杉醇联用能够协同抑制非小细胞肺癌H460细胞增殖[4]。EGCG不但能抑制肿瘤的生长,也能抑制肿瘤的侵袭和转移,抑制肿瘤的血管形成,具有多重效应[5]。
西妥昔单抗(cetuximab,Cet)是靶向表皮生长因子受体(epidermal growth factor receptor,EGFR)的IgG1型的嵌合型单克隆抗体,能与内源性的EGFR配体竞争性地结合EGFR,且亲和力明显高于内源性配体[6],是一种大分子靶向抗肿瘤药物。在临床上单用或与伊立替康联用于EGFR过度表达的、对以伊立替康为基础的化疗方案耐药的转移性直肠癌的治疗,其作用机制是通过拮抗EGFR受体介导的信号通路,从而产生抑制肿瘤的细胞生长、血管形成、侵袭转移等多重效应;同时也可以通过抗体依赖的细胞毒作用(antibodydepedent cell-mediated cytotoxicity,ADCC)产生抗肿瘤作用[7]。
基于以上所述,EGCG和Cet均具有抑制肿瘤的细胞生长、血管形成、侵袭转移等多重效应,因此,我们研究两者联用对食管癌是否具有增效作用。
1 材料与方法
1.1 材料
1.1.1 药品与试剂绿茶提取物EGCG由绿康天然产物有限责任公司提供,批号为D98-120602;Cet注射液由勃林格殷格翰药业公司生产(100 mg/瓶,进口药品注册号S20110009);兔超敏二步法免疫组化检测试剂盒和ZLI-9018浓缩型DAB试剂盒购自北京中杉金桥公司;一抗CD31购自美国Abcam公司,批号为2530-1;Annexin V-FITC凋亡检测试剂盒购自碧云天生物技术研究所。
1.1.2 实验动物6~8周BALB/c裸鼠,体重18~22 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2007-0001。
1.2 方法
1.2.1 细胞培养人食管癌Eca-109细胞由本室保存。细胞用含10%小牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养液在含5%CO2的37℃温箱中培养,每周传代2~3次,常规消化,细胞长至对数生长期备用。
1.2.2 MTT法检测药物对肿瘤细胞的增殖抑制作用取对数生长期细胞,消化计数后按3000~5000个/孔接种于96孔细胞培养板中,置5% CO2培养箱培养24 h后用不同浓度的药物处理细胞48 h或72 h,每组至少3个平行孔,MTT用PBS缓冲液配成2 mg/ml溶液,每孔加20 μl,37℃温箱中温育4 h。吸出上清液,加入150 μl DMSO,振荡15 min,使结晶物充分溶解。用酶标仪在570 nm处测定每个孔的光密度(OD)。
细胞存活率(%)=OD药物组/OD对照组×100%
各测试孔的OD值减去本底(完全培养基加MTT,无细胞)OD值,3个平行孔OD值取平均数。以存活率为50%的药物浓度为IC50。
1.2.3 克隆形成法检测药物对肿瘤细胞的增殖抑制作用取对数生长期细胞,消化计数后按5000个/10 ml的浓度接种于96孔细胞培养板中,每孔50个细胞/100 μl,每组设3个平行孔。置5%CO2培养箱培养24 h后用不同浓度的药物处理细胞,加药后放培养箱中培养7 d,计数含50个细胞以上的集落,显微镜下计细胞集落数,并计算药物单独作用的IC50。联合用药给药方式为先加EGCG 50 μl/孔,6 h后加其他药物50 μl/孔。
1.2.4 Annexin V-FITC双染法检测细胞凋亡将细胞接种于6孔培养板中,10万~20万个/孔(2 ml),培养24 h后,加入不同浓度的药物,并设空白对照,每组设3个平行孔。作用48 h后,吸出旧培养液,用PBS冲洗细胞1次,胰酶消化,用旧培养液中和胰酶,收集细胞液稍混匀,转移到离心管内,1000×g离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数,取5万~10万个重悬细胞,1000×g离心5 min,弃上清,加入195 μl Annexin V-FITC结合液轻轻重悬细胞。加入5 μlAnnexin V-FITC,轻轻混匀。室温避光孵育10 min。1000×g离心5 min,弃上清,加入190 μl Annexin V-FITC结合液轻轻重悬细胞。加入10 μl碘化丙啶(PI)染色,轻轻混匀,冰浴避光放置。随即进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
1.2.5 小鼠肿瘤模型建立将培养好的人食管癌Eca-109细胞接种于BALB/c裸鼠右腋皮下,接种细胞数为(800~1000)×104个/只。
1.2.6 动物体内疗效观察在BALB/c裸鼠右腋皮下接种人食管癌Eca-109细胞,待肿瘤生长后,剥离瘤体,切成2 mm3大小的肿瘤块,移植入裸鼠右腋皮下。接种后7 d,将动物按体重分层,并随机分组,每组6只,共6个实验组:对照组、EGCG单药150 mg/kg、EGCG单药100 mg/kg、Cet 20 mg/kg、EGCG单药150 mg/kg与Cet 20 mg/kg联合、EGCG单药100 mg/kg与Cet 20 mg/kg联合。EGCG口服给药每周5次,连给3周,共15次。Cet腹腔注射每周2次,连给3周,共6次。定期测量动物体重及瘤块的长径和短径。一周测量2~3次,按以下公式计算肿瘤体积:
V=a(长径)×b(短径)×1/2
第30天处死动物,取瘤块称重,计算抑瘤率及动物体重变化。
1.2.7 两药相互作用指数两药相互作用指数CDI,CDI=AB/(A×B)。AB为两药联合作用组的细胞抑制率,A、B是药物单独作用组的细胞抑制率。当CDI<1时药物作用为协同;当CDI<0.7时药物作用为协同显著;当CDI=1时药物作用性质为相加,CDI>1,表示两药无相加或协同作用。
1.2.8 免疫组化法研究CD31在肿瘤组织的表达将肿瘤组织制备成石蜡切片,脱蜡后侵入0.01 mmol/L枸橼酸缓冲液中进行抗原修复,PBS冲洗2 min×2次,3%双氧水室温孵育10 min,以阻断内源性过氧化物酶,PBS冲洗2 min×3次,滴加一抗4℃过夜,PBS冲洗2 min×3次,滴加聚合物辅助剂,37℃孵育10~20 min,PBS冲洗2 min×3次。滴加二抗,37℃孵育10~20 min,PBS冲洗2 min×3次。DAB染色:1 ml DAB底物缓冲液中加1滴DAB浓缩液,混匀。组织切片上滴加DAB显色液,上色后立即自来水冲洗,终止染色。苏木素复染5 min,用水冲洗,氨水、酸乙醇反蓝,脱水后中性树脂封片。光镜下观察。
1.3 统计学处理
2 结果
2.1 EGCG对Eca-109细胞的增殖抑制作用
采用MTT法检测了EGCG对Eca-109细胞增殖的影响,结果表明,EGCG能够剂量依赖性地抑制Eca-109的增殖,40 μmol/L时显示出明显疗效,与对照组相比存在统计学差异(P<0.001)。EGCG在本实验条件下的IC50值为43.22 μmol/L(图1)。
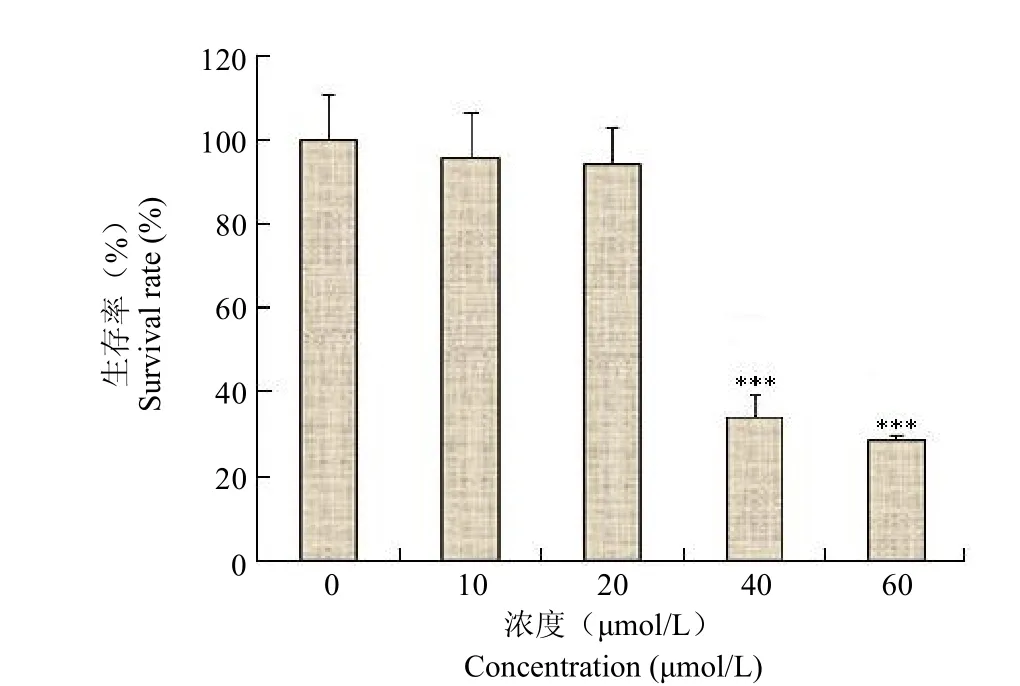
图1 EGCG对Eca-109细胞增殖的影响(***P<0.001)Figure 1Effect of EGCG on the proliferation of Eca-109 cells(***P<0.001)
2.2 EGCG对Eca-109细胞克隆形成的影响
克隆法是体外检测化合物是否具有抑瘤作用的一个有效方法。表1结果表明,EGCG能够抑制Eca-109细胞的克隆形成,具有浓度依赖性,10 μmol/L EGCG的克隆形成抑制率为72.22%,与对照比较具有显著差异(P<0.001)。EGCG对Eca-109细胞克隆形成的IC50值为28.49 μmol/L。
2.3 EGCG对Eca-109细胞凋亡的影响
细胞凋亡是化合物或药物抑制细胞增殖的一个途径,本文采用Annexin V-FITC双染法经流式细胞术检测细胞凋亡。结果表明,EGCG处理细胞48 h能够剂量依赖性地诱导Eca-109细胞凋亡,60和80 μmol/L EGCG都能显著诱导细胞凋亡,凋亡百分率分别为(21.70±0.62)%、(57.13± 9.09)%,其凋亡百分率和对照比较均存在统计学差异(P<0.001)(图2)。

表1 EGCG对Eca-109细胞的克隆形成的影响Table 1Effect of EGCG on colony formation of Eca-109 cells
2.4 EGCG与Cet联用对Eca-109细胞增殖的影响
本研究采用MTT法检测了EGCG与Cet联用对Eca-109细胞增殖的影响。实验中采用的药物作用浓度分别为10 μmol/L EGCG、1 μg/ml Cet。实验采用两种加药顺序,先加EGCG 2 h,再加Cet(图3A);或者先加Cet 2 h,再加EGCG(图3B),两种顺序均两药共同作用72 h。图3A表明,Cet能够显著抑制Eca-109细胞增殖,与对照相比具有统计学意义(P<0.05),两药联用,作用明显增强,此种情况下CDI值为1.05。图3B也表明,两药联用作用明显增强,CDI值为1.11。从以上CDI值均大于1可以看出,两药联用没有相加或协同作用,但存在增强作用。
2.5 EGCG与西妥昔单抗联用对Eca-109裸鼠移植瘤的影响
动物实验是评价药物或化合物抑制肿瘤生长是否有效的金标准,因此本实验中采用食管癌裸鼠移植瘤实验观察了两药联合应用的情况。本实验中,Cet采用20 mg/kg。图4结果表明,在本实验剂量条件下,Cet、EGCG和两者联用对动物体重均没有明显的影响,联用情况下,动物体重也是逐渐增加的,因此说明此剂量条件下无论是单药还是联用均对动物没有明显毒性。图5是肿瘤的生长曲线,从中可以看出,单用EGCG能够剂量依赖性地抑制肿瘤的生长,Cet对Eca-109移植瘤的生长也具有生长抑制作用,两者联用作用明显增强。从剥离瘤块后称重结果可以看出,各剂量组均能显著抑制肿瘤的生长(P<0.05),且两药联用的CDI值在1~1.06之间,接近1,因此具有一定的相加作用。

图2 EGCG对Eca-109细胞凋亡的影响(***P<0.001)(A~D为凋亡的散点图;A:0 μmol/L;B:40 μmol/L;C:60 μmol/L;D:80 μmol/L;E:三次实验的平均结果图)Figure 2Effect of EGCG on the apoptotic rate of Eca-109 cells(***P<0.001)(A-D was a scatter plot of apoptosis;A:0 μmol/L;B:40 μmol/L;C:60 μmol/L;D:80 μmol/L;E:Average result of triple)

图3 EGCG与Cet联用对Eca-109细胞增殖的影响(*P<0.05,***P<0.001)(A:EGCG预处理2 h,两药共同作用72 h;B:Cet预处理2 h,两药共同作用72 h)Figure 3Effect of the combination of EGCG and Cet on the proliferation of Eca-109 cells(*P<0.05,***P<0.001)(A:The cells were pretreated with EGCG for 2 h,followed by exposure to both drugs for 72 h;B:The cells were pretreated with Cet for 2 h,followed by exposure to both drugs for 72 h)
2.6 EGCG与Cet联用对肿瘤组织中血管形成的影响
处理动物,肿瘤组织进行石蜡切片包埋并进行免疫组化实验。实验中采用CD31抗体作为一抗,研究化合物对血管形成的影响。图6结果表明,Cet作用后,瘤块中的新生血管明显减少,EGCG作用后新生血管较对照组有所减少,但不如Cet组明显,两者联用后,新生血管明显减少。

图4 EGCG与Cet联用对携带移植瘤裸鼠体重的影响Figure 4Effect of the combination of EGCG and Cet on the body weight of nude mice with tumor xenografts of Eca-109 cells

图5 EGCG与Cet联用对Eca-109裸鼠移植瘤的生长抑制作用Figure 5Combination of EGCG and Cet inhibited the growth of tumor xenografts of Eca-109 cells in nude mice

图6 EGCG和Cet联用对血管形成的影响[A:对照;B:EGCG(150 mg/kg);C:Cet(20 mg/kg);D:EGCG(150 mg/kg)+Cet(20 mg/kg);图中箭头表示新生血管(×200)]Figure 6Effect of the combination of EGCG and Cet on the angiogenesis[A:Control;B:EGCG(150 mg/kg);C:Cet(20 mg/kg);D:EGCG(150 mg/kg)+Cet(20 mg/kg);The direction of the arrow showed the neovascularization(×200)]
3 讨论
众所周知,茶叶具有一定的防癌功能。EGCG是茶叶具有生物学活性的主要成分,兼具一定的抗肿瘤作用。EGCG能够抑制肝癌细胞生长,诱导肝癌细胞凋亡,引起肝癌细胞周期阻滞,这些与EGCG抑制Akt信号通路相关[8]。因此,我们研究了EGCG对Eca-109细胞增殖和克隆形成的影响,同时观察了EGCG的凋亡诱导作用。本研究结果表明,EGCG能够剂量依赖性地抑制食管癌细胞Eca-109的增殖,在体外具有显著的抑制肿瘤细胞生长和克隆形成的作用,同时,其还具有诱导肿瘤细胞凋亡的功能,凋亡也是化合物或药物引起肿瘤细胞死亡的机制之一。但是,EGCG对食管癌细胞作用的分子机制还有待进一步研究。
肿瘤靶向治疗是近年来肿瘤研究的热点,由于EGFR在肿瘤中高表达,它已经成为肿瘤治疗的靶点[9]。肿瘤化疗一般以联合治疗为主,靶向药物也需要与传统的化疗药物联用来达到治疗肿瘤的最大效能。Cet主要通过拮抗EGFR信号通路发挥抗肿瘤作用,与之相联用的化疗方案正在进行不同肿瘤的临床试验[10-11]。本研究将EGCG与Cet联用,结果表明,在体外,两者联用对Eca-109的细胞增殖具有一定的增强作用。体内试验表明,EGCG和Cet单独应用也能明显抑制携带Eca-109裸鼠移植瘤的生长,两者联用能够显著抑制移植瘤的生长,强于单独用药组。
CD31为内皮细胞分子标记[12],EGCG和Cet都具有血管形成抑制作用,因此该研究也进行了CD31表达的免疫组化分析。结果表明,Cet能够明显抑制肿瘤组织中的血管形成,EGCG具有较Cet弱的血管形成抑制作用,两者联用后血管形成抑制作用明显增强。EGCG与Cet联用产生明显抗肿瘤作用的机制可能与它们抑制肿瘤血管形成相关。本研究为EGCG的抗肿瘤作用提供一些实验依据,为茶多酚开发成药提供了一些思路。
[1]Chen Y,Yu C,Li Y.Physical activity and risks of esophageal and gastric cancers:a meta-analysis.PLoS One,2014,9(2):e88082.
[2]Yang EJ,Lee J,Lee SY,et al.EGCG attenuates autoimmune arthritis by inhibition of STAT3 and HIF-1α with Th17/Treg control.PLoS One,2014,9(2):e86062.
[3]Chen SJ,Zhen YS.Molecular targets of tea polyphenols and its roles of anticancer drugs in experimental therapy.Acta Pharm Sinica,2013,48(1):1-7.(in Chinese)
陈淑珍,甄永苏.茶多酚的分子作用靶点及其在抗肿瘤药物实验治疗中的作用.药学学报,2013,48(1):1-7.
[4]Park S,Kim JH,Hwang YI,et al.Schedule-dependent effect of epigallocatechin-3-gallate(EGCG)with paclitaxel on H460 cells. Tuberc Respir Dis(Seoul),2014,76(3):114-119.
[5]SakamotoY,TerashitaN,MuraguchiT,etal.Effectsof epigallocatechin-3-gallate(EGCG)on A549 lung cancer tumor growth and angiogenesis.Biosci Biotechnol Biochem,2013,77(9):1799-1803.
[6]Sotelo Lezama MJ,Sastre Valera J,Díaz-Rubio García E.Impact of cetuximab in current treatment of metastatic colorectal cancer.Expert Opin Biol Ther,2014,14(3):387-399.
[7]Shao RG,Zhen YS.Clinical application of cefuxionab and other anti-EGFR antibody drugs.Beijing:People's medical publishing House,2013:668-698.(in Chinese)邵荣光,甄永苏.抗体药物研究与应用.北京:人民卫生出版社,2013:668-698.
[8]Shen X,Zhang Y,Feng Y,et al.Epigallocatechin-3-gallate inhibits cell growth,induces apoptosis and causes S phase arrest in hepatocellular carcinoma by suppressing the AKT pathway.Int J Oncol,2014,44(3):791-796.
[9]Björkelund H,Gedda L,Malmqvist M,et al.Resolving the EGF-EGFR interaction characteristics through a multiple-temperature,multiple-inhibitor,real-time interaction analysis approach.Mol Clin Oncol,2013,1(2):343-352.
[10]Pircher A,Manzl C,Fiegl M,et al.Overcoming resistance to first generationEGFRTKIswithcetuximabincombinationwith chemotherapy in an EGFR mutated advanced stage NSCLC patient. Lung Cancer,2014,83(3):408-410.
[11]De Cesare M,Lauricella C,Veronese SM,et al.Synergistic antitumor activity of cetuximab and namitecan in human squamous cell carcinomamodelsreliesoncooperativeinhibitionofEGFR expression and depends on high EGFR gene copy number.Clin Cancer Res,2014,20(4):995-1006.
[12]Ghanekar A,Ahmed S,Chen K,et al.Endothelial cells do not arise from tumor-initiating cells in human hepatocellular carcinoma.BMC Cancer,2013,13:485.
MethodsMTT assay and colony formation assay were used to detect the effect of cell proliferation.Cellular apoptosis was examined using flow cytometry.Animal experiments were performed to evaluate the reduced growth of tumor xenograft in nude mice administrated by EGCG and cetuximab.Immunohistochemical technique was applied to examine the expression of endothelial cells in tumor tissue.
ResultsEGCG inhibited the proliferation of Eca-109 cells in a dose-dependent manner and the IC50value was 43.22 μmol/L.The results from colony formation assay showed that EGCG dose-dependently decreased the number of colony formation at the IC50value of 28.49 μmol/L.EGCG also induced apoptosis of Eca-109 cells and the percentage of apoptosis was(21.70±0.62)%and(57.13±9.09)%at the concentration of 60 and 80 μmol/L,respectively.The inhibitory effect of the combination of EGCG and cetuximab on the proliferation was more potent than that of either single treatment with EGCG or cetuximab,indicating an additive effect for the combination treatment.At the same time,the combination reduced the growth of tumor xenografts in nude mice more potently than EGCG or cetuximab alone.Moreover,expression level of CD31 in the tumor tissue from xenografts in the combination group was decreased more significantly than that of single EGCG or cetuximab treatment.
ConclusionEGCG inhibits the proliferation and colony formation,and induces significantly apoptosis in human esophageal cancer cell line Eca-109.An additive effect was observed for the combination of EGCG and cetuximab treatment on the growth of Eca-109 cells in vitro and in vivo.
Antitumor effect of the combination of EGCG and cetuximab on the human esophageal cancer cell line Eca-109 in vitro and in vivo
SHANG Yue,LIU Xu-jie,CHEN Shu-zhen
ObjectiveTo explore the antitumor effect of the combination of EGCG and cetuximab on human esophageal cancer cell line Eca-109 in vitro and in vivo.
Catechols;Drug screening assays,antitumor;Esophageal neoplasms;Cetuximab
CHEN Shu-zhen,Email:bjcsz@imb.pumc.edu.cn
10.3969/cmba.j.issn.1673-713X.2015.01.005
国家自然科学基金(81373437);“重大新药创制”国家科技重大专项(2012ZX09301-002-001-022)
100050北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室
陈淑珍,Email:bjcsz@imb.pumc.edu.cn
2014-04-29
www.cmbp.net.cn中国医药生物技术,2015,10(1):18-24
AuthorAffiliation:Department of Oncology,Institute of Medicinal Biotechnoloty,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100050,China
www.cmbp.net.cn Chin Med Biotechnol,2015,10(1):18-24
