复配逆胶束体系中漆酶催化性能研究
2015-11-23马玉杰袁兴中吴秀莲曾光明湖南大学环境科学与工程学院湖南长沙410082湖南大学环境生物与控制教育部重点实验室湖南长沙410082
马玉杰,袁兴中*,彭 馨,刘 欢,包 姗,吴秀莲,曾光明(1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
复配逆胶束体系中漆酶催化性能研究
马玉杰1,2,袁兴中1,2*,彭 馨1,2,刘 欢1,2,包 姗1,2,吴秀莲1,2,曾光明1,2(1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
在由鼠李糖脂和Tween-80构建而成的复配逆胶束媒介研究了漆酶的催化性能.采用紫外法考察了Tween-80摩尔含量、逆胶束含水量、水相酸碱度、水相盐度以及助表面活性剂种类等反应条件对漆酶催化性能的影响.研究结果表明,反应的最佳条件:Tween-80的摩尔含量为30%,体系含水量为20,缓冲溶液pH为4.5,KCI浓度为70mmol/L,助表面活性剂正己醇.并且在最佳条件下,漆酶在复配逆胶束体系中的酶活比在单相鼠李糖脂逆胶束中高1.44倍,比在水溶液中高4.35倍,研究结果表明复配表面活性剂在构建胶束酶学上具有很大的潜力.
复配逆胶束;鼠李糖脂;Tween-80;漆酶;催化性能
同传统化学表面活性剂相比,鼠李糖脂作为一种环境友好型的天然表面活性剂,产生于微生物动物或植物的代谢过程中,具有低毒性、可生物降解性、生态相容性以及一定的胶团催化能力等优点[15-16],其对于推进逆胶束酶体系的应用意义重大.阴离子表面活性剂——鼠李糖脂,与酶具有强烈的静电和疏水作用,导致其在逆胶束中的活性和稳定性降低[17-18].为解决这一难题,通常是加入非离子表面活性剂,减弱逆胶束体系的静电作用与疏水性,从而减弱酶与表面活性剂的相互作用[5,13].非离子表面活性剂Tween-80具有低毒、易生物降解、与离子型表面活性剂具较好协同性等特点.然而,目前向鼠李糖脂逆胶束体系中加入非离子表面活性剂Twenn-80以形成复配逆胶束体系来提高酶的催化性能的研究至今仍未见报道.
本文选择鼠李糖脂和Tween-80进行复配,以异辛烷为连续相,短链醇为助表面活性剂,与水构成复配逆胶束体系.本实验采用单因素法分别考察了非离子表面活性剂的摩尔含量、pH值、W0、离子浓度、助表面活性剂种类等重要因素对漆酶催化活性的影响,以确定鼠李糖脂/ Tween-80复配逆胶束体系的最佳状态为其推广到工业应用奠定实验基础.此研究拓展了酶反应的媒介,这对于构建适合于胶束酶学研究的逆胶束体系言有突出的实际意义.
1 材料与方法
1.1 材料与试剂
ABTS(Sigam公司);鼠李糖脂(湖州紫金生物科技有限公司);Tween-80(天津市化学试剂三厂);漆酶(Sigam公司);异辛烷、正己醇、正丁醇、正戊醇、正辛醇、正庚醇、柠檬酸、柠檬酸钠、无水乙醇和KCl等试剂均为市售分析纯.超纯水本实验室自制.
紫外分光光度计(Shimadzu UV-2552, Japan);超声波清洗仪;pH计(PHS-2F,上海雷磁仪器厂);磁力搅拌器.
1.2 实验方法
1.2.1 复配逆胶束体系的制备 有机溶剂能够影响到逆胶束水核中酶的活性和稳定性,有研究证明相对于己烷和辛烷等有机溶剂,异辛烷对逆胶束中酶的性质影响最小,酶在异辛烷体系中的活性最高[19].以鼠李糖脂和Tween-80为表面活性剂,异辛烷为油相,短链醇为助表面活性剂,100mmol/L的一定pH值和KCI浓度的柠檬酸—柠檬酸钠缓冲溶液作为水相,配制复配逆胶束.逆胶束的含水量以W0(无量纲,其大小等于水的摩尔数与总表面活性剂摩尔数之比)来表示.
1.2.2 漆酶酶活测定 取10μL 0.5mg/mlABTS加入不同参数的逆胶束溶液中,用分光光度计(Shimadzu UV-2550,Japan)测420nm处吸光度的变化,绘制酶活随非离子表面活性剂的摩尔分数、W0、pH值、离子强度以及助表面活性剂的种类变化的图形.每个实验3个平行,取平均值,实验温度(29±1)℃.定义1个酶活力单位(U)为1umol的ABTS每min被转化所需的酶量.
无锡禅意小镇·拈花湾位于无锡马山太湖国际旅游度假岛,距离无锡市区三十余公里。拈花湾面湖依山,风景秀美,其命名源于佛教中“拈花微笑”的典故。作为灵山集团重点打造的五期工程,小镇投资将近50亿元,规划建筑面积达到约35万平方米。拈花湾通过对禅文化的创造性运用,打造成为“具有东方文化内涵的心灵度假目的地”。自2015年11月14日开园以来,已吸引了众多的游客前来感受禅意生活。根据统计,2017年拈花湾的客流量为174.1万人次。
1.2.3 相对酶活计算 以缓冲溶液中漆酶活性为对照,对照组的酶活设为100%.相对酶活=(不同参数组的酶活性/对照组酶活性)X100%.
2 结果与讨论
2.1 Tween-80对漆酶活性的影响
研究表明,在逆胶束体系中加入适量的非离子表面活性剂有利于提高酶的催化活性[14,20-21].非离子表面活性剂的加入增大了界面膜面积,降低了界面电荷密度和界面膜的刚性,促进底物与酶的活性位点接触,从而提高酶的催化性能[14].保持表面活性剂总浓度为0.05mol/L,考察Tween-80的摩尔分数[x(Tween-80)]对酶活性的影响,如图1所示.
从图1可以看出,酶活性随x(Tween-80)的增大,先增大后减小.在x(Tween-80)为0%时,体系为单相鼠李糖脂逆胶束系统,漆酶的最大酶活为1.69U;在x(Tween-80)>0%时,体系为复配逆胶束系统,漆酶的最大活性为4.13U,后者比前者高出1.44倍.在x(Tween-80)为30%时,活性达到最大,相对酶活为5.35,酶活性比在水溶液中提高了4.35倍.这一方面是由于Tween-80吸附在胶束界面上,减小了界面上的电荷密度及逆胶束的疏水性,减弱了酶分子与鼠李糖脂分子极性头的静电作用以及酶分子与逆胶束之间的疏水作用对酶活性产生的不利影响;另一方面Tween-80分子中的聚氧乙烯链可以与酶分子以氢键相结合[13],从而减弱酶分子与鼠李糖脂分子的相互作用.因此,在一定范围内随着x(Tween-80)的增加,逆胶束的表面电荷的逐渐降低有利于酶的吸附,从而有利于底物与酶结合,所以酶活逐渐增大.然而Tween-80具有乳化作用,用量过大时会出现乳化现象,使逆胶束的结构发生变化,酶在逆胶束中的溶解能力降低,酶活性也随之降低.选用x(Tween-80)=30%进行后续实验.
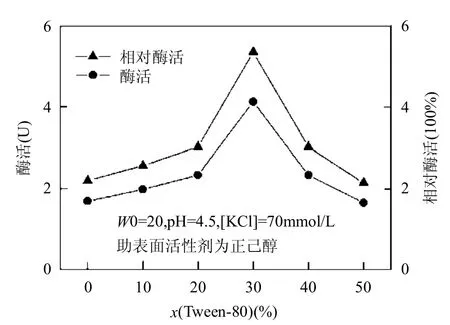
图1 Tween-80的摩尔分数对复配逆胶束体系中漆酶催化性能的影响Fig.1 Effect of x(Tween-80) on activity of laccase in the mixed reversed micelles system
2.2 W0对漆酶活性的影响
W0是影响逆胶束中酶活性的一个重要参数,其大小决定了逆胶束中心水核(表面活性剂分子疏水的非极性尾部指向有机溶剂,亲水的极性头部聚集形成的纳米级中心水核[22])尺寸的大小,从而影响酶的催化活力.研究表明,酶的催化反应是在环绕着酶分子表面的水层内进行的,只有与酶蛋白紧密结合的一层水分子对酶的催化活力才是重要的[23].在W0为10~30范围内研究了其对酶活性的影响,其结果如图2所示.
研究结果表明,当W0较小时(<15),逆胶束中心水核尺寸较小,酶分子的构象受到逆胶束微粒的限制,结构运动的自由度相对较小,酶的构象变化受到限制,使酶不易转化为催化构象,酶的活力较低[24].同时在W0较小的情况下,酶分子不能完全溶于逆胶束中心水核中,过多的酶分子暴露于有机溶液中,会降低酶的活性和稳定性.当 15≤W0≤20时,酶的活性随W0的增加变化较缓慢并且保持良好催化性能.这是由于随着W0的增加,逆胶束中心水核尺寸增大,不仅有利于酶的催化构象的转变,而且有利于酶分子被水和表面活性剂分子包裹,避免直接暴露于有机溶剂而失活酶[5].当W0大于20时,随着W0的增大酶的活性逐渐减小,这一方面是由于胶束内部水含量增加,会引起酶流动性的增大,从而导致酶催化构象的破坏,另一方面是由于当W0继续增大时,逆胶束中心水核中水的活增大,将影响酶的活性[13].与酶活相比,相对酶活的变化趋势比较明显,在W0=20时,相对酶活达到最大.综合考虑酶活和相对酶活,在后续实验中均采用W0=20.

图2 含水量W0对复配逆胶束中漆酶催化性能的影响Fig.2 Effect of W0 on the catalytic performance of laccase in mixed reversed micelles system
2.3 pH值对漆酶活性的影响
在逆胶束体系中酶分子所处微环境的pH值决定了其所带电荷的种类.因此,pH值不仅影响酶分子在逆胶束体系中的溶解度和催化构象,而且也有可能改变酶分子与逆胶束表面活性剂层之间的相互作用[25].逆胶束微水相过高或过低的pH值条件都会引起酶活性的丧失,酶分子活性中心周围的离子基团只有在特定的酸碱度下才具有酶催化反应的最佳离子态.考察逆胶束水相pH值的改变对漆酶催化性能的影响,其结果如图3所示.
当pH<4.5时,随着pH值的增加,表面活性剂与酶分子之间的静电作用逐渐减小,酶的溶解度以及活性逐渐增强;当逆胶束内表面电荷即表面活性剂极性基团所带的电荷与酶分子的等电点最接近时,二者产生静电引力最小,酶的活性最大,此时pH=4.5;当pH值继续增加时,表面活性剂与酶分子之间的静电作用又有所增加,酶活性随之降低.这与文献[26]报道相一致漆酶在逆胶束中的最佳pH值在4.2~4.5,非离子型表面活性剂对最佳pH值影响不大,而主要取决于酶本身的性质.
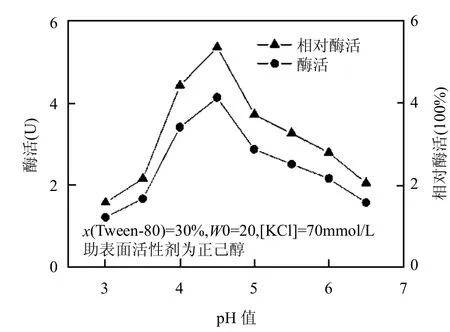
图3 pH值对复配逆胶束中漆酶催化性能的影响Fig.3 Effect of pH on the catalytic performance of laccase in mixed reversed micelles system
2.4 KCl对漆酶活性的影响
反应体系中缓冲液的离子强度影响酶的空间结构,从而影响其催化能力.逆胶束中心水核盐浓度主要通过改变逆胶束结构和酶的空间结构两种方式来影响逆胶束中酶的催化性能,水相中的盐离子能影响表面活性剂分子极性头部间的静电作用,从而引起逆胶束聚集体大小和数目的改变[27].研究盐浓度对复配逆胶束中漆酶催化性能的作用,如图4所示.从图4可以看出,当盐浓度较低时,酶活性开始随离子强度增加而增加,最佳活性时离子强度为70mmol/L.适当增加盐浓度能缩小逆胶束中心水核的体积,增加逆胶束结构的刚性,有利于溶解在其中的酶保持其催化活性[27].随后酶的活性下降,在高离子强度下,蛋白质由于变性而使酶活性大为降低,所以活性降低.彭子原等[28]的研究结果,KCl为10mmol/L时,漆酶在鼠李糖脂逆胶束体系中的活性达到最大,与本实验相比,非离子表面活性剂的加入明显提高了酶在逆胶束体系的耐盐度.
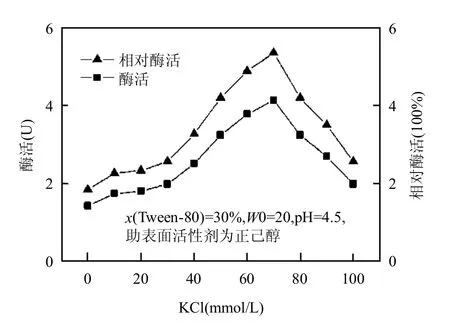
图4 KCI浓度对复配逆胶束中漆酶催化性能的影响Fig.4 Effect of KCl concentration on the catalytic performance of laccase in mixed reversed micelles system
2.5 不同醇种类对酶活性的影响
中短碳链的醇作为助表面活性剂,与表面活性剂分子共同组成界面层,使界面层上表面活性剂的数目减少,能调节表面活性剂的HLB值,增强体系的增溶能力,进而改变酶在逆胶束体系中的催化性能[26].除此之外,还可以改变表面活性剂的亲水基之间的作用,松散表面活性剂分子的排列[29],使酶分子更容易进入逆胶束水核.采用正丁醇、正己醇、正庚醇、正辛醇及正戊醇等5种正构醇作为助表面活性剂,分别加入有机相异辛烷中,探究助表面活性剂种类对漆酶催化性能的影响,其结果如图5所示.
助表面活性剂能够增加表面活性剂的溶解性,同时能够促进表面活性剂极性端的结合,形成逆胶束[30].Jolivalt等[29]研究表明,增加助表面活性剂的碳链长度会导致表面活性剂分子头部集团之间的屏蔽作用降低,使得逆胶束体积变大,为酶催化反应提高足够的空间,提高酶的活性.正如本实验中正丁醇、正戊醇、正己醇作助表面活性剂时,醇的碳链增长,酶的活性依次增强.张文娟等[31]认为由于表面活性剂电荷性质、头基大小及醇在聚集体结构中的定位等原因,醇对酶有激活作用,并且这种激活作用随碳链长度的增加逐渐减小.由此,正庚醇和正辛醇对酶的激活作用弱于正己醇、正戊醇和正丁醇.上述原因的共同作用,从图5看出,正己醇最适合作助表面活性剂.
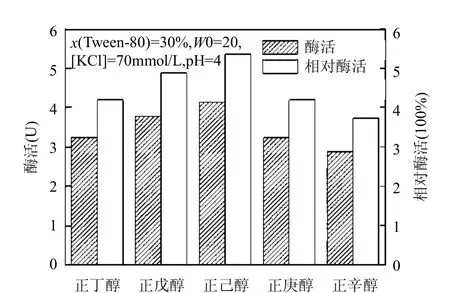
图5 助表面活性剂种类对复配逆胶束中漆酶催化性能的影响Fig.5 Effect of cosurfactant types on the catalytic performance of laccase in mixed reversed micelles system
3 结论
3.1 在最佳条件下鼠李糖脂/Tween-80复配逆胶束体系中漆酶的活性比在单相鼠李糖脂逆胶束中高出1.44倍,比在水溶液中高出4.35倍,漆酶在复配逆胶束体系中表现出了超活性,表面活性剂复配在胶束酶学中有巨大的潜力.
3.2 漆酶在复配逆胶束体系中表现出优良的催化性能,其活性受到非离子表面活性剂的摩尔含量、含水量W0、水相酸碱度、水相盐浓度、助表面活性剂等条件的影响.当总体表面活性剂浓度为0.05mol/L,反应的最佳条件:x(Tween-80)= 30%,含水量W0=20,水相pH值4.5,水相KCl浓度70mmol/L,助表面活性剂正己醇.
[1]Potapov A V, Alekseev D B, Alekseeva I G, et al. Investigation of cluster formation in reversed micelles systems by the method of correlation spectroscopy of scattered light [J]. Laser Phys. Lett.,2007,4(1):61-65.
[2]方振敏,袁兴中,曾光明,等.正反胶束体系中木素过氧化物催化氧化藜芦醇条件优化 [J]. 中国环境科学, 2013,33(4):734-740.
[3]彭 馨,袁兴中,黄华军,等.漆酶的逆胶束萃取条件优化的研究[J]. 中国环境科学, 2013,33(5):904-909.
[4]刘 薇,袁兴中,曾光明,等.不同反胶束体系萃取纤维素酶的条件优化对比研究 [J]. 中国环境科学, 2013,33(4):728-733.
[5]杨淑娟,孔长青,张 可,等.丁二酸二异辛酯磺酸钠(AOT)/Triton X-100混合反胶束体系中纤维素酶降解纤维素的研究 [J]. 化学学报, 2010,68(9):839-844.
[6]Liu D J, Ma J M, Cheng H M, et al. Solubilization behavior of mixed reverse micelles: effect of surfactant component,electrolyte concentration and solvent [J]. Colloids Surf. A, 1998,143:59-68.
[7]Rajib K M, Bidyut K P. Investigation on percolation in conductance of mixed reverse micelles [J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 2005,252:243-259.
[8]Kaushik K, Bidyut K P. Physicochemical investigation of mixed surfactant reverse micelles:Water solubilization and conductometric studies [J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 2013,433:154-165.
[9]Bidyut K P, Rajib K M. Water solubilization capacity of mixed reverse micelles:Effect of surfactant component, the nature of the oil,and electrolyte concentration [J]. Journal of Colloid and Interface Science, 2005,288:261-279.
[10]Kundu K, Guin G, Paul B K. Interfacial composition,thermodynamic properties, and structural parameters of waterin-oil microemulsions stabilized by 1-pentanol and mixed surfactants [J]. Journal of Colloid and Interface Science,2012,385:96-110.
[11]Zhang Y, Huang X, Huang F, et al. Catalytic performance of lignin peroxidase in a novel reversed micelle [J]. Colloids and Surfaces B: Biointerfaces, 2008,65:50-53.
[12]Spernath A, Aserin A. Microemulsions as carriers for drugs and nutraceuticals [J]. Advances in Colloid and Interface Science,2006,128-130:47-64.
[13]张玉霞,赵继华,杜中玉,等.AOT/TritonX-100混合反胶束体系中假丝酵母脂肪酶催化蓖麻油水解的活性 [J]. 物理化学学报,2007,23(9):1483-1486.
[14]Konstantza T, Zdravka L. Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion [J]. Biotechnology Advances, 2008,26:516-532.
[15]Xie Y W, Ye R Q, Liu H L. Synthesis of silver nanoparticles in reverse micelles stabilized by natural biosurfactant [J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 2006,279:175-178.
[16]Mulligan C N. Environmental applicationsfor biosurfactants [J]. Environ. Pollut., 2005,133:183-198.
[17]Carvalho C M L, Melo E P, Costa M B, et al. A steady-state fluorescence study of cutinase microencapsulated in AOT reversed micelles at optimal stability conditions [J]. Biotechnol. Lett, 1999,21:673-681.
[18]Walde P, Han D, Luisi P L. Spectroscopic and kinetic studies of lipases solubilized in reverse micelles [J]. Biochemistry,1993,32(15):4029-4034.
[19]Wang Y D, Gan Q, Shi C Y, et al. Separationtion of phenol from aqueous solutions by polymeric reversed micelle extrsction [J]. Chemical Engineering Journal, 2002,88:95-101.
[20]Lan J, Zhang Y, Huang X, et al. Improvement of the catalytic performance of lignin peroxidase in reversed micelles [J]. Chem Technol Biotechnol, 2008,83:64-70.
[21]Shome A, Roy S, Das P K. Nonionic surfactants: a key to enhance the enzyme activity at cationic reverse micellar interface [J]. Langmuir 2007,23:4130-4136.
[22]梁运姗,袁兴中,曾光明,等.表面活性剂在逆胶束酶反应体系中的作用机制 [J]. 中国科学, 2011,41(5):763-772.
[23]闫爱新,田桂玲,叶蕴华.蛋白酶在有机合成中应用的新进展 [J].化学进展, 2001,13(03):203-208.
[24]Carvalho C M L, Cabral J M S. Reverse micelles as reaction media for lipases [J]. Biochimie, 2000,82:1063-1085.
[25]刘伟东,聂开立,鲁吉珂,等.反胶束体系中脂肪酶催化合成生物柴油 [J]. 生物工程学报, 2008,24(1):142-146.
[26]姬产磊.Irpexlacteus dft-1漆酶在反胶束中的催化性能研究 [J].环境科学技术, 2009,32(12):79-84.
[27]Biasuai M A, Abuin E B, Silber J J, et al. Kinetics of reactions catalyzed by enzymes in solutions of surfactants [J]. Advances in Colloid and Interface Science, 2008,136(1/2):1-24.
[28]彭子原,袁兴中,彭 馨,等.生物表面活性剂逆胶束中漆酶催化性能的研究 [J]. 中国环境科学, 2013,33(6):1091-1096.
[29]Jolivalt C, Minier M, Renon H. Extraction of a-chymotrypsin using reversed micelles [J]. Journal of Colloid Interface Science,1990,135:85-96.
[30]刘 恋,田森林,宁 平.Tween-20胶束溶液对甲苯的增溶吸收作用规律及预测 [J]. 中国环境科学, 2010,30(5):615-624.
[31]张文娟,王 丹,黄锡荣,等.直链醇对反胶束体系中木素过氧化物酶催化活性的影响,化学学报, 2005,63(21):2009-2012.
Catalytic performance of laccase in mixed reversed micelle system.
MA Yu-jie1,2, YUAN Xing-zhong1,2*, PENG Xin1,2,LIU Huan1,2, BAO Shan1,2, WU Xiu-lian1,2, ZENG Guang-ming1,2(1.College of Environmental Science and Engineering,Hunan University, Changsha 410082, China;2.Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, Hunan University, Changsha 410082, China). China Environmental Science, 2015,35(4):1129~1134
A mixed reversed micelle system had been developed to investigate the catalytic performance of laccase. The anionic biosurfactant Rhamnolipid and nonionic surfactant Tween-80 were used to construct the mixed reversed micelle system, while the isooctane and short-chain alcohols (1:1, V/V) were used as oil phase and cosurfactant, respectively. UV spectrum was analysed to find out how the molar fraction Tween-80, water content, pH, ionic strength and cosurfactant stype affected enzyme activity of laccase in the mixed reversed micelle system. And it has been found that while the molar fraction Tween-80 was 30%, water content was 20, pH was 4.5, the concentration of KCl was 70mmol/L, cosurfactant stype was n-hexanol, the optimal condition of mixed reversed micelle system could be reached. In optimum catalytic conditions, the catalytic activity was higher 1.44 times in the mixed reversed micelle than that in the single Rhamnolipid reversed micelle system, and higher 4.35 times than that in water. The research indicated mixed reversed micelle has huge potential in micellar enzymology.
mixed reversed micelle system;Rhamnolipid;Tween-80;laccase;catalytic performance
X703.5
A
1000-6923(2015)04-1129-06
马玉杰(1984-),女,河南周口人,湖南大学环境科学与工程学院硕士研究生,研究方向为废物资源化.
2014-07-18
国家自然科学基金资助项目(50978087)
* 责任作者, 教授, yxz@hnu.edu.cn
