烤烟组培苗与常规苗大田防御酶活性的比较
2015-11-23许冬梅王维陈建军罗福命张金霖凌寿军陈俊黄日伟邓世媛
许冬梅 ,王维,陈建军,罗福命 ,张金霖 ,凌寿军 ,陈俊 ,黄日伟,邓世媛
1 华南农业大学烟草研究室,广东广州,510642;2 广东烟草清远市有限公司,清远,511515;3 广东烟草连州市有限公司,连州,513400
烤烟组培苗与常规苗大田防御酶活性的比较
许冬梅1,王维1,陈建军1,罗福命2,张金霖3,凌寿军2,陈俊3,黄日伟3,邓世媛1
1 华南农业大学烟草研究室,广东广州,510642;2 广东烟草清远市有限公司,清远,511515;3 广东烟草连州市有限公司,连州,513400
为比较烤烟组培苗与常规苗烟苗素质及大田期的抗性差异,以烤烟品种(系)K326、粤烟97、华烟06的组培苗与常规苗为试验材料,测定了苗期农艺性状及根系活力和大田期多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、抗坏血酸过氧化物酶(APX)、β-1,3-葡聚糖酶等防御性酶活性,并调查了田间发病率。结果表明:组培苗在株高、叶数、茎围、根系体积、根系活力、干鲜重等方面均优于常规苗。在整个大田生育期内,不同处理烤烟的防御酶活性基本呈现出上升—下降—上升的变化趋势。旺长期前,组培苗与常规苗之间防御酶活性差异不大,旺长期受到病虫害侵染后,各处理的防御酶活性均先下降然后上升,并在较长一段时间内处于较高水平,且组培苗防御酶活性增加的幅度高于常规苗,其中K326组培苗的PPO、PAL、β-1,3-葡聚糖酶活性分别比常规苗高出29.58%、15.30%、73.03%,华烟06组培苗APX活性高于常规苗58.43%,差异显著。组培苗的花叶病、气候斑病及虫害发生率等均低于常规苗,表现出较强的抗性。
烤烟;防御酶;组培苗;常规苗
传统烟草育苗方式面临着品种单一、品种自然退化、烟苗不均一、易感染病菌等问题[1-2],通过组织培养技术繁殖烟苗,可以保持烟草品种的优良性、减少病虫害的发生,提高烟叶的工业可用性,同时还可以保存优良的种质资源。随着第一家兰花组培苗工厂的建立,目前世界上80%~85%的兰花是通过组织培养脱毒和快繁的,至今全国已建成葡萄、苹果、香蕉、马铃薯、甘蔗、兰花等快繁生产线10余条,年供应试管苗上亿株,其中生产的香蕉试管苗已进入国际市场[3]。虽然在植物组织培养技术发展的早期,烟草作为模式植物为组培技术的发展作出了贡献,但目前组培苗在烟草育苗中却未得到很好的应用,对烟草组培苗生长发育过程中的生理特性也缺乏研究。
烤烟在大田生长期间会发生多种病虫害。当病虫害入侵植物体后,植物体内会发生复杂的生理生化变化,其中之一便是启动自身防御酶系统。多酚氧化酶(Polyphemol oxidase,PPO)与植物抵抗病原菌入侵有密切关系,同时也是防御害虫取食的重要成员[4];苯丙氨酸解氨酶(Phenylalanine ammonialyase,PAL)活性在遭遇寒冷[5]、紫外辐射[6]、昆虫取食[7]后会迅速上升;抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)是植物细胞中防御外界氧化胁迫和植物本身活性氧代谢的重要抗氧化酶类[8];β-1,3-葡聚糖酶(β-1,3-Glucanase)参与了植物对病原菌的防卫反应,抑制真菌的生长增殖,它在植物体内的诱导与积累,对于增强植物的抗病能力有重要作用[9]。组培苗是在无菌的条件下培育出来的,在抗病性方面具有一定的优势,目前关于组培苗抗病性的报道中,草莓[10]、桉树[11]组培苗抗病性优于常规苗,但对烟草组培苗抗病性的研究还未见报道。本试验就是通过比较不同烤烟品种(系)组培苗与常规苗防御酶活性及大田抗病性的差异,研究组培苗田间抗性的表现及其机理,以期为组培苗应用于烤烟大田生产提供理论参考。
1 材料与方法
1.1 试验材料与处理
试验于2013年12月至2014年7月在广东省连州市唐屋村进行。试验地前茬为水稻,土质属紫色砂页岩发育而成的紫色土,土壤pH值为7.5,土壤主要养分含量为有机质1.51%,全氮0.095%,全钾(K2O)2.89%,碱解氮84 mg·kg-1,速效磷(P2O5)6.8 mg·kg-1,速效钾(K2O)110 mg·kg-1。
供试烤烟品种为K326、粤烟97、华烟06(新品系),以各品种(系)组培苗和常规苗(CK)作为试验材料,共6个处理,每处理3次重复、共18个小区,株行距为50 cm×120 cm。组培苗由华南农业大学烟草研究室采用组织培养技术,取无菌苗叶片于适宜培养基上,通过愈伤组织的诱导、芽的分化继代、生根壮苗获得,并在移栽前进行了假植,常规苗在连州星子烟站通过漂浮育苗得到。试验于3月13日移栽,4月8日揭膜,5月11日现蕾打顶,6月7日第一次采摘下部叶。施氮水平为153.7 kg·hm-2,N:P2O5:K2O=1:1.2:2.5,其他大田管理按照连州当地优质烟叶生产规范进行管理。
1.2 测定项目与方法
1.2.1 防御性酶活性
取样时间与方法:移栽前、揭膜后每隔12 d取一次,一直取到上部叶采收,每次均摘取倒四叶位叶片,去叶脉,放预冷研钵中研磨提取粗酶液。
PPO活性测定采用邻苯二酚法,参照朱广廉[12]的方法略有改动,反应体系包括0.2 mol.L-1邻苯二酚1.5 mL,0.05 mol.L-1pH 6.8的磷酸缓冲液1.5 mL。1 g 叶片加少量聚乙烯吡咯烷酮、8 mL pH 6.8磷酸缓冲液冰浴研磨,4 ℃下13000 rpm离心20 min,取上清液50 μL,于398 nm处测2 min内吸光度值的变化,不加酶液的反应为对照,以每分钟A398变化1为1个酶活性单位U。
PAL活性测定参照李靖[13]的方法,反应体系中包括3.8 mL pH 8.8的硼酸缓冲液,1 mL 0.5 mol.L-1L-苯丙氨酸,0.2 mL酶液,40 ℃水浴1小时,于298 nm下测OD值,以每小时△OD变化0.01为1个酶活性单位U。
APX活性测定参照沈文飚[14]的方法,取烟叶0.5 g,加5 mL酶提取液冰浴研磨,4 ℃下10000 rpm离心20 min。在3 mL反应液中加入0.3 mL酶液,加0.05 mL H2O2启动反应。不加H2O2为对照,测定290 nm波长下1 min OD值变化量,忽略H2O2对AsA极小的氧化作用,酶活性单位以每克鲜质量每分钟OD值变化来表示。
β-1,3-葡聚糖酶活性测定参照王旭丽等[15]的方法,取1 g烟叶加入4 mL 0.05 mol.L-1pH 5.0乙酸钠缓冲液,冰浴研磨,4 ℃下14000 rpm离心15 min,反应体系包括0.4 mL 1 mg.mL-1昆布多糖,0.1 mL酶液,2.5 mL DNS液,显色冷却后测定540 nm波长处OD值,以每分钟分解0.1 %昆布多糖产生1 μmol葡萄糖为1个酶活性单位U。
1.2.2 田间发病率
田间发病率调查方法参照GB/T23222—2008进行,从揭膜起每隔12d调查1次。每小区调查65株,共3次重复,主要记录连州烟区烟草生产上容易发生的花叶病、气候斑病及虫害发生率。
1.3 烤烟生育期气象资料
烤烟大田生育期气象数据由http://www.wunderground.com/history/网站下载,见表1。

表1 连州市烤烟大田生育期气象资料(2014年3月-7月)Tab.1 Meteorological data of fl ue-cured tobacco fi eld in the growth phase in Lianzhou(from March to July,2014)
1.4 数据处理
采用excel2010、SPSS18.0等软件进行数据统计分析。
2 结果与分析
2.1 烤烟组培苗与常规苗苗期素质的比较
表2显示了成苗期不同品种(系)烤烟组培苗与常规苗的烟苗素质。三个品种(系)组培苗的根系体积、根系活力、鲜重和干重、茎围均显著高于常规苗。组培苗K326、粤烟97和华烟06根系活力分别比常规苗高10.71%、10.55%、3.33%,干重高出12.50%、17.95%、18.52%,茎围高出52.75%、45.36%、13.12%。
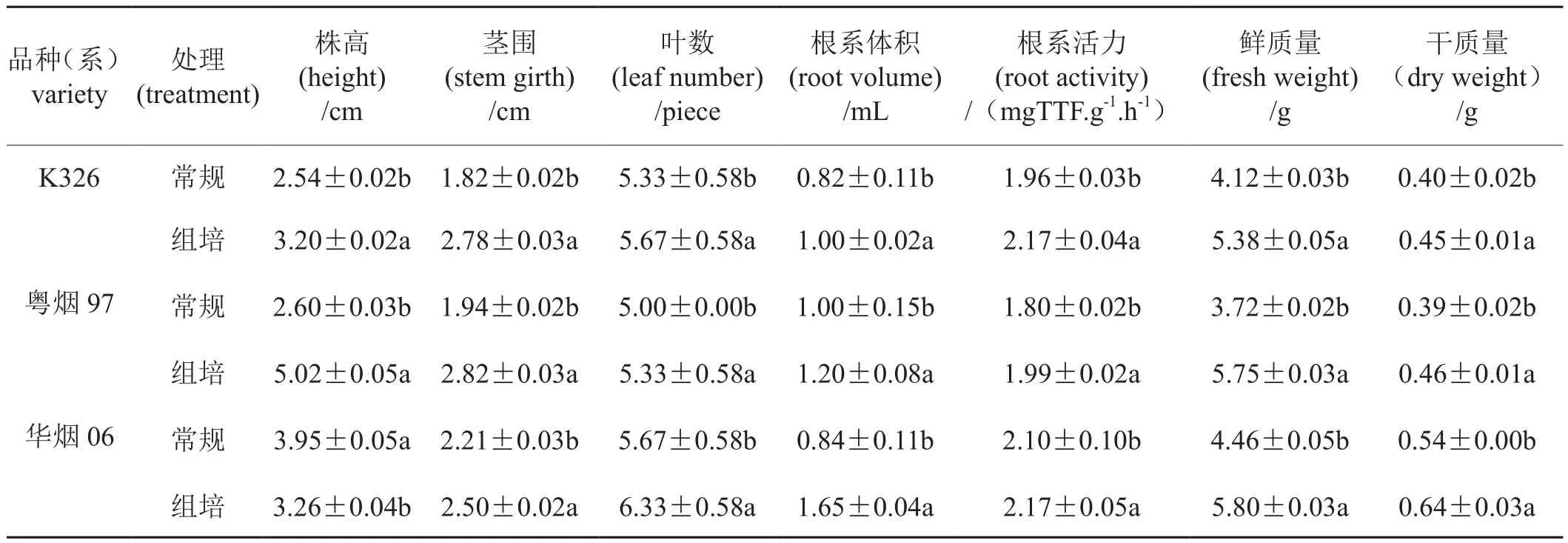
表2 烤烟组培苗与常规苗烟苗素质的比较Tab.2 Comparison of tobacco seedling quality with different seedling methods
2.2 烤烟组培苗与常规苗PPO活性的比较
从图1可以看出,移栽至还苗期间,各处理的PPO活性变化平缓,且组培苗与常规苗之间相差不大。进入旺长期后,组培苗与常规苗PPO含量均呈直线上升,在现蕾打顶期出现第一个峰值,此时华烟06、粤烟97、K326组培苗的PPO活性比常规苗分别高出16.40%、19.28%、29.58%,之后各处理PPO活性均出现小幅下降,到成熟期又上升达到另一个峰值,之后缓慢下降。整个生育进程中,三个品种(系)PPO活性变化趋势基本一致,还苗期粤烟97组培苗的PPO活性略高于华烟06和K326的组培苗,但在团棵期、旺长期和成熟期后两者PPO活性均不同程度的高于粤烟97组培苗。
2.3 烤烟组培苗与常规苗PAL活性的比较
图2显示了不同品种(系)烤烟组培苗与常规苗大田期间PAL活性的变化。从图中可以看出,移栽至成熟,各处理的PAL活性总体呈现升—降—升的变化趋势。旺长期之前,三个品种(系)的常规苗PAL活性均略高于组培苗,进入旺长期后,各品种(系)组培苗的PAL活性增加幅度都大于常规苗,圆顶期PAL活性出现小幅下降,之后一直升高并保持到采收时期,华烟06、粤烟97、K326组培苗的PAL活性分别比常规苗高出19.46%、20.63%、13.85%。从品种间来看,粤烟97组培苗PAL活性在苗期略低于华烟06和K326组培苗,成熟期粤烟97组培苗的PAL活性比K326组培苗低12.19%,有显著性差异。

图1 PPO活性变化Fig.1 Change of PPO activity

图2 PAL活性变化 Fig.2 Change of PAL activity
2.4 烤烟组培苗与常规苗APX活性的比较
图3显示,各处理的APX活性均在移栽后即迅速上升,尤以粤烟97的上升速度最快。团棵之前,各品种(系)组培苗的APX活性均略低于常规苗,进入团棵之后,组培苗的APX活性增加幅度高于常规苗,尤其以华烟06组培苗的APX活性升高幅度最大,与常规苗相差最大达46.89%,粤烟97组培苗的APX活性也有较大幅度的增加,K326组培苗在此期间则变化较小。旺长期后,各品种(系)组培苗与常规苗的APX活性都出现了一个快速下降的过程,但随后又迅速升高,粤烟97和K326在达到第二个峰值后缓慢下降,而华烟06则一直处于上升趋势。现蕾打顶时,华烟06和粤烟97组培苗的APX活性分别比常规苗高出58.42%、37.55%,差异显著,K326组培苗与常规苗APX活性的最大差异出现在采收初期,相差51.13%。从品种间来看,各品种(系)常规苗的APX活性相差不大,但华烟06组培苗的APX活性在团棵后明显高于粤烟97和K326组培苗,在旺长期分别比粤烟97和K326组培苗高出34.29%、41.95%,采收时仍然高出43.93%、20.63%。
2.5 烤烟组培苗与常规苗β-1,3-葡聚糖酶活性的比较
由图4得知,三个品种(系)组培苗与常规苗β-1,3-葡聚糖酶活性在移栽期至团棵期无明显差异,进入旺长期后β-1,3-葡聚糖酶活性迅速上升,其中K326组培苗与常规苗相差73.04%,差异显著,华烟06组培苗也比常规苗高出46.29%,而粤烟97组培苗与常规苗的酶活曲线几乎重合,差异不明显。随后,各品种(系)组培苗与常规苗的β-1,3-葡聚糖酶活性又上升,华烟06和K326的组培苗在圆顶期比常规苗分别高44.29%、73.03%,差异显著。较高水平的酶活性一直保持到落黄成熟期,但后期组培苗与常规苗之间的差异逐渐缩小。从不同品种(系)组培苗的β-1,3-葡聚糖酶活性比较来看,团棵之前以K326较高,旺长期华烟06组培苗低于粤烟97和K326组培苗。

图3 APX活性变化Fig.3 Change of APX activity

图4 β-1,3-葡聚糖酶活性变化Fig.4 Change of β-1,3-glucanase activity
2.6 烤烟组培苗与常规苗发病率的比较
从表3可以看出,在整个大田生育期内,三个烤烟品种(系)组培苗的花叶病、气候斑病及虫害的发生率均低于常规苗。烤烟气候斑病多发于旺长期前,旺长期后发病率不再增加,品种K326表现出较好的抗性,无论是常规苗还是组培苗,发病率均为0;粤烟97的发病率比华烟06高,尤其是常规苗比华烟06高了66.81%;从组培苗与常规苗的比较来看,华烟06和粤烟97的组培苗分别比常规苗低33.41%、57.48%,差异显著。烟草花叶病最早从品种K326开始发生,旺长期时三个品种(系)均有花叶病出现,且发病率上升速度较快,进入现蕾打顶期有所放缓,成熟期时K326、华烟06、粤烟97组培苗的花叶病发病率分别比常规苗低12.31、4.62、6.13个百分点;从品种(系)间来看,组培苗的发病率表现为粤烟97>华烟06>K326,而常规苗则表现为K326>粤烟97>华烟06。虫害发生率高发于旺长期,这可能是由于连州烟区旺长期多为雨后晴朗高温天气、恰逢烟株叶片数量急剧增加,为虫害的发生创造了有利条件,调查结果显示,K326、华烟06、粤烟97组培苗的虫害发生率分别比常规苗低52.73%、51.44%、49.46%,品种(系)间的表现则是K326最小、华烟06其次、粤烟97最高,常规苗也表现出相同的规律。

表3 烤烟大田生育期病虫害发生率Tab.3 Incidence of disease and pests in fl ue-cured tobacco during the fi eld period
3 讨论
烤烟组培苗在移栽前需要进行一段时间假植,即将无菌环境下培育出的组培苗移栽到育苗盘中进行炼苗。草莓[16]研究中发现,假植因移栽引起断根,促发细根和初生根的发生,增加根重、扩大根系,使草莓苗旺苗壮,品质得到大幅度提高。本试验中,成苗期烤烟组培苗的株高、叶片数、根系体积、根系活力及干物质的累积等各烟苗素质指标均优于常规苗。
前人研究表明,还苗期烤烟PPO活性较低,随着生育进程逐渐增强,在旺长期开始上升,成熟期达到峰值之后逐渐下降[17],还有人发现PPO活性在非正常落黄的烟叶中往往较高[18]。本试验中,PPO活性在旺长期到达第一个峰值后出现短暂下降之后又迅速上升,成熟期有所回落,且组培苗高于常规苗。结合田间虫害率发现,旺长期虫害增长率最迅速,由此推测,为了抵抗外界侵害,烟株体内防御酶系统产生生物应激反应,因此PPO活性又被激发上升,这与Constabel等[19]报道的机械损伤能强烈诱导烟草、杨树中PPO活性上升的结果一致,各品种(系)组培苗的PPO活性高于常规苗,因而抗病性更强。
受烟草花叶病毒(TMV)侵染的烟草品种[20-21]和苜蓿花叶病毒侵染的菜豆叶片中[22],PAL活性均显著增强,且PAL活性变化趋势一般均为具有2个酶峰的曲线[23]。本试验中,烟叶感染TMV后,PAL活性增强,且在后期一直维持较高水平,组培苗的PAL活性高于常规苗,因此花叶病发生率显著降低,说明PAL活性增强对烤烟抗病性有一定的促进作用。也有研究发现PAL活性提高率与蚜虫取食诱导有关[24],本试验中,旺长期后三个烤烟品种(系)组培苗的PAL活性均高于常规苗,而虫害发生率的结果显示组培苗均远低于常规苗,这可能是由于PAL参与植保素、木质素、酚类物质的合成,产生的机械障碍、毒害和趋避作用[20],抵抗了害虫的取食,因此降低了组培苗的虫害发生率。
Charles等[25]研究大豆cAPXs观察到,APX的转录、翻译和翻译后调控可能增强农作物抵抗环境胁迫的能力。本试验结果表明,在容易发生病虫害的旺长期,各处理的APX活性均有迅速增加的过程,且组培苗的增加幅度大于常规苗,因此病害发生率明显比常规苗低。高温胁迫下苹果[26]、鸭梨[27]的APX活性会增加,本试验也发现,成熟期烟株内APX活性均上升,这可能与成熟期田间温度较高有关,且组培苗在后期的APX活性也一直高于常规苗,因此更有利于抵抗病虫害。
接种了寄生疫霉的烟草体内β-1,3-葡聚糖酶活性较对照显著升高,并认为真菌激发子的诱导具有激活植物系统抗病性的作用[28]。感染了病原菌后,大豆[29]、甜菜[30]、向日葵[31]、小麦[32-33]体内的β-1,3-葡聚糖酶活性快速升高,且在较长时间内维持着高活性。本试验中,烤烟在旺长期受到病原菌和害虫侵染后,β-1,3-葡聚糖酶活性也迅速上升,尤其是组培苗的升高幅度要大于常规苗,与发病率调查结果结合分析,可以认为β-1,3-葡聚糖酶活性与烤烟的抗病性密切相关。
4 结论
烤烟组培苗经过假植、炼苗后,烟苗素质优于常规苗。大田生长过程中,在高温、高湿、病虫害高发的情况下,组培苗烟株体内的PPO、PAL、APX、β-1,3-葡聚糖酶等酶活性高于常规苗,抗病虫性表现更优,因此,应用于大田生产具有一定的优势,可以作为未来烟草集约化、工厂化育苗方式发展的新方向,尤其是在烟草优良种质资源保存方面可发挥重要作用。
[1]何川生, 王晓云, 雷永和. 烟草快速繁殖及培养的研究[J]. 云南农业大学学报,1998,13(4):392-396.
[2]肖军, 张云霄, 刘伯峰. 烟草的组织培养技术研究[J]. 泰山学院学报,2009,31(6):94-98.
[3]梁称福. 植物组织培养研究进展与应用概况[J]. 经济林研究,2005(04):99-105.
[4]梁军锋, 薛泉宏, 牛小磊, 等. 7株放线菌在辣椒根部定殖及对辣椒叶片PAL与PPO活性的影响[J]. 西北植物学报,2005(10):2118-2123.
[5]Leyva A, Jarillo J A, Salinas J, et al . Low Temperature Induces the Accumulation of Phenylalanine Ammonia-Lyase and Chalcone Synthase mRNAs of Arabidopsis thaliana in a Light-Dependent Manner[J]. Plant Physiology,1995,108(1):39-46.
[6]Bufler G, Bangerth F. UV-induced peroxidase and phenylalanine ammonia lyase activity and phaseolin accumulation in leaves ofPhaseolus vulgarisin relation to ethylene[J]. Plant Science Letters,1982(25):227–237.
[7]Hartley S E, Firn R D. Phenolic biosynthesis, leaf damage,and insect herbivory in birch [J]. Journal of Chemical Ecology,1989,15(1):275-283.
[8]孙云, 江春柳, 赖钟雄, 等. 茶树鲜叶抗坏血酸过氧化物酶活性的变化规律及测定方法[J]. 热带作物学报,2008(05):562-566.
[9]Jesus M, Itzhack P. An endochitinase from wheat germ[J].The journal of biological chemistry,1979,254(11):4901-4907.
[10]张利英, 李贺年, 张鑫, 等. 草莓组培苗和自繁苗田间性状比较试验研究[J]. 安徽农业科学,2009(25):11957-11958.
[11]谭健晖, 蔡玲, 王以红, 等. 不同无性繁殖复壮措施对桉树生长及抗病性比较研究[J]. 广西科学,2007(02):167-171.
[12]朱广廉, 钟文海, 张爱琴. 植物生理学实验[M]. 北京:北京大学出版社,1991.
[13]李靖, 利容千, 袁文静. 黄瓜感染霜酶病菌叶片中一些酶活性的变化[J]. 植物病理学报,1991,21(4):277-282.
[14]沈文飚. 抗坏血酸过氧化物酶活性测定的探讨[J]. 植物生理学通讯,1996,32(3):2053-2058.
[15]王旭丽, 黄丽丽, 康振生, 等. 小麦全蚀病菌胞外β-1,3-葡聚糖酶的产生和部分特性的研究[J]. 菌物系统,2003,22(4):628-633.
[16]王云侠. 假植时间对草莓生长发育的影响[J]. 北方果树,2007(1):14,22.
[17]雷东锋, 蒋大宗, 王一理. 烟草中多酚氧化酶的生理生化特征及其活性控制的研究[J]. 西安交通大学学报,2003(12):1316-1320.
[18]韩锦峰, 朱大恒, 杨素勤, 等. 不同陈化时期烤烟几种酶活性及相关化学成分的分析[J]. 中国烟草科学,1999(1):1- 2.
[19]Constabel C P, Ryan C A. A survey of wound and methyl jasmonate induced leaf Polyphenol Oxidase in Crop plants[J]. Phytochemistry (Oxford),1998,47(4):507-511.
[20]Legrand M, Fritig B, Hirth L. Enzymes of the phenylpropanoid pathway and the necrotic reaction of hypersensitive tobacco to tobacco mosaic virus[J].Phytochemitry,1976(15):1353-1359.
[21]Paynot M, Vallee J C, Martin C, et al. Effect of picloram on phenylalanine ammonia-lyase activity in nicotiana tabacum induced by a hyper sensitive reaction to tobacco mosaic virus[J]. Phytochemistry,1976,15(5):669-671.
[22]Vegetti G, Conti G, Pesci P. Changes in phenylalanine ammonia-lyase, peroxidase and polyphenoloxidase during the development of local necrotic lesions in pinto bean leaves infected with alfalfa mosaic virus[J]. Phytopathol,1975,84 (2): 153-171.
[23]冉莹青, 利容千, 王建波. 辣椒感染疫霉菌后几种酶活性及同工酶谱带变化[J]. 植物病理学报,1997(02):63.
[24]吴龙火, 李庆, 杨群芳, 等. 禾谷缢管蚜取食5种山羊草的诱导抗性[J]. 中国农业科学,2008(01):102-107.
[25]Charles R, Frank J, Michael B. Identification of two cytosolic ascorbate peroxidase cDNAs from soybean leaves and characterization of their products by functional expressionin E.coli[J]. Planta,1998(204):120-126.
[26]王静璞, 李英丽, 张建光. 高温、强光胁迫对苹果果皮组织APX活性的影响[J]. 华北农学报,2008(06):144-147.
[27]李英丽. 温度与光照强度对鸭梨果实抗氧化能力的影响及其机理研究[D]. 河北农业大学,2013.
[28]Paz-Lago D, Gutierrez A, Luzardo L. Biological relevance of the enzyme beta-1,3-glucanase on the activation of systemic resistance of tobacco induced by the fungal cell wall[J]. Cultivos Tropicales,1998,19(3):25-27.
[29]左豫虎, 康振生, 杨传平, 等. β-1,3-葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系[J]. 植物病理学报,2009,36(6):600-607.
[30]张少英, 王俊斌, 王海凤, 等. 甜菜几丁质酶和β-1,3-葡聚糖酶活性与其对丛根病抗性的关系[J]. 植物生理与分子生物学学报,2005(03):271-286.
[31]Cachinero J M, Cabello F, Jorrin J, et al. Induction of different chitinase and beta-1,3-glucanase isoenzymes in sunflower Helianthus annuus L. seedling in response to infection by Plasmopara halstedii[J]. European Journal of Plant Pathology,1996,102(4):401-405.
[32]Anguelova V S, Westhuizen A J. Intercellular proteins and beta-1,3-glucanase activity associated with leaf rust resistance in wheat[J]. Physiologia Plantarum,1999,106(4):393-401.
[33]Anguelova V S, Westhuizen A J, Pretorius Z A. Beta-1,3-glucanase and chitinase activities and the resistance response of wheat to leaf rust[J]. Journal of Phytopathology,2001,149(7/8):381-384.
Comparative study on activity of defensive enzymes between tissue culture seedlings and conventional seedlings of fl ue-cured tobacco
XU Dongmei1, WANG Wei1, CHEN Jianjun1, LUO Fuming2, ZHANG Jinlin3, LING Shoujun2, CHEN Jun3, HUANG Riwei3,DENG Shiyuan1
1 Tobacco Laboratory, South China Agricultural University, Guangzhou 510642, China;2 Guangdong Qingyuan Municipal Tobacco Company, Qingyuan 511515, Guangdong, China;3 Guangdong Lianzhou County Tobacco Company, Lianzhou 513400, China
Resistance capability difference between tissue culture seedlings and conventional seedlings was studied by using varieties(strains) K326, Yueyan97, and Huayan06, whose root activity and agronomic characters in seedling period, incidence rate and activities of PPO, PAL, APX , β-1,3-Glucanase during fi eld period were investigated. Results indicated that tissue culture seedlings outperformed conventional seedlings in terms of plant height, leaf number, stem girth, root volume, root activity and dry weight. Defensive enzyme activity was in the pattern of up-down-up, which meant that it increased at the start, then decreased and rose again in the fi nal period.Tissue culture seedlings showed no signi fi cant difference with conventional seedlings before vigorous growth stage. The enzyme activities decreased before increasing when infected by diseases and maintained at a high level for a long period. The increase of enzyme activities of tissue culture seedlings was higher than that of conventional seedlings. In particular, PPO, PAL and β-1,3-Glucanase of tissue culture seedling K326 was 29.58%, 15.30%, 73.03% higher than that of conventional seedlings respectively and Huayan06 tissue culture seedling’s APXA was 58.43% higher than that of conventional seedlings. The tissue culture seedling proved to have advantage in disease-resistance and insect-resistance.
fl ue-cured tobacco;defensive enzymes;tissue culture seedling;conventional seedling
许冬梅,王维,陈建军,等. 烤烟组培苗与常规苗大田防御酶活性的比较[J]. 中国烟草学报,2015,21(4)
中国烟草总公司广东省公司科技项目(201104,粤烟科【2011】28号)
许冬梅(1990— ),硕士研究生,研究方向为烟草栽培与品质生理,Email:348241995@qq.com
邓世媛(1975—),博士,副教授,研究方向为烟草栽培与品质生理,Email: yydsy@scau.edu.cn
2014-08-15
:XU Dongmei, WANG Wei, CHEN Jianjun, et al. Comparative study on activity of defensive enzymes between tissue culture seedlings and conventional seedlings of fl ue-cured tobacco [J]. Acta Tabacaria Sinica, 2015, 21(4)
