大理烟区不同类型植烟土壤养分状况分析
2015-11-23王新中樊在斗李再光王德勋户艳霞徐发华
王新中,樊在斗,李再光,王德勋,户艳霞,徐发华
云南省烟草公司大理州公司,云南省大理市鹤庆路71号 671000
孙翠红1,徐翠莲2,赵铭钦1,黄元炯3,黄海棠4,朱金峰4
1烟草学院国家烟草栽培生理生化研究基地,郑州 450002;
2河南农业大学理学院,郑州 450002;
3河南省烟草公司,郑州 450002;
4河南省漯河市烟草公司,漯河 462000
大理烟区不同类型植烟土壤养分状况分析
王新中,樊在斗,李再光,王德勋,户艳霞,徐发华
云南省烟草公司大理州公司,云南省大理市鹤庆路71号 671000
对大理烟区1111个土壤样品的养分状况进行分析。结果表明,(1) 大理烟区主要土壤类型为红壤、水稻土、新积土和紫色土,4种土壤类型pH值介于4.66~8.46之间,不同土壤类型pH值适宜烤烟生长(5.5~7.0)的比例分别为红壤67.22%、新积土63.49%、紫色土61.91%、水稻土57.80%;(2)4种土壤类型有机质含量整体较为丰富,含量高低依次为水稻土(42.55 g/kg)>红壤(36.04 g/kg)>新积土(35.51 g/kg)>紫色土(28.76 g/kg);(3)土壤碱解氮、速效磷平均含量均以水稻土最高,紫色土最低;土壤速效钾平均含量以红壤最高,紫色土最低;(4)土壤水溶性氯偏高的土壤(>30 mg/kg)所占比例分别为水稻土19.7%、红壤16.8%、紫色土9.09、新积土8.72%;(5)4种土壤类型有效锌含量整体较为丰富,除紫色土有效锌含量低于临界值(<0.5mg/kg)的土壤比例达6.06%以外,其余3种土壤类型有效锌含量低于临界值的土壤比例均较低;有效硼含量低于临界值(<0.5mg/kg)的比例以红壤最高达51.79%,其余土壤类型在38.87%~43.29%之间;4种土壤类型有效钼含量低于临界值(<0.15mg/kg)的比例均较高,分别为紫色土89.18%、新积土77.78%、水稻土68.54%、红壤56.47%。
烟草;土壤类型;土壤养分;大理
大理州位于云南省中部偏西, 境内年均气温15.8℃,年降雨量835.7mm,年日照时数2332 h,常年烤烟种植面积约28000hm2, 种植区域遍及全州12个县(市)。全州土壤类型多种,其中红壤、水稻土、新积土和紫色土占植烟土壤的98%以上[1],烤烟种植土壤类型多变、土壤理化性质各异,为烤烟测土施肥、分类指导带来了一定的难度。国内关于不同类型植烟土壤方面的研究已有一些报道[2-6], 但对大理烟区植烟土壤的研究自2002年以来未见详细报道[7]。为此, 笔者于2012 年对大理烟区植烟土壤肥力状况广泛开展了调查研究,旨在为提高烤烟整体生产水平提供参考依据。
1 材料与方法
1.1 土样采集
2012年采烤结束后,根据大理烟区植烟土壤的不同类型[1],对红壤、水稻土、新积土和紫色土分别进行采样,共采集1111个土样。其中,红壤363个,水稻土391个,新积土126个,紫色土231个 。具体采样方法为:按平均40hm2取一个土壤样品,在一个取样单位或连片区域画对角线,每条对角线上均匀布10个点,采集该20个点的耕层0~20 cm土壤样品,混合后四分法取舍数次后取1 kg作为该取样单位的一个土壤样品。经过风干、研磨、过筛、混匀、装瓶后以备测定分析。
1.2 测定项目及方法
土壤养分测定项目包括土壤pH值、有机质、碱解氮、速效磷、速效钾、有效锌、有效硼、有效钼、水溶性氯,测定方法参考文献[8]的方法进行。
2 结果与分析
2.1 不同土壤类型pH值状况
适宜的pH值是烟草正常发育和优质品质形成的保证,一般认为,适宜烤烟生长的土壤pH值为5.5~7.0,最适宜范围为5.5~6.5[9]。由表1可知,不同土壤类型土壤pH平均值均在烤烟适宜生长的范围内,但存在一定的变异,变异系数介于10.57%~12.01%之间;红壤在适宜范围内所占的比例最高为67.22%,其次为新积土(63.49%)和紫色土(61.91%),水稻土最低为57.80%。pH>7.0的土壤所占比例在21.21%~33.24%之间,pH<5.5的土壤所占比例在6.92%~11.57%之间。

表1 大理烟区不同土壤类型pH值分布状况Tab. 1 Distribution of pH values in different soil types of Dali tobacco-growing areas
2.2 不同土壤类型土壤有机质含量状况
土壤有机质是植物营养元素的源泉,且具有对植物产生刺激或抑制作用的特殊功能[10]。优质烟叶生长后期以碳代谢为主,对氮的需求量不大,过高的有机质含量会造成后期吸氮过剩,降低烟叶品质。由表2可知,不同类型土壤有机质含量依次为水稻土(42.55 g/kg)>红壤(36.04 g/kg)>新积土(35.51 g/kg)>紫色土(28.76 g/kg)。从变异系数来看,各类型土壤有机质含量变化较大,在40.66%~46.65%之间。一般认为,适宜烟草生长的有机质含量范围为15~25 g/kg[11],在此范围内,紫色土所占比例最高为27.71%,其次为新积土和红壤,分别为21.43%和21.21%,水稻土最低为11.76%。各土壤类型有机质含量偏高的比例均在57%以上,以水稻土比例最高为85.43%;紫色土有机质含量偏低的比例最高为14.72%,其余3种土壤类型介于2.81%~6.89%之间。

表2 大理烟区不同土壤类型有机质含量状况Tab. 2 Organic matter contents in different soil types of Dali tobacco-growing areas
2.3 不同土壤类型土壤碱解氮、速效磷和速效钾含量状况
氮素是影响烟株生长发育以及烟叶质量最重要的元素[12],土壤氮素含量、供应能力与烟叶产质有密切关系[9]。从表3可以看出,水稻土碱解氮平均含量最高达164.90 mg/kg,紫色土碱解氮含量最低为114.48 mg/kg。紫色土氮素含量相对较低的原因可能与其成土特点有关,紫色土由紫色砂页岩发育而成,土层浅薄,有机质含量低,而氮素含量与有机质含量呈正相关,故其氮素含量也较低[13]。从碱解氮的区间百分比来看,紫色土碱解氮含量<65mg/kg的比例也是最高的,达16.88%,其余3种土壤类型在2.81%~5.51%之间。

表3 大理烟区不同土壤类型碱解氮含量状况Tab. 3 Alkalytic nitrogen contents in different soil types of Dali tobacco-growing areas
磷与适量的氮相配合,可使糖类正常合成和积累,使烟叶的色泽和吸食品质得到改善,获得优良的外观和内在品质[12]。由表4可知,不同土壤类型速效磷平均含量均在中等(20~40 mg/kg)范围水平,速效磷含量最为丰富的是水稻土,平均为33.36mg/kg;最低的为紫色土,平均为28.64 mg/kg。土壤速效磷含量偏低(<20mg/kg)的比例分别为紫色土42.00%、红壤33.33%、水稻土31.71%和新积土28.57%。

表4 大理烟区不同土壤类型速效磷含量状况Tab. 4 Available phosphors contents in different soil types of Dali tobacco-growing areas
土壤速效钾易受外界环境条件如水分、温度等因素的影响,且在土壤中的移动性大,易被淋失,特别是高温多雨季节,淋失更为严重。胡国松等认为,植烟土壤中速效钾越高越好[14]。从表5可知,红壤速效钾含量最高,平均为238.96 mg/kg;其次为新积土,平均为222.09 mg/kg;最低的为紫色土,平均为193.48mg/kg。其中,土壤速效钾含量<150mg/kg的比例分别为紫色土(53.25%)>水稻土(43.99%)>红壤(31.68%)>新积土(30.95%)。

表5 大理烟区不同土壤类型速效钾含量状况Tab. 5 Available potassium contents in different soil types of Dali tobacco-growing areas
2.4 不同土壤类型土壤水溶性氯含量状况
烤烟是忌氯作物,烟叶中过高的浓度会影响烟叶的吸食品质,而烟叶中氯离子的含量主要受土壤中氯离子浓度的影响,两者之间呈正相关关系[15]。因此,将土壤氯离子含量控制在适量范围内对烟叶品质的形成具有重要意义。从表6可知,4种土壤类型水溶性氯含量偏高(30~45 mg/kg)的土壤所占比例分别为水稻土8.70%、红壤6.89%、紫色土4.76%、新积土2.38%;土壤水溶性氯过高(>45 mg/kg)的土壤所占比例分别为水稻土11.00%、红壤9.92%、新积土6.35%、紫色土4.33%。

表6 大理烟区不同土壤类型水溶性氯含量状况Tab. 6 Water soluble chlorine contents in different soil types of Dali tobacco-growing areas
2.5 不同土壤类型微量元素含量状况
微量元素虽在植物体内含量较低,但却是烟株生长和烟叶产量、品质形成必不可少的营养元素。如烤烟缺锌时,生长缓慢,植株矮小,节间短,叶片小,顶叶簇生,下部叶有大量坏死斑[14];缺硼时,叶片会增厚、皱缩、扭曲或翻转[16]。参考国内相关研究结果[17,18],将大理州植烟土壤有效锌、有效硼和有效钼的临界值定为0.5mg/kg、0.5mg/kg和0.15mg/kg。由表7可知,不同土壤类型有效锌含量基本能够满足优质烤烟生产的需求,含量由高到低的顺序为:紫色土>水稻土>红壤>新积土,低于临界值的比例分别为6.06%、1.28%、1.38%和1.59%。不同土壤类型有效硼含量低于临界值的土壤比例分别为红壤51.79%、水稻土38.87%、新积土40.48%、紫色土43.29%。不同土壤类型有效钼含量在临界值以下的比例均较大,在56.47%~89.18%之间,其中紫色土最高占89.18%,红壤较低占56.47%。
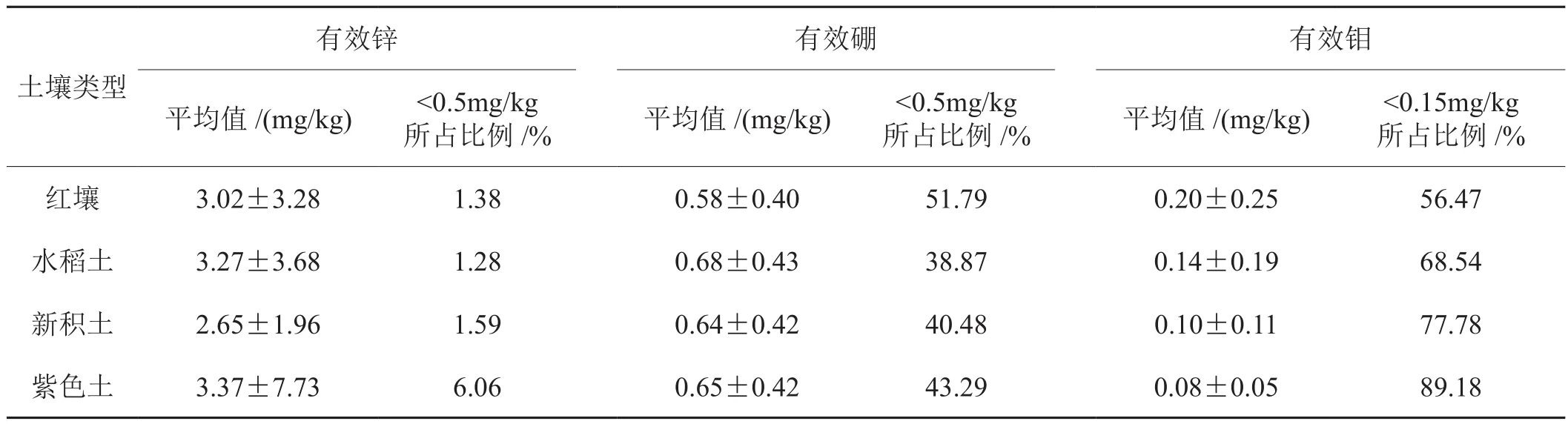
表7 大理烟区不同土壤类型微量元素含量状况Tab. 7 Trace element contents in different soil types of Dali tobacco-growing areas
3 结论
(1)大理烟区主要植烟土壤多呈微酸性或中性,有利于优质烤烟的生长发育,4种土壤类型分别有21.21%~33.24%的土壤偏碱,施肥时应尽量不施或少施碱性肥料,同时可施用生理酸性肥料进行改良;少部分偏酸的土壤,应减少酸性肥料的施用、改用碱性肥料,并适当施用生石灰,调节土壤pH值在烤烟适宜生长范围。各类土壤有机质含量较丰富,但有少部分紫色土有机质含量偏低,要注重有机肥的补充。
(2)除紫色土碱解氮含量偏低的比例稍高达16.88%外,其余各类型土壤碱解氮含量偏低的比例极少,因此这部分土壤可适当增加氮肥外,其余土壤则应严格控制氮肥的施用量;各类型土壤速效磷含量偏低的土壤均占相当比例,应增加磷肥的施用量;各土壤类型速效钾含量偏低的比例在30.95%以上,其中紫色土有53.25%的土壤处于缺钾状态,应结合实际增施钾肥。
(3)4种土壤类型均有一定比例的土壤水溶性氯含量偏高,特别是水稻土和红壤比例相对较大,在施肥上不仅在烤烟生产当季严禁施用含氯肥料,前茬作物也应杜绝施用含氯肥料,并通过合理灌溉、轮作等措施降低土壤氯含量。
(4)4种土壤类型有效锌含量普遍丰富,仅有极少数低于临界值;有效硼和有效钼含量整体偏低,其中有效硼含量低于临界值的比例在38.87%~51.79%,有效钼含量低于临界值的比例在56.47%~89.18%之间,应结合生产实际适当补充硼肥和钼肥。
[1]李再光. 大理州植烟土壤分析与评价[M]. 昆明:云南人民出版社,2014.
[2]王怡,陈建军,李福军,等. 广东南雄烟区主要植烟土壤类型养分状况分析[J]. 广东农业科学,2014,(1):37-41.
[3]王得强,程亮,许自成,等. 湖北十堰烟区不同土壤类型的肥力状况分析[J]. 安徽农业科学,2008,36(17):7322-7325.
[4]罗维斌,向鹏华,杨友才. 湖南祁东烟区不同植烟土壤类型肥力状况比较[J]. 邵阳学院学报(自然科学版),2009,6(4):57-60.
[5]张秋琴,周宝同,高明. 重庆市不同类型植烟土壤肥力状况研究[J].干旱地区农业研究,2006,24(4):25-29,81.
[6]安德艳,艾复清. 铜仁地区植烟土壤类型及肥力分析[J]. 贵州农业科学,2010,38(6):126-129.
[7]邹加明,单沛祥,李文璧,等. 大理州植烟土壤肥力质量现状与演变趋势[J]. 中国烟草学报,2002,(4):15-21.
[8]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.
[9]刘国顺. 烟草栽培学[M]. 北京:中国农业出版社,2003.
[10]林成谷. 土壤学[M]. 北京:中国农业出版社,1998.
[11]陈江华,李志宏,刘建利 ,等. 全国主要烟区土壤养分丰缺状况评价[J]. 中国烟草学报,2004,10(3):14-18.
[12]闫克玉. 烟草化学[M]. 郑州:郑州大学出版社,2002.
[13]何毓蓉. 中国紫色土(F篇)[M]. 北京:科学出版社. 2001.
[14]胡国松,郑伟,王震东,等. 烤烟营养原理[M]. 北京:科学出版社,2000.
[15]许自成,郭燕,肖汉乾. 湖南烟区土壤水溶性氯的地区分布特点及其与烤烟氯含量的关系[J]. 生态学杂志,2008,27(12):2190-2194.
[16]韩锦峰. 烟草栽培生理[M]. 北京:中国农业出版社,2003.
[17]刘铮,朱其清,唐丽华,等. 我国缺乏微量元素的土壤及其区域分布[J]. 土壤学报,1982,19(3):209-223.
[18]陈江华,刘建利 ,李志宏,等. 中国植烟土壤及烟草养分综合管理 [M]. 科学出版社,2008.
:WANG Xinzhong, FAN Zaidou, LI Zaiguang, et al. Analysis of nutrient status in different types of tobacco-growing soil in Dali[J]. Acta Tabacaria Sinica, 2015,21(6)
植物保护
壳寡糖衍生物纳米银微粒诱导烟株产生TMV抗性
孙翠红1,徐翠莲2,赵铭钦1,黄元炯3,黄海棠4,朱金峰4
1烟草学院国家烟草栽培生理生化研究基地,郑州 450002;
2河南农业大学理学院,郑州 450002;
3河南省烟草公司,郑州 450002;
4河南省漯河市烟草公司,漯河 462000
摘 要:为开发高效、低毒且环境友好的新型抗烟草普通花叶病毒制剂,以合成的具有季铵盐结构的新型壳寡糖希夫碱衍生物为还原剂和稳定剂合成了壳寡糖衍生物纳米银微粒(C4-AgNPs),并探讨了其对烟草花叶病毒的抑制效应及生理生化机制。结果表明17 µg/mL 的C4-AgNPs在珊西烟上对烟草普通花叶病毒具有良好的预防和治疗效果,防效可达到86.95%;C4-AgNPs喷施在感染TMV的普通烟K326上可在一定的时间内提高叶片内防御酶过氧化氢酶(CAT) 和苯丙氨酸解氨酶(PAL)的活性,使脯氨酸含量得到提高,丙二醛含量降低。
关键词:纳米银;壳寡糖季铵盐衍生物;烟草普通花叶病毒;抑制;机理
引用本文:孙翠红,徐翠莲,赵铭钦,等. 壳寡糖衍生物纳米银微粒诱导烟株产生TMV抗性[J]. 中国烟草学报,2015,21(6)
基金项目:河南省烟草公司重点科技攻关项目[HYKJ201015]和[HYKJ201307].
作者简介:孙翠红(1988—),硕士,主要从事烟草化学研究,Email:13838144121@163.com
徐翠莲,博士,教授,硕士生导师,从事应用化学研究,Tel: 0371-63558138,Email: xucuilian666@126.com赵铭钦,教授,主要从事烟草化学研究,Tel: 0371-63555713,Email: zhaomingqin@126.com
收稿日期:2014-10-22
寡糖是复杂的碳水化合物,公认在调节植物生长、发育和防御起着一定的作用[1]。有研究表明[2],植物能够利用寡糖结构的复杂性通过各种防御反应主动调节植物重要的生理过程,包括快速产生活性氧、细胞壁的合成和加强病程相关蛋白(PR)。作为低聚糖家族的一个成员,壳寡糖(CS)是一种聚合度在3到10之间,交联度低于5%的低聚β-(1,4)-2-脱氧-2-氨基葡萄糖[3],它是一种诱导植物产生防御反应的潜在信号[4]。实验研究表明,CS在形态和生理水平方面具有抗真菌活性[5]和抗病毒活性[6-7]。有研究表明,壳寡糖对烟草普通花叶病毒有很好的抑制作用[8-9]。目前,已经推出的主成分为壳寡糖的多种抗病毒剂,在烟草普通花叶病上的防治效果可以达到20%~40%[10],国内外又相继合成了壳寡糖的席夫碱、壳寡糖的磷酸酯、烷基化和磺酰化衍生物,发现其抗病效果比未修饰的壳寡糖明显提高[11-12]。随着研究的进一步深入,壳寡糖诱导植物抗病性的作用机理逐渐被了解[13-15],有研究表明壳寡糖诱导烟草对TMV产生防御可能与N基因介导的抗性有关[16-17],这为壳寡糖及其衍生物诱导植物抗病机理的深入研究奠定了理论基础。
纳米银(silver nanoparticles, AgNPs)是应用纳米技术将银单质纳米化后形成的超微颗粒,它具有稳定的物理和化学性能。目前制备AgNPs的方法包括多糖法、生物法、Tollens法以及物理法等,其中利用天然源或生物源产生的多糖制备纳米银由于制备过程的绿色化而成为研究热点。近年来,纳米银作为一种新型、绿色、高效的纳米材料在医药、食品、精细化工领域备受关注。AgNPs不仅具有强效抗菌以及广谱抗菌的作用[18-19],还具有抗病毒[20-21],抗肿瘤[22-23]等生物活性。Hoang[24]和Wei[25]等利用壳聚糖为还原剂和稳定剂制备的纳米银溶液具有良好的抑菌作用。壳寡糖纳米银的抗病毒活性也已有报道[26-27],对人体H1N1、HCMV等具有显著的抑制作用。
纳米银在烟草病毒防治上的研究起步较晚,杨海艳等[28-29]研究了电解法和微波法制得的纳米银对接种TMV的心叶烟的抑制作用,最高达到57%的预防效果。本课题组近年来一直从事对壳寡糖的结构改性研究,并进一步利用修饰后的壳寡糖衍生物制备纳米银,目的是获得药效更高的壳寡糖衍生物和更加便于大量制备纳米银的方法,为其生产上的应用提供研究基础。课题组以壳寡糖为原料,通过经典的化学反应合成了一类具有季铵盐结构的新型壳寡糖希夫碱季铵盐衍生物,并以此为还原剂和稳定剂合成了C4-AgNPs(如图1所示)。本试验研究了C4-AgNPs对TMV的最适浓度和防治效果,初步探讨了其诱导抗性机理,以期为新的绿色诱导抗病毒药剂开发提供参考。
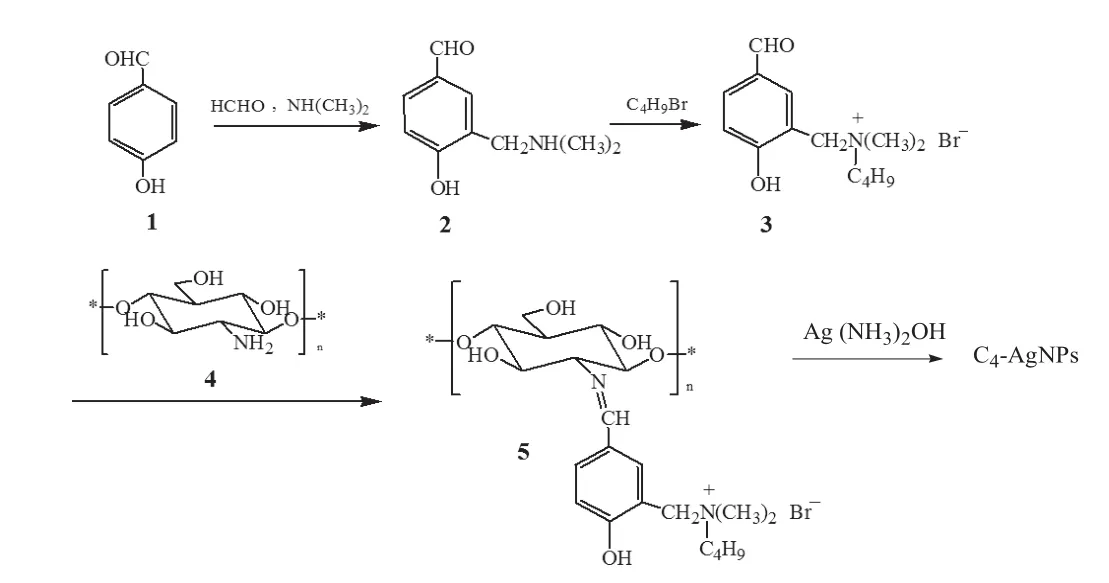
图1 基于新型壳寡糖季铵盐衍生物的纳米银合成Fig. 1 Synthesis of C4-AgNPs
1 材料与方法
1.1 实验材料
供试植物:珊西烟(Nicotiana tabacumcv.Xanthi-nc)为TMV的枯斑寄主,购自中国烟草总公司青州烟草研究所;普通烟(Nicotiana tabacum)K326(K326感普通花叶病)为TMV的系统侵染寄主。
供试病毒:烟草普通花叶病毒(Tobacco mosaic virus, TMV),由贵州大学提供,供试病毒TMV采用常规汁液摩擦接种的方法保存在普通烟K326上。
供试药剂:市售宁南霉素(稀释260倍),德强生物股份有限公司;壳寡糖(分子量平均约为5000)上海海曲化工有限公司;壳寡糖C4季铵盐由本实验室合成。
1.2 实验方法
1.2.1 壳寡糖季铵盐衍生物纳米银的合成
向50 mL烧杯中加入15 mL壳寡糖C4季铵盐溶液(1 mg/mL),在80 ℃、磁力搅拌器搅拌下缓慢加入0.2 mL的银氨溶液(其中mol/L),继续搅拌10min,得到橙红色壳寡糖季铵盐衍生物纳米银溶液(C4-AgNPs),将C4-AgNPs设为 1 mg/mL、50 μg/mL、17 μg/mL 和 10 μg/mL 四个浓度。
1.2.2 枯斑寄主半叶法
采用枯斑寄主半叶法[30-32]对供试药剂进行筛选。TMV病毒汁液浓度为3.33 µg/mL, 采用常规汁液摩擦接种法。
预防试验:选取长势一致、4~5片真叶的盆栽珊西烟喷药24 h后半叶接种TMV,以半叶喷清水24 h后接种TMV为对照,每个处理重复3次,观察发病情况,计算枯斑抑制率。
治疗试验:选取长势一致、4~5片真叶的盆栽珊西烟半叶接种TMV 12 h后喷药,以半叶接种TMV 12 h后喷清水为对照,每个处理重复3次,观察发病情况,计算枯斑抑制率。

1.2.3 最优药剂在K326烟株上对TMV的诱导抗性研究
选用长势一致,7~8片真叶的盆栽K326进行试验。在对K326喷施最优药剂以及对照药剂24 h后,采用常规汁液摩擦接种法接种TMV,TMV病毒汁液浓度为3.33 µg/mL。试验设有:处理1(喷施稀释260倍的宁南霉素后接种TMV,T1),处理2(喷施17 μg/mL C4-AgNPs后接种TMV,T2),处理3(喷施1 mg/mL壳寡糖后接种TMV,T3),处理4(喷施清水后接种TMV,CK)。在接种后1 d、4 d、7 d、10 d、13 d和16 d分别取样装入锡箔纸,做好标记,置于-80 ℃冰箱中保存。
烟草普通花叶病毒的提纯采用Gooding的方法[33]。叶绿素的测定采用乙醇提取法[34];过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)参照Chen Yafei的方法[35];丙二醛参照赵世杰的方法[36];脯氨酸采用邹琦的方法[37]。
2 结果与分析
2.1 最优抗病毒药剂的筛选
对8个处理药剂下,枯斑预防效果以及治疗效果进行统计分析,结果如表1所示,从预防效果来看,17 μg/mL C4-AgNPs的枯斑抑制率高达86.95%,比市售药剂宁南霉素高出24.09%,比预防效果最差的1 mg/mL壳寡糖C4席夫碱季铵盐高出47.51%。从治疗效果来看,10 μg/mL C4-AgNPs治疗效果最好,为44.23%,其次为17 μg/mL C4-AgNPs,最差的依然是1 mg/ml C4席夫碱季铵盐。各个处理与宁南霉素处理和壳寡糖处理相比差异性不明显。17 μg/mL C4-AgNPs的枯斑抑制效果如图2和图3所示。综合预防与治疗效果选择进一步在普通烟上研究C4-AgNPs的诱导抗病毒机理。

表1 供试药剂在珊西烟上对TMV的抑制效果Tab. 1 Inhibition of the test agents against TMV diseases on Nicotiana tabacum cv. Xanthi-nc

图2 预防效果中珊西烟发病情况Fig. 2 Necrosis spots on Nicotiana tabacum cv. Xanthi-nc of preventive effect

图3 治疗效果中珊西烟发病情况Fig. 3 Necrosis spots on Nicotiana tabacum cv. Xanthi-nc of treatment effect
2.2 试剂处理下防御酶活性的动态变化
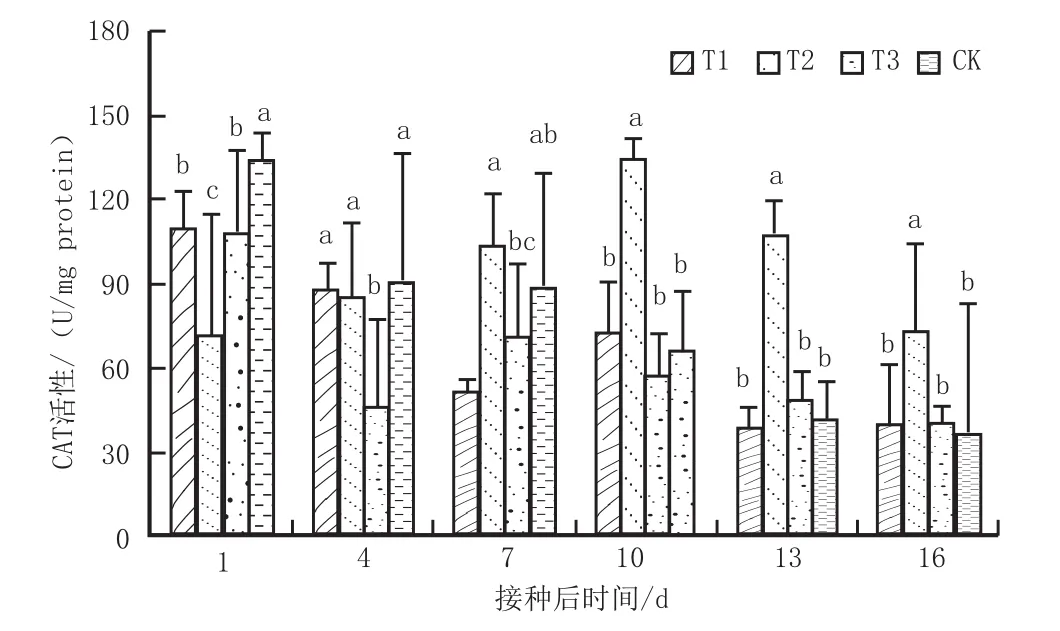
图4 药剂处理下CAT酶的活性变化Fig. 4 Changes of CAT activities under drug treatment

图5 药剂处理下PAL酶的活性变化Fig. 5 Changes of PAL activities under drug treatment
测定了不同药剂处理后叶片中CAT、PAL防御酶的含量变化,结果如图4、图5所示。由图4可以看出,与对照CK相比,T2处理(17 μg/mL C4-AgNPs处理)在第10天出现酶活最大值133.94 U/mg,且其CAT酶活最高峰分别高出T1、T3处理34.33%、47.66%,与其它处理相比T2处理下整体上酶活性较高,T2处理与对照CK相比差异性显著,其它处理与CK之间差异性不明显。CAT 是植物细胞内保护酶系统的一个重要酶,作为植物细胞内重要的活性氧清除剂,在植物与病原物互作中,CAT 可通过活性发生变化诱导植物的抗病反应,因此,喷施最优药剂17 μg/mL的 C4-AgNPs可有效提高感病烟株CAT酶活。
如图7所示,T1和T3处理在第4天达到最大值之后呈明显下降趋势,T2处理酶活性在第13天出现了一个最高值,因此17 μg/mL的 C4-AgNPs药剂对烟株PAL的酶活性的作用具有长效性,效果明显。T2处理下PAL酶活性变化与CK相比差异性显著,其它处理和CK之间差异不显著。PAL在植物体内是苯丙烷类代谢途径的关键酶和限速酶,与酚类代谢有关,酚类物质为次生抗病性物质,可提高植物的抗病能力,故喷施17 μg/mL C4-AgNPs在一定程度上可有效的提高被TMV侵染后防御酶PAL的活性,从而提高烟草的抗病性。
2.3 试剂处理下烟叶中丙二醛和游离脯氨酸的动态变化
丙二醛是细胞膜膜脂过氧化的最终产物,它可降低膜内不饱和脂肪酸的含量,从而改变膜的结构和功能,引起一系列的生理变化,其含量的高低反映了细胞膜质的过氧化水平以及植物对逆境条件反映的强弱[38],脯氨酸是逆境条件下产生的可反映逆境水平的一种重要的氨基酸。
测定了不同药剂处理后叶片中丙二醛和游离脯氨酸的含量变化,结果如图8、图9所示,由图8可知,与对照CK相比,T2处理下烟叶中的丙二醛含量整体上低于从第7天以后同期间的其它处理,各个处理与对照CK相比均存在着显著性差异,说明施用17 μg/mL的 C4-AgNPs可有效的降低丙二醛含量,即降低烟草受TMV侵染造成的膜脂过氧化程度。
如图9所示,各个处理下游离脯氨酸含量均在第7d达到最大值,第7天以后T2处理下烟叶中的游离脯氨酸的含量高于相应期间的其它各个处理, T2处理下游离脯氨酸含量变化与CK相比呈现显著性差异,T2和T3处理与CK相比差异性较显著。
由此可知,喷施17 μg/mL C4-AgNPs在一定程度上可有效的减少被TMV侵染后丙二醛的含量和增加脯氨酸的含量,从而提高烟草的抗病性。

图6 药剂处理下丙二醛的含量变化Fig. 6 Changes of MDA content under drug treatment

图7 药剂处理下脯氨酸的含量变化Fig. 7 Changes of proline content under drug treatment
3 结论与讨论
(1) 采用枯斑寄主半叶法对不同浓度的C4-AgNPs在珊西烟上进行抑制TMV活性筛选。结果表明,不同浓度的C4-AgNPs有不同的防治效果,以17 μg/mL C4-AgNPs的防治效果最好,其预防效果可达到86.95%,且比已报道的[29]结果显著提高,其中原因有待深入研究。治疗效果中以抑制率为44.23%的10 μg/mL C4-AgNPs效果较好。药剂的防治效果可能与其浓度以及壳寡糖衍生物结构中的取代基团发生协同作用有关,且药剂的预防效果远远好于治疗效果,对烟株可采取以预防为主、治疗为辅的措施。通过在普通烟上的进一步生理试验得出,17 μg/mLC4-AgNPs可有效的诱导被TMV侵染的烟株的抗性。
(2) 活性氧的积累可导致膜脂过氧化,使植物受到伤害,研究表明,防御酶PAL、CAT等可对活性氧进行有效的清除。研究表明PAL活性的升高与木质素等抗性物质的产生和积累呈正相关性,故PAL活性常作为植物抗病性的重要生化指标[40];一般认为,植物感染病原菌后 CAT 活性降低,或与抗病品种的非亲和性互作中其活性降低[40],在一定的时间内,本研究也得到了相同的结果。烟株感病后17 μg/mL C4-AgNPs处理可使对烟叶有毒害作用的丙二醛的含量降低,达到降低TMV侵染后烟叶的膜脂过氧化程度;受TMV侵染的烟株在17 μg/mL C4-AgNPs处理下烟叶中游离脯氨酸含量增加,在一定程度上增强了烟株对TMV侵染胁迫的抗性。
(3) 与农业上广泛应用的宁南霉素相比,C4-AgNPs在诱导抗TMV方面具有较好的效果,为今后新的抗TMV药剂的开发提供新思路。研究的不足之处主要包括AgNPs对TMV的抗性机制以及壳寡糖衍生物本身所发挥的作用缺乏深入研究,因此,围绕上述问题开展相关研究包括利用现代分子生物学的新技术和方法成为下一步的研究目标。
参考文献
[1]Prome J C. Signalling events elicited in plants by de fi ned oligosaccharide structures[J]. Curr Opin Struct Biol, 1996,6: 671-678.
[2]Mondry K W. Plant virus–host cell relations[J]. Annu Rev Phytopathol, 1963, 1: 173-196.
[3]Zhang Hu, Du Yuguang, Yu Xingju, et al. Preparation of chitooligo-saccharides from chitosan by a complex enzyme[J]. Carbohydr Res, 1999, 320: 257-260.
[4]Hadwiger L A, Ogawa T, Kuyama H. Chitosan polymer sizes effective in inducing phytoalexin accumulation and fungal suppression are verified with synthesized oligomers[J]. Mol Plant Microbe Interact, 1994, 7: 531-533.
[5]Xu Junguang, Zhao Xiaoming, Han Xiuwen, et al.Antifungal activity of oligochitosan against Phytophthora capsici and other plant pathogenic fungi in vitro[J]. Pestic Biochem Physiol, 2007, 87: 220-228.
[6]Feng B, Chen Y, Zhao C, et al. Isolation of a novel Ser/Thr protein kinase gene from oligochitosan-induced tobacco and its role in resistance against tobacco mosaic virus[J]. Plant Physiol Biochem, 2006, 44: 596-603.
[7]Zhao Xiaoming, She Xiaoping, Du Yuguang, et al. Induction of antiviral resistance and stimulary effect by oligochitosan in tobacco[J]. Pestic Biochem Physiol, 2007, 87: 78-84.
[8]商文静, 吴云峰, 赵小明, 等. 壳寡糖诱导烟草抑制TMV增殖的研究[J]. 西北农林科技大学学报(自然科学版), 2006, 34(5): 88-91.
[9]马镝, 赵秀香, 吴元华. 壳寡糖对烟草花叶病毒的抑制作用及其对烟草酶活性的影响[J]. 中国生物防治, 2008,24(2): 154-158.
[10]郭红莲, 李丹, 白雪芳, 等. 壳寡糖对烟草TMV病毒的诱导抗性研究[J]. 中国烟草科学, 2002, 4: 1-3.
[11]Huang Junmin, Chen Ruyu. An overview of recent advances on the synthesis and biological activity of α-aminophosphonic acid derivatives[J]. Heteroatom Chem,2000, 11: 480-492.
[12]Miao Zhiwei, Fu Cuirong, Wang Bin, et al. Synthesis and electrospray ionization mass spectra of N-(1,3,2-dioxaphosphorinan-2-ylmethyl)thiophosphoramidates [J].Chin J Chem, 2007, 25(9): 1344-1348.
[13]Zhao Xiaoming, Du Yuguang. Research progress of oligosaccharide stimulate plant immune and oligosaccharide plant vaccine[M]. //Qiu Dewen editor in chief. Plant immune and Plant Vaccine-Research and Practice. Beijing:Sci Press, 2008: 48-66.
[14]陈娅斐. 壳寡糖诱导烟草mapk基因抗性机理的初步研究[D]. 大连: 中国科学院大连化学物理研究所, 2005.
[15]赵小明. 壳寡糖诱导植物抗病性及其诱抗机理的初步研究[D]. 大连:中国科学院大连化学物理研究所, 2006.
[16]Lu Hang, Zhao Xiaoming, Bai Xuefang, et al. Involvement of N-mediated defense in oligochitosan inducing resistance to tobacco mosaic virus[J]. J Biotechnol, 2008,136(Supplement 1): S581-S582.
[17]Ashraful H M, Nobumitsu S, Hiromi K, et al. Identi fi cation of a Tobacco mosaic virus elicitor-responsive sequence in the resistance gene N[J]. Physio Mo Plant Pathol, 2009,xxx: 1-8.
[18]Li Wenru, Xie Xiaobao, Shi Qingshan, et al. Antibacterial activity and mechanism of silver nanoparticles on Escherichia coli[J]. Appl Microbiol Biotechnol, 2010, 85:1115-1122.
[19]Hernandez-Sierra J F, Ruiz F, Pena DCC, et al. The antimicrobial sensitivity of streptococcus mutans to nanoparticles of silver, zinc oxide, and gold[J].Nanomedicine, 2008, 4: 237-240.
[20]Sun raymond wai-yin, Chen Rong, Chuang Nancy P Y, et al. Silver nanoparticles fabricated in hepes buffer exhibit,cytoprotective activities toward HIV-1 infected cells[J].Chen Commun, 2005: 5059-5061.
[21]Lu Lei, Sun raymond wai-yin, Chen Rong, et al. Silver nanoparticles inhibit hepatitis B virus replication[J].Antiviral Therapy, 2008, 13(2): 253-262.
[22]Youngs W J, Robishaw N, Panzner M J. Treatment of breast cancer with silver antitumor drugs encapsulated in biodegradable polymeric nanoparticles[J]. Nanotech Conference amp; Expo, 2009, 2:5-8.
[23]Okada H, Mak T W. Pathways of apoptotic and nonapoptotic death in tumour cells[J]. Nat Rev Cancer, 2004, 4:592-603.
[24]Hoang V T, Lam D T, Cham T B, et al. Colloids and Surfaces A: Physico-chemical and Engineering Aspects[J].2010, 360(1-3): 32-40.
[25]Wei Dongwei, Sun Wuyong, QianWeiping, et al. The synthesis of chitosan-based silver nanoparticles and their antibacterial activity[J]. Carbohydr Res, 2009, 344(17):2375-2382.
[26]Mori Yasutaka, Ono Takeshi, Miyahira Yasushi, et al.Antiviral activity of silver nanoparticle/chitosan composites against H1N1 influenza A virus[J]. Nanoscale research letters, 2013, 8: 93-99.
[27]Russo E, Gaglianone N, Baldassari S, et al. Preparation,characterization and in vitro antiviral activity evaluation of foscarnet-chitosan nanoparticles[J]. Colloids and Surfaces B: Biointerfaces, 2014, 118: 117-125.
[28]杨海艳, 谢雪梅, 王波, 等. 纳米银对烟草病毒的体外抑制作用[J]. 贵州农业科学, 2011, 39(11): 112-114.
[29]杨海艳, 王福超, 王浩华, 等. 纳米银对烟草花叶病毒的抑制作用及烟草酶活性的影响[J]. 江苏农业科学, 2012,40(2): 87-89.
[30]Hadidi A, Khetarpal R K, Koganezawa H. Plant virus disease control [M]. St Paul, Minnesota: The American Phytopathol Society, 1998: 154-162.
[31]French C J, Towers G HN. Inhibition of infectivity of potato virus X by fl avonoids [J]. Phytochem, 1992, 31(9): 3017-3020.
[32]李重九, 费菁. 丙酰紫草素对病毒的钝化作用[J]. 中国农业大学学报, 1997, 2(5) : 47-50.
[33]Gooding G V jr, Hebert T T. A simple technique for puri fi cation of tobacco mosaic virus in large quantities[J].Phytopathol Notes, 1967, 57: 1285.
[34]李虎林, 白青竹, 姬文秀, 等. 不同类型烟草叶片叶绿素和类胡萝卜素含量比较分析[J]. 延边大学农学学报,2008, 30(3): 153-156.
[35]Chen Yafei, Zhan Yong, Zhao Xiaoming, et al. Functions of oligochitosan induced protein kinase in tobacco mosaic virus resistance and pathogenesis related proteins in tobacco[J]. Plant Physiol Biochem, 2009, 47: 724-731.
[36]赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯, 1991, 30(3): 207–210.
[37]邹琦. 植物生理生化实验指导[M]. 北京: 中国农业出版社, 1995.
[38]蒋靓, 庄杰云, 樊叶杨, 等. 与水稻耐逆性相关的叶片丙二醛含量的 QTL分析[J]. 中国水稻科学, 2007(4): 436-438.
[39]郭兴启, 温孚江, 朱汉城. 烟草感染马铃薯Y病毒(PVY)后光合作用的变化规律[J].浙江大学学报: 农业与生命科学版, 2000, 26(1): 75-78.
[40]吴元华, 文才艺, 李浩戈, 等. 烟草感染马铃薯 Y 病毒坏死株系后六种酶活性变化的研究[J]. 中国烟草学报,1999, 5(2): 30-34.
Abstract:C4-AgNPs were synthesized by using new chitosan Schiff base derivatives with the structure of quatemary ammonium salt as reducing agent and stabilizer to develop new anti-TMV agent which was efficient, low toxic and environmental friendly. Inhibitory effect of s C4-AgNPs on TMV and its biochemical mechanism were also studied. Results showed that 17 µg/mL C4-AgNPs had good prevention and treatment effects on TMV, and it could effectively reduce the number of lesion with prevention rate up to 86.95%. C4-AgNPs could improve activity of defense enzymes catalase (CAT) and phenylalanine ammonialyase (PAL).Meanwhile, the content of proline was enhanced and that of MDA reduced by tracing the changes of physiological and biochemical indexes in a certain period of time on Nicotiana tabacum var. K326.
Keywords:silver nanoparticles; chitosan quaternary ammonium salt derivatives; TMV; inhibition; mechanism
Citation:SUN Cuihong, XU Cuilian, ZHAO Mingqin, et al. Study on TMV resistance of tobacco plants induced by chitosan oligosaccharide derivatives silver nanoparticles [J]. Acta Tabacaria Sinica, 2015,21(6)
Analysis of nutrient status in different types of tobacco-growing soil in Dali
WANG Xinzhong, FAN Zaidou, LI Zaiguang, WANG Dexun, HU Yanxia, XU Fahua
Dali Prefecture Tobacco Company, Yunnan Province, Dali 671000, China
1111 topsoil samples from Dali tobacco-growing areas were collected and analyzed. Results showed that: (1) the main soil types in Dali tobacco-growing areas were red soil, paddy soil, fl uvo-aquie soil and purple soil, with pH values in the range of 4.66~8.46. The proportion of pH values suitable for tobacco cultivation(5.5~7.0) were 67.22%, 63.49%, 61.90% and 57.80%,respectively. (2) Average contents of organic matter (OM) of different soil types were generally high, and paddy soil had the highest, followed by red soil, fl uvoaquie soil and purple soil. (3) Contents of soil alkalytic nitrogen (AN) and available phosphorus (AP) were highest in paddy soil, while content of available potassium (AK) was highest in red soil. Purple soil had the lowest content of AK, AP and AK. (4) The proportion of soil water soluble chlorine (> 30mg/kg) was highest in paddy soil, which was 8.72%, followed by red soil 9.09%, purple soil 16.8% and fl uvo-aquie soil 19.7%. (5) Soil available zinc were generally abundant expect in purple soil where available zinc was 6.06%, which was less than the critical value (0.5 mg/kg). The proportion of soil available boron (less than critical value of 0.5mg/kg) was highest in red soil with a ratio of 51.79%, and the others ranged from 38.87% to 43.29%. The proportion of soil available molybdenum (less than critical value of 0.15mg/kg) were all relatively high, which were 89.18%, 77.78%, 68.54%, 56.47% for purple soil, fl uvo-aquie soil, paddy soil and red soil, respectively.
tobacco; soil type; soil nutrient; Dali
Study on TMV resistance of tobacco plants induced by chitosan oligosaccharide derivatives silver nanoparticles
SUN Cuihong1, XU Cuilian2, ZHAO Mingqin1,HUANG Yuanjiong3,HUANG Haitang4,ZHU Jinfeng4
1 National Tobacco Cultivation amp; Physiology amp; Biochemistry Research Center, Zhengzhou 450002, China;
2 College of Science, Henan Agricultural University, Zhengzhou 450002, China;
3 Henan Provincial Tobacco Corporation, Zhengzhou 450002, China;
4 Henan Luohe Municipal Tobacco Company, Luohe 462000, Henan, China
王新中,樊在斗,李再光,等. 大理烟区不同类型植烟土壤养分状况分析[J]. 中国烟草学报,2015,21(6)
大理州科技计划项目“大理州植烟土壤分析与评价”(20130105)
王新中(1978—),农艺师,博士,从事烟草栽培方面的研究,Email:xzwangl@163.com
2014-12-19
