BABA诱导烟草抵御高锌胁迫的初步研究
2015-11-23陆雪莲顾厚武陈祝单丹丹王文杰何宽信陈学平
陆雪莲,顾厚武,陈祝 ,单丹丹,王文杰 ,何宽信 ,陈学平
1中国科学技术大学化学系,安徽省合肥市金寨路96号 230026;
2中国科学技术大学纳米学院,江苏苏州市独墅湖高教区仁爱路166号 215123;
3江西省烟草公司,江西省南昌市洪城路298号 330025;
4安徽省池州市烟草公司,安徽省池州市贵池区长江中路41号 247100
BABA诱导烟草抵御高锌胁迫的初步研究
陆雪莲1,2,顾厚武3,陈祝1,单丹丹1,王文杰4,何宽信3,陈学平1
1中国科学技术大学化学系,安徽省合肥市金寨路96号 230026;
2中国科学技术大学纳米学院,江苏苏州市独墅湖高教区仁爱路166号 215123;
3江西省烟草公司,江西省南昌市洪城路298号 330025;
4安徽省池州市烟草公司,安徽省池州市贵池区长江中路41号 247100
通过测定抗氧化体系、离子含量及基因表达探讨了β-氨基丁酸(BABA)诱导烟草抵御高锌胁迫作用机理。结果表明:0.2 mmol/L BABA能够诱导烟草缓解高锌胁迫,相比对照组增加了幼苗叶片中脯氨酸、还原性谷胱甘肽及可溶性蛋白含量且使丙二醛含量恢复到几乎正常水平;APX、POD、CAT酶活性略有下降但SOD酶活性增加最终使信号分子H2O2含量上升;等离子体发射光谱仪测试表明BABA处理使叶片中Zn2+含量下降,而对根部Zn2+含量影响不大;基因表达得出0.2 mmol/L BABA处理后PR1、PR2、NtMTP1A、NtMTP1B、NtC477及NtYSL基因表达上调。综合来看0.2 mmol/L BABA缓解烟草高锌胁迫是通过激发植物体抗氧化系统、限制Zn2+向上运输以及抗病蛋白和离子转运蛋白相关基因表达量上调的综合结果。
β-氨基丁酸;烟草;高锌胁迫
锌是植物生长必需微量元素,能够作为多种酶的辅助因子参与光合作用、蛋白合成、维持细胞膜结构、调节酶活性、转录、翻译和信号传导等诸多生命代谢途径[1-3]。根据植物对锌的需求不同,正常条件下土壤中锌浓度一般在15 mg/kg到100 mg/kg之间[4]。当外界锌浓度过高时,不仅会抑制植物生长、矿物元素吸收下降、ABA积累、叶片萎黄、根尖分生组织有丝分裂减弱,还会导致细胞膜裂解、离子渗漏、DNA与RNA降解及活性氧爆发诱导脂膜过氧化反应[5-9]。这就意味着植物体内的Zn2+浓度应该保持在一个相对狭窄范围以避免毒性效应。
我国土壤平均含锌量比世界高出一倍,受Zn、Cd等重金属污染的耕地约占总耕地面积的1/5,高达2000万hm2[10],部分高锌污染区锌超标率达到44 %[11]。在重金属锌污染土地开展春小麦[12]、大麻[13]、油菜[14]等种植试验,发现锌毒害使小麦株高降低、分蘖和生长受抑制,产量下降;锌胁迫还会导致大麻和油菜茎叶锌含量超标,通过食物链扩大污染。据艾绥龙[15]等报道烟叶总糖含量与一定范围内的锌浓度成显著正相关,锌浓度过高促使总糖含量增加,导致烟叶中糖碱比失衡,造成烟气香味平淡缺乏劲头,并产生酸性刺激。李义强[16]和胡钟胜[17]也指明烟叶中积累重金属会使烟叶化学成分代谢不协调,烟气中重金属含量增加,从而降低烤烟的内在品质。
β-氨基丁酸(BABA)是植物体内很少存在的非蛋白氨基酸。早在1963年就证明了BABA能够提高豌豆抗Aphanomyces euteiches病害能力,之后证实其可提高多种抗病和抗逆能力如诱导番茄抗青枯病[18]、卷心菜抗黑斑病[19]、拟南芥抗高温[20]、高盐[21]、低钾[22]、诱导春小麦抗干旱[23]及大豆抗重金属镉胁迫[24]等。
由于受自然条件影响,如何提高烟草对各种不利环境的抵抗能力一直是广大学者所关注的问题。BABA能够提高植物对多种胁迫的耐受性,但对调节烟草受高锌胁迫的研究很少有报道。本研究发现BABA能够在一定程度上提高烟草对锌离子的耐受性。为进一步了解BABA调节锌胁迫相关作用机理,测定分析了抗氧化物质含量、抗氧化酶活性、叶和根中Zn2+含量及相关基因表达量,以期为提高烟草抗锌胁迫能力提供参考。
1 材料和方法
1.1 材料和试剂
烟草品种云烟87来自于安徽农业科学院,BABA市购,RNA提取试剂盒和反转录试剂盒分别购自于天根生物试剂有限公司和大连Takara公司。
1.2 生长条件和处理
培养基:对照组添加ZnSO4至Zn2+终浓度为1 mmol/L的MS(Murashige和Skoog)培养基,处理组在对照组基础上另加入BABA至终浓度0.2 mmol/L,自然生长组为正常MS培养基。烟草种子经75 %(V/V)C2H5OH消毒3min,20 %(V/V)NaClO振荡处理 22min,灭菌双蒸水清洗6次。每个培养皿点播30粒种子,(28 ± 2) ℃,光照16 h /d条件下培养,16 d后观察种子萌发和幼苗长势。
水培:霍格兰士营养液润湿灭菌营养土表面,将种子均匀播撒,选取生长一致小苗每10株移栽于口径12 cm平皿中(已预先加入同体积霍格兰士营养液),烟草幼苗用珍珠岩悬浮固定,(28 ± 2) ℃,光照16 h /d条件下培养至3、4叶真叶期进行实验,具体如下表:

表1 水培幼苗处理过程Tab.1 Hydroponic condition
分别取鲜叶提RNA和进行相关测试,每实验3次重复。结果部分图示中“fresh”、“0mM”、“0.2mM”表示自然生长、对照组和处理组。
1.3 脯氨酸测定
取新鲜叶片约0.10 g,剪碎后完全浸没在5 mL 3 %磺基水杨酸溶液的试管中,封口后于沸水中提取10min,取出冷却至室温,吸取上清液2 mL(对照加2 mL双蒸水)加2 mL冰醋酸和3 mL 2.5 %的茚三酮显色液于沸水浴上反应40min,冷却后加入5 mL甲苯萃取,静置分层后在520 nm波长下测吸光光度值。脯氨酸标准曲线绘制参照Michael等的方法[9]。
1.4 还原性谷胱甘肽(GSH)测定
测试步骤参照苏州科铭生物技术有限公司GSH测试试剂盒。
1.5 MDA含量测定
取0.2~0.3 g叶片剪碎加入1 mL 10 % TCA和少量石英砂,均浆后再加入1 mL TCA继续研磨,于12000 rad/s离心10min。取上清液2 mL(对照加2 mL10 % TCA),加入2 mL 0.6 % TBA溶液,混匀后于沸水浴反应15min,迅速冷却后离心,取上清液分别于523 nm、600 nm和450 nm测吸光光度值。
1.6 抗氧化酶活性测定
取新鲜叶片约0.20 g,置于预冷研钵中,加入1 mL提取液(50 mmol/L PH 7.0磷酸缓冲液含有0.1 mmol/L EDTANa2和1 % PVP并已灭菌)快速研磨,再加入1 mL提取液冲洗干净研杵后将混合液一并于12000 rad/s离心15min。上清酶液置于4 ℃冷藏备用。
APX测定:反应混合液2.9 mL(50 mmol/L PH 7.0磷酸缓冲液含有0.1 mmol/L EDTANa2、 0.3 mmol/L AsA和0.06 mmol/L H2O2)加0.1 mL 上述酶液(空白加0.1 mL 50 mmol/L pH 7.0磷酸缓冲液)于290 nm波长下记录2min内吸光度变化值。
POD测定:参照Kar M等的方法,略作修改[25]。2.7 mL混合液(0.7 mL 50 mmol/L磷酸缓冲液( pH 5.5)含 0.1 mmol/L EDTANa2,1 mL 2 % H2O2,1 mL 0.05mm 愈创木酚)和0.3 mL酶液(空白用0.3 mL缓冲液替换)。37 ℃水浴15min后立即测试470 nm波长吸光度值。
SOD酶活性参照Beauchamp C等人的方法,略作修改[26]。
可溶性蛋白含量测定参照Lowry等人的方法,略作修改[27]。
CAT、H2O2测定依据南京建成生物试剂公司CAT、H2O2测试试剂盒。
1.7 锌离子含量测定
胁迫处理3 d后幼苗先在0.1 mmol/L EDTANa2溶液中浸泡,再用去离子水冲洗3遍以洗净表面吸附的锌离子,吸干水分后置于85 ℃烘箱24 h,根和叶分别研磨成细粉,采用Optima 7300DV等离子体发射光谱仪测定锌离子含量。
1.8 RT-PCR分析
叶片总RNA提取参照天根公司植物总RNA提取试剂盒说明书。RNA反转录参照TaKaRa反转录试剂盒说明书。内参基因18S rRNA(AJ236016.1),目的基因PR1、PR2、YSL、MTP1A、MTP1B、NtC477。

表2 目的基因引物序列Tab.2 Primer sequences of the target genes
1.9 数据分析
实验数据表示为平均值 ± 偏差,数据分析采用单因素方差分析,置信区间P<0.05,统计分析软件使用Origin 9.0。
2 结果与讨论
2.1 高锌胁迫下 BABA处理对烟草幼苗生长状况的影响
如图1A所示,自然生长条件下,幼苗根和叶生长良好。而在高锌胁迫下烟草幼苗出现生长不良,叶片变小且稍有失绿、根长变短根茎变细、根多呈现弯曲状(图1B),当高锌培养基中添加0.2 mmol/L BABA后改善了幼苗生长不良状况,叶片变大且根长增加(图1C)。根长(图1D)和鲜重(图1E)表明添加0.2 mmol/L BABA后幼苗根长和鲜重都有显著增加,相比对照组分别提高了16 %和28 %。这些结果说明0.2 mmol/L BABA能够在一定程度上增强烟草幼苗抵御高锌胁迫的能力。
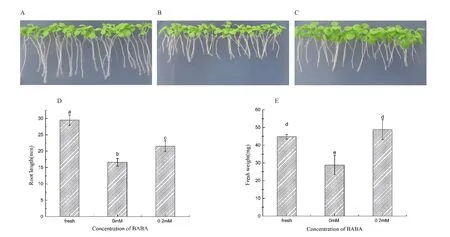
图1 自然生长、对照组和处理组烟草幼苗长势(A 、B和C)、根长(D)和鲜重(E)差异Fig.1 Tobacco seedling growth( A,B and C), root length (D) and fresh weight (E) in the natural, the control and the BABA groups
2.2 高锌胁迫下BABA处理对烟草生理生化指标影响
2.2.1 脯氨酸、谷胱甘肽、可溶性蛋白和丙二醛含量
由图2A可知0.2 mmol/L BABA处理幼苗叶片脯氨酸含量显著提高,比对照组增加了230 %。据报道,脯氨酸可以作为分子伴侣保护蛋白的完整性并增加许多酶的活性、参与减轻细胞质酸中毒和维持辅酶NADP/NADPH比率,从而维持细胞氧化还原循环[28-29]。结果表明BABA能够通过促使烟草幼苗产生脯氨酸来缓解高锌胁迫,这同Ramakrishna等人在研究24-表油菜素内酯对锌的缓解效果中脯氨酸变化趋势基本一致[30]。
谷胱甘肽(GSH)在金属解毒过程中具有金属螯合剂、细胞抗氧化剂和作为活性氧(ROS)信号分子三重作用[30-31]。在图2B中,0.2 mmol/L BABA处理幼苗叶片中GSH含量比对照组增加约36.7 %。一些研究表明,谷胱甘肽通过其具有高金属亲和力的巯基与金属离子发生螯合作用,故低聚物的谷胱甘肽在植物螯合肽合成酶催化下可合成植物螯合肽(PCs),高含量的PCs对金属锌离子的耐受起到重要作用[3,32]。GSH还可以作为细胞氧化状态的调控分子,可以将氧化性强的分子还原,本身能快速与另一个谷胱甘肽结合成为氧化态GSSG,其含量高低可表明细胞抵御氧化胁迫的能力[6]。图2B结果可能说明了BABA调控GSH含量增加一方面来提高烟草幼苗抵御氧化胁迫能力,另一方面络合锌离子,从而缓解高锌胁迫毒害。
蛋白质在植物体内承担着重要的代谢和生理生化功能,如参与活细胞反应中的各种酶、结构蛋白、信号传导物质、离子通道和多种转录调控因子等。如图2C,0.2 mmol/L BABA处理后幼苗叶片蛋白质含量比对照组增加约21 %。研究表明,当植物遭受重金属胁迫时,蛋白中的组氨酸、络氨酸、精氨酸、色氨酸和蛋氨酸等敏感氨基酸最易发生羰基化结构改变,特殊位点氨基酸也会被修改、肽链破碎、交叉聚合和蛋白质水解[33],其中蛋氨酸被氧化为亚砜的防御反应被认为是细胞抵御氧化应激的最后措施[34]。结果表明BABA能够通过促使烟草幼苗产生可溶性蛋白来缓解高锌胁迫。
锌胁迫下引起膜脂过氧化反应,脂肪氧合酶(LOX)使不饱和脂肪酸间发生各种氧化连锁反应,丙二醛(MDA)是脂肪酸氧化的最终分解产物[35]。高活性的脂肪氧合酶会进一步氧化分解质膜结构,造成细胞膜裂解,离子渗漏形成脂质或核苷酸过氧化物,最终导致细胞死亡。如图2D显示,0.2 mmol/L BABA处理将MDA含量下调到几乎正常水平,比对照组下降16.7 %,减少了锌离子对烟叶的氧化损伤。
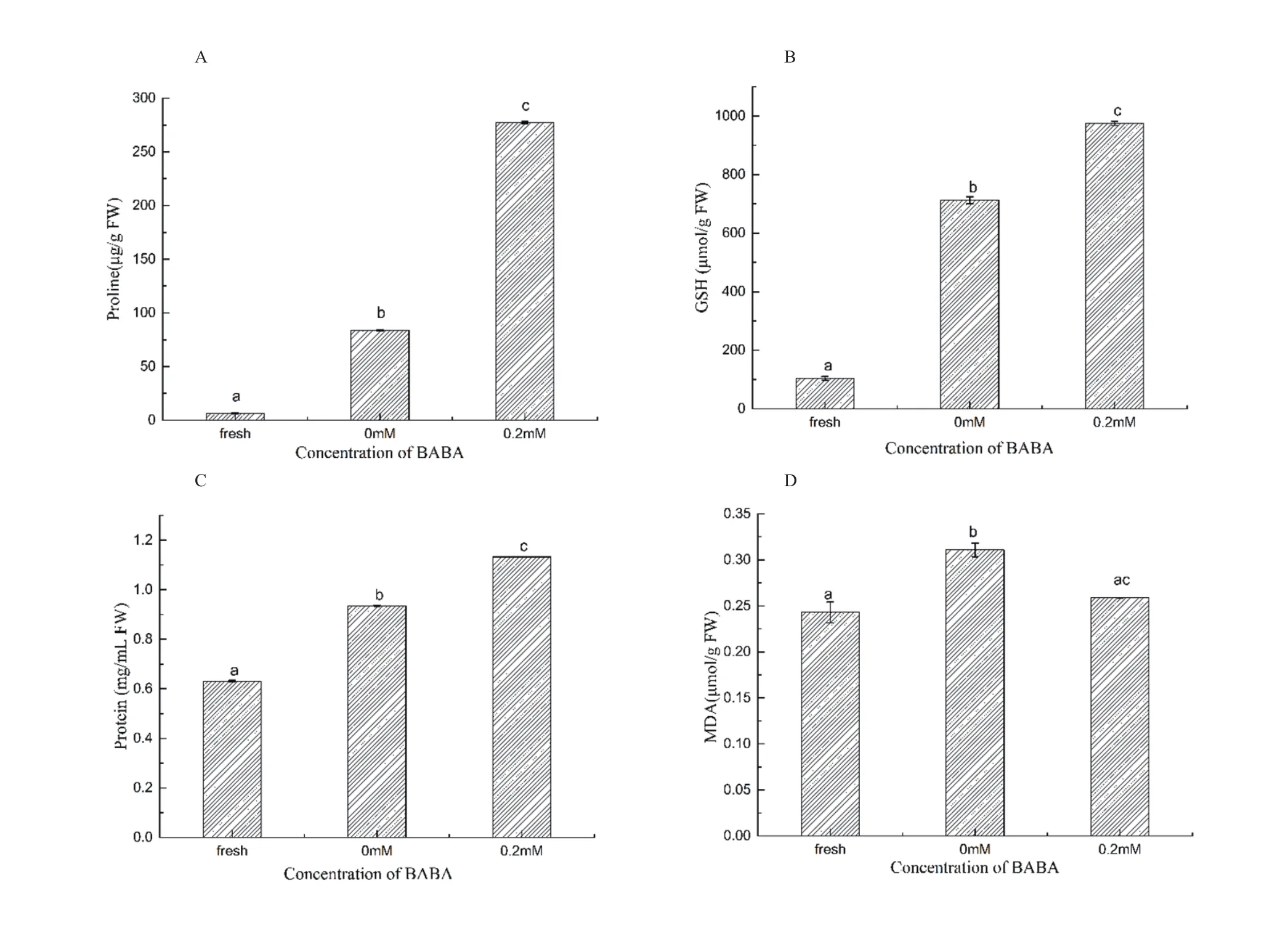
图2 自然生长、对照组和处理组烟草幼苗叶片中谷胱甘肽、脯氨酸、可溶性蛋白和丙二醛含量差异Fig. 2 Contents of proline(A) ,GSH(B) ,soluble protein(C) and MDA(D) in the natural, the control and the BABA groups
2.2.2 抗氧化酶和H2O2含量
重金属离子常诱导活性氧(ROS)爆发产生次级毒害,如超氧化物离子(O2-)、羟基自由基 (OH·)、过氧化氢(H2O2)、单线态氧气(1O2)等强破坏性分子,可氧化损害细胞内各种化合物如核酸、蛋白质、糖类和脂质等,严重时引起细胞死亡[36]。ROS还能诱导DNA的损伤、突变和其他致命基因的激活。为抵制细胞氧化胁迫,植物细胞拥有一套全面的抗氧化系统来清除活性氧。主要是包括一些抗氧化酶和抗氧化物分子。抗氧化酶系统如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸盐过氧化物酶(APX)等[37]。SOD作为细胞内唯一能够清除超氧化物离子(O2-)的蛋白酶,对于减轻超氧化物离子对细胞毒害作用重大。CAT、APX和POD广泛存在于植物的各个组织器官中,对清除植物体过氧化氢毒害作用明显。如图3A-D所示,0.2 mmol/L BABA处理后SOD活性同对照组相比增加8 %,POD、APX和CAT都有不同程度下降,分别降低10.7 %、9 %、50.3 %。这一酶活测试结果同Zhang等人在研究BABA对采摘后芒果抗炭疽病相关酶活变化类似[38]。虽然POD、APX和CAT都有所下降,但SOD酶活上升,机体就可以将过多氧化性极强的超氧化物离子转化为H2O2减轻氧化胁迫。且Rizhsky等人发现拟南芥CAT和APX双突变体相比单突变体和野生型都要有更强的抵御外界胁迫能力[39]。这些都说明了CAT和APX对机体作用的复杂性。
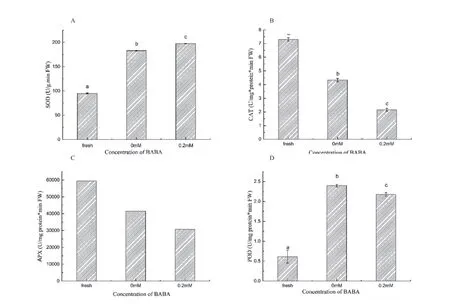
图3 自然生长、对照组和处理组烟草叶片中SOD、CAT 、APX及POD酶活性差异Fig. 3 Activities of SOD(A) ,CAT(B) , APX(C) and POD(D) in the natural, the control and the BABA groups
H2O2是植物有氧代谢的副产物,可以通过水蛋白通道和扩散两种方式自由进出细胞间,使得其适合作为信号网络传递的第二信使在许多生化过程中起重要调节作用。此外,Morina等从细胞壁中观察到过量的锌能诱导生产H·和CH3·等自由基和质外体叶片中H2O2的累积[40]。如图4所示,锌胁迫后,H2O2含量增加,0.2 mmol/L BABA处理后叶片H2O2含量相比对照组平均增加了约12.5 %。H2O2的产生和清除紧密调节着细胞的氧化还原平衡。H2O2可以和蛋白巯基结合调节信号传导中许多物质的活性,例如蛋白激酶、蛋白质磷酸化或转录因子,高含量的H2O2还可以激活Ca2+、ABA、乙烯等内源性通道,诱导下游调节基因的表达,从而激活机体抵御多种生物和非生物胁迫耐性[41-43]。
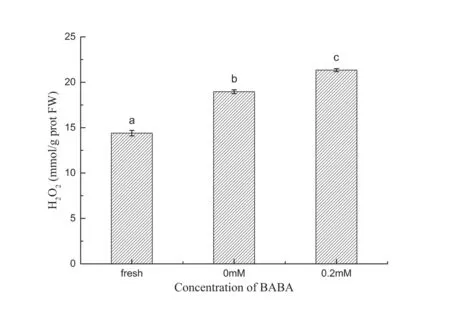
图4 自然生长、对照组和处理组烟草叶片中H2O2含量差异Fig. 4 Contents of H2O2 in the natural, the control and the BABA groups
2.3 幼苗根和叶中锌离子含量
从图5离子含量结果得出,锌胁迫下烟草幼苗根和叶中的锌离子含量均大量增加。0.2 mmol/L BABA处理后叶片中锌离子含量下降了23 %(图5A),然而BABA处理对幼苗根部锌离子含量几乎没有影响(图5B)。结果表明高锌胁迫下BABA通过降低锌离子在幼苗体内的向上运输,减少锌离子对地上组织的损害。
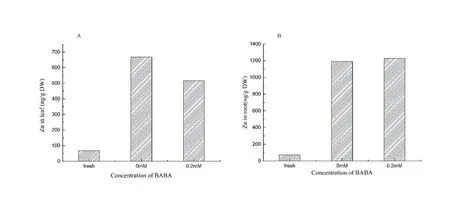
图5 自然生长、对照组和处理组烟草幼苗叶和根中锌离子含量差异Fig. 5 Contents of Zn in the tobacco leaves(A) and roots(B) in the natural, the control and the BABA groups
2.4 相关基因的转录
2.4.1 PR基因表达
当植物细胞遭受外来病原物侵害时,能否检测到病程相关蛋白基因(PR)表达常被看做是细胞抵御外来防御反应的重要标志。如图6示,烟草幼苗受高锌胁迫后,无论BABA是否处理,PR基因都大量表达;但BABA处理过叶片中PR1和PR2基因表达量都要显著强于对照组,且PR2表达量要稍强于PR1。一些研究表明,从病源侵害到系统获得抗性过程中,PR1和PR2抗病蛋白发挥关键作用,一般认为PR2编码合成β-1,3-葡聚糖酶和几丁质酶来降解病菌的细胞壁且β-1,3-葡聚糖酶还能释放寡聚糖来增加细胞的抵御能力[44]。结果表明BABA通过诱导PR基因表达上调使细胞处于更强的防御体系中。
2.4.2 锌离子转运和耐受蛋白相关基因表达
当植物遭受锌胁迫时,植物细胞膜上的受体蛋白最先接受到胁迫信号,然后将信号向下游传导,产生次级信使再经过一系列的信号传导,最终引起功能转运蛋白或者耐受蛋白基因的高表达。这些基因的表达产物使植物能够适应高锌环境。许多研究证实,锌离子最有可能通过ZIP转运体和TRT转运体透过质膜(ZRT-IRT蛋白质)以主动运输方式进入细胞[45]。一旦大量的Zn2+进入胞质,必定引起细胞内pH、离子浓度及相关酶活改变。
由图6得,锌胁迫下对照组幼苗的MTP1A、MTP1B、NtC477及NtYSL表达量同自然生长几乎没有差异,而0.2 mmol/L BABA处理幼苗上述基因表达量均显著增加。烟酰胺(NA)是一类非蛋白氨基酸,在体外可对一系列过渡金属如Cu、Ni、Co、Zn、Fe、Mn显示出很高的亲和性。金属Zn-NA复合物可以通过YSL蛋白质载体输出细胞,维持Zn2+在体内的平衡[46]。金属耐受蛋白NtMTP(metal tolerance protein)和NtC477是位于液泡膜上富含组氨酸结构的载体蛋白,可以将金属离子区隔到液泡内减少对胞质毒害[47]。综上所述BABA通过调节相关基因的表达产物来络合或区隔化Zn2+减少Zn2+对烟草幼苗细胞质的毒害作用。

图6 自然生长、对照组和处理组叶片中PR1、PR2、MTP1A、MTP1B、NTC477和YSL相关基因表达差异Fig. 6 Differences of the gene expressions of PR1,PR2,MTP1A,MTP1B, NTC477 and YSL in the natural, the control and the BABA groups
3 结论
研究发现受高锌胁迫烟草幼苗生长抑制、叶片变小、根长变短,添加0.2 mmol/L BABA后改善了幼苗生长不良状况。分析认为BABA诱导烟草幼苗抵御高锌胁迫,一方面通过增加烟株脯氨酸、还原性谷胱甘肽、可溶性蛋白含量,另一方面APX、POD、CAT酶活性略有下降而SOD酶活性增加,最终使信号分子H2O2含量上升,且使叶片中Zn2+浓度降低减轻毒害。此外BABA提高烟草耐锌胁迫还与烟 株 中 PR1、PR2、NtMTP1A、NtMTP1B、NtC477及NtYSL基因表达上调相关。综上表明0.2 mmol/LBABA缓解烟草锌胁迫是通过激发植物体抗氧化系统、抑制Zn2+向上运输以及抗病蛋白和离子转运蛋白相关基因表达上调的综合结果。
[1] Broadley M R, White P J, Hammond J P, et al. Zinc in plants [J].New Phytologist, 2007, 173(4): 677-702.
[2]Hänsch R, Mendel R R. Physiological functions of mineral micronutrients (Cu, Zn, Mn, Fe, Ni, Mo, B, Cl) [J]. Current opinion in plant biology, 2009, 12(3): 259-266.
[3]Tennstedt P, Peisker D, Böttcher C, et al. Phytochelatin synthesis is essential for the detoxi fi cation of excess zinc and contributes signi fi cantly to the accumulation of zinc [J]. Plant Physiology, 2009, 149(2): 938-948.
[4]Yang Y, Sun C, Yao Y, et al. Growth and physiological responses of grape (Vitis vinifera “Combier”) to excess zinc[J]. Acta Physiologiae Plantarum, 2011, 33(4): 1483-1491.
[5]Appenroth K-J. What are “heavy metals” in Plant Sciences?[J]. Acta Physiologiae Plantarum, 2010, 32(4): 615-619.
[6]Ramakrishna B, Rao S S R. 24-Epibrassinolide maintains elevated redox state of AsA and GSH in radish (Raphanus sativus L.) seedlings under zinc stress [J]. Acta Physiologiae Plantarum, 2013, 35(4): 1291-1302.
[7]Buyuk I, Aydin S S, Altunkaynak E, et al. Expression analysis of catalase and superoxide dismutase genes in Lycopersicum esculentum L. under zinc stress [J]. Journal of Biotechnology,2012, 161:31.
[8]Jain R, Srivastava S, Solomon S, et al. Impact of excess zinc on growth parameters, cell division, nutrient accumulation,photosynthetic pigments and oxidative stress of sugarcane(Saccharum spp.) [J]. Acta Physiologiae Plantarum, 2010,32(5): 979-986.
[9]Michael P I, Krishnaswamy M. The effect of zinc stress combined with high irradiance stress on membrane damage and antioxidative response in bean seedlings [J]. Environmental and Experimental Botany, 2011, 74:171-177.
[10]杜锁军, 戴艳, 谢东俊, 等. 土壤 Zn 污染及其治理措施评述 [J]. 污染防治技术, 2009, 22(3): 87-90.D Sjun, D Yan, Xie Dongjun, et al. The Introduction of Zn Pollution In Soil and Its Control Measures [J]. Pollution Control Technology, 2009, 22(3): 87-90.(in Chinese)
[11]张丽红, 徐慧珍, 于青春, 等. 河北清苑县及周边农田土壤及农作物中重金属污染状况与分析评价 [J]. 农业环境科学学报, 2010, 29(11): 2139-2146.Zhang Lihong, Xu Huizhen, Yu Qingchun, et al. The Investigation and Evaluation of the Heavy Metal Pollution in Farmland Soil and Crop in the Qingyuan of Hebei, China [J].Journal of Agro-Environment Science, 2010, 29(11): 2139-2146. (in Chinese)
[12]李惠英, 陈素英, 王豁. 铜, 锌对土壤—植物系统的生态效应及临界含量 [J]. 农村生态环境, 1994, 10(2): 22-24.Li Huiying, Chen Suying, Wang Huo. Study on the fates of Cu and Zn in soil-plant system as well as their critical contents[J].Rural Eco-Environment, 1994, 10(2): 22-24. (in Chinese)
[13]景宁宁, 苏文华, 张光飞, 等. 重金属锌污染土地大麻种植试验 [J]. 安徽农业科学, 2013, 41(5): 1994-1996.Jing Ningning, Su Wenhua, Zhang Guangfei, et al. Cannabis sativa Cultivation Experiments on Heavy Metal Zinc Contaminated Land[J]. Journal of Anhui Agri.Sci. 2013, 41(5):1994-1996. (in Chinese)
[14]杨红飞, 王友保, 李建龙. 铜, 锌污染对水稻土中油菜(Brassica chinensis L.) 生长的影响及累积效应研究 [J]. 生态环境学报, 2011, 20(10): 1470-1477.Y Hongfei, Wang Youbao, Li Jianlong. Impacts of Cu and Zn pollution on rape(Brassica chinensis L.) growth and its accumulation effect of heavy metals in paddy soil [J]. Ecology and Environmental Sciences, 2011, 20(10): 1470-1477. (in Chinese)
[15]艾绥龙, 马英明. 水培条件下烟草锌临界值探讨 [J]. 陕西农业科学, 1999, 1: 13-15.Ai Neilong, Ma Yingming. The study of critical value of zinc in tobacco under hydroponic conditions[J]. Shaanxi Journal of Agricultural Sciences, 1999, 1: 13-15. (in Chinese)
[16]李义强. 影响烟叶质量安全的外源因素及防控对策 [J]. 中国烟草学报, 2013, 19(2): 85-89.Li Yiqiang. External factors affecting safety of leaf tobacco quality and relevant counter measures [J]. Acta Tabacaria Sinica, 2013, 19(2): 85-89. (in Chinese)
[17]胡钟胜, 章钢娅, 王广志, 等. 改良剂对烟草吸收土壤中镉铅影响的研究 [J]. 土壤学报, 2006, 43(2): 233-239.Hu Zhongsheng, Zhang Gangya, Wang Guangzhi, et al.effects of soil amendments on cadmium and lead contents in tobacco[J]. Acta Pedologica Sinica, 2006, 43(2): 233-239. (in Chinese)
[18]Hassan M A E, Abo-Elyousr K A M. Activation of tomato plant defence responses against bacterial wilt caused by Ralstonia solanacearum using DL-3-aminobutyric acid (BABA) [J].European Journal of Plant Pathology, 2013, 136(1): 145-157.
[19]Kim Y C, Kim Y H, Lee Y H, et al. beta-Aminon-butyric Acid Regulates Seedling Growth and Disease Resistance of Kimchi Cabbage [J]. Plant Pathology Journal, 2013, 29(3): 305-316.
[20]Zimmerli L, Hou B H, Tsai C H, et al. The xenobiotic betaaminobutyric acid enhances Arabidopsis thermotolerance [J].Plant J, 2008, 53(1): 144-156.
[21]Jakab G, Ton J, Flors V, et al. Enhancing Arabidopsis salt and drought stress tolerance by chemical priming for its abscisic acid responses [J]. Plant Physiology, 2005, 139(1): 267-274.
[22]Cao Shuqing, Jiang Li, Yuan Huaibo, et al. beta-Amino-butyric acid protects Arabidopsis against low potassium stress [J]. Acta Physiologiae Plantarum, 2008, 30(3): 309-314.
[23]Du Yanlei, Wang Zhenyu, Fan Jingwei, et al. β-Aminobutyric acid increases abscisic acid accumulation and desiccation tolerance and decreases water use but fails to improve grain yield in two spring wheat cultivars under soil drying [J].Journal of Experimental Botany, 2012, 63(13): 4849-4860.
[24]Hossain Z, Makino T, Komatsu S. Proteomic study of betaaminobutyric acid mediated cadmium stress alleviation in soybean [J]. J Proteomics, 2012, 75(13): 4151-4164.
[25]Kar M, Mishra D. Catalase, peroxidase and polyphenol oxidase activities during rice leaf senescence [J]. Plant Physiology,1976, 57:315-319.
[26]Beauchamp C, Fridovich I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels [J].Analytical biochemistry, 1971, 44(1): 276-287.
[27]Lowry O H, Rosebrough N J, Farr A L, et al. Protein measurement with the Folin phenol reagent [J]. The Journal of biological chemistry, 1951, 193(1): 265-275.
[28]Belkhodja R, Morales F, Abadia A, et al. Chlorophyll fl uorescence as a possible tool for salinity tolerance screening in barley (Hordeum vulgare L.) [J]. Plant Physiology, 1994,104(2): 667-673.
[29]Gueta-Dahan Y, Yaniv Z, Zilinskas B A, et al. Salt and oxidative stress: similar and specific responses and their relation to salt tolerance in citrus [J]. Planta, 1997, 203(4): 460-469.
[30]Seth C, Remans T, Keunen E, et al. Phytoextraction of toxic metals: a central role for glutathione [J]. Plant, cell amp;environment, 2012, 35(2): 334-346.
[31]Ramakrishna B, Rao S S R. 24-Epibrassinolide alleviated zinc-induced oxidative stress in radish (Raphanus sativus L.)seedlings by enhancing antioxidative system [J]. Plant Growth Regulation, 2012, 68(2): 249-259.
[32]Lin Y F, Aarts M G M. The molecular mechanism of zinc and cadmium stress response in plants [J]. Cellular and Molecular Life Sciences, 2012, 69(19): 3187-3206.
[33]Gossett D R, Millhollon E P, Lucas M. Antioxidant response to NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton[J]. Crop Science, 1994, 34(3): 706-714.
[34]Foyer C H, Noctor G. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context [J]. Plant, Cell amp; Environment, 2005,28(8): 1056-1071.
[35]Apel K, Hirt H. Reactive oxygen species: metabolism,oxidative stress, and signal transduction [J]. Annu Rev Plant Biol, 2004, 55:373-399.
[36]Gadjev I, Stone J M, Gechev T S. Programmed cell death in plants: new insights into redox regulation and the role of hydrogen peroxide [J]. International review of cell and molecular biology, 2008, 270:87-144.
[37]Matilla-Vázquez M, Matilla A. Role of H2O2 as signaling molecule in plants [M]. Environmental adaptations and stress tolerance of plants in the era of climate change. Springer. 2012:361-80.
[38]Zhang Zhengke, Yang Dongping, Yang Bo, et al. beta-Aminobutyric acid induces resistance of mango fruit to postharvest anthracnose caused by Colletotrichum gloeosporioides and enhances activity of fruit defense mechanisms [J]. Scientia Horticulturae, 2013, 160:78-84.
[39]Rizhsky L, Hallak-Herr E, Van Breusegem F, et al. Double antisense plants lacking ascorbate peroxidase and catalase are less sensitive to oxidative stress than single antisense plants lacking ascorbate peroxidase or catalase [J]. The Plant Journal,2002, 32(3): 329-342.
[40]Morina F, Jovanovic L, Mojovic M, et al. Zinc-induced oxidative stress in Verbascum thapsus is caused by an accumulation of reactive oxygen species and quinhydrone in the cell wall [J]. Physiologia plantarum, 2010, 140(3): 209-224.
[41]Xing Yu, Jia Wensuo, Zhang Jianhua. AtMKK1 mediates ABA-induced CAT1 expression and H2O2 production via AtMPK6-coupled signaling in Arabidopsis [J]. The Plant Journal, 2008, 54(3): 440-451.
[42]Jammes F, Song C, Shin D, et al. MAP kinases MPK9 and MPK12 are preferentially expressed in guard cells and positively regulate ROS-mediated ABA signaling [J].Proceedings of the National Academy of Sciences, 2009,106(48): 20520-20525.
[43]Xu Juan, Li Yuan, Wang Ying, et al. Activation of MAPK kinase 9 induces ethylene and camalexin biosynthesis and enhances sensitivity to salt stress in Arabidopsis [J]. Journal of Biological Chemistry, 2008, 283(40): 26996-27006.
[44]Dubreuil-Maurizi C, Trouvelot S, Frettinger P, et al.β-aminobutyric acid primes an NADPH oxidase-dependent reactive oxygen species production during grapevine-triggered immunity [J]. Molecular plant-microbe interactions, 2010,23(8): 1012-1021.
[45]Gainza-Cortés F, Pérez-Dïaz R, Pérez-Castro R, et al.Characterization of a putative grapevine Zn transporter,VvZIP3, suggests its involvement in early reproductive development in Vitis vinifera L [J]. BMC plant biology, 2012,12(1): 111.
[46]Trampczynska A, Küpper H, Meyer-Klaucke W, et al.Nicotianamine forms complexes with Zn (II) in vivo [J].Metallomics, 2010, 2(1): 57-66.
[47]Shingu Y, Kudo T, Ohsato S, et al. Characterization of genes encoding metal tolerance proteins isolated from Nicotiana glauca and Nicotiana tabacum [J]. Biochemical and biophysical research communications, 2005, 331(2): 675-680.
A preliminary research on BABA induced resistance to high Zn2+stress of tobacco
LU Xuelian1.2,GU Houwu3,CHEN Zhu1,SHAN Dandan1,WANG Wenjie4,HE Kuanxin3,CHEN Xueping1
1 Department of Chemistry, University of Science and Technology of China, Hefei 230026, China;
2 Suzhou Institute for Advanced Study, University of Science and Technology of China, Suzhou 215123, China;
3 Jiangxi Provincial Tobacco Company, Nanchang 330025, China;
4 Anhui Chizhou Municipal Tobacco Company, Chizhou 247100, China
Excess amount of Zinc is toxic and has negative effects on inhibition of growth, root development and may cause leaf chlorosis.The role of BABA in protecting tobacco seedling from high Zn2+stress was studied and its working mechanism was explored through measuring antioxidative molecular content, antioxidative enzyme activities, concentration of Zn2+in leaf and root and related gene expression. Results showed that 0.2 mmol/L BABA protected tobacco seedling from high-Zn2+stress via increasing content of proline,GSH, total soluble protein and keeping MDA content at nearly normal level. Activities of CAT, POD and APX were reduced while SOD activity was increased, which raised signal molecule H2O2content. BABA lowered Zn2+concentration in leaf, but no obvious difference was found in root under high-Zn2+stress by ICP-7300DV. In addition, gene expression indicated that the transcript level of PR1, PR2,NtMTP1A, NtMTP1B, NtC477 and NtYSL was higher than that of BABA untreated samples. It was suggested that the 0.2 mmol/L BABA was bene fi cial in alleviating high-Zn2+stress in tobacco seedling by stimulating antioxidant system, restricting Zn2+upper transportation and over expression genes of related ion transporters and pathogenesis-related proteins.
β-aminobutyric acid; tobacco; high-Zn2+stress
陆雪莲,顾厚武,陈祝,等. BABA诱导烟草抵御高锌胁迫的初步研究[J]. 中国烟草学报,2015,21(6)
江西省烟草公司“提高烟草可能性新型调节物质研制及应用”(赣烟2011.98)和池州市烟草公司“生物绿肥在生产中应用研究”(池烟2011.11.18号)
陆雪莲(1987—),硕士,主要研究方向:植物抗逆性,Email:sa11226575@mail.ustc.edu.cn
陈学平(1956—),博士,教授,主要研究方向:植物生物技术及遗传改良,Email: chenxp08@ustc.edu.cn
2014-02-22
:LU Xuelian,GU Houwu,CHEN Zhu, et al. A preliminary research on BABA induced resistance to high Zn2+stress of tobacco[J]. Acta Tabacaria Sinica, 2015,21(6)
