烟草NtHCT基因对次生代谢物质绿原酸和类黄酮合成的影响
2015-11-23李洋李明岳玮丁新华储昭辉
李洋,李明,岳玮,丁新华,储昭辉
1作物生物学国家重点实验室,山东省农业微生物重点实验室,山东农业大学, 泰安岱宗大街61号 271018;
2 高密市环保局,山东省高密市人民大街(西)1758 号 261500
烟草NtHCT基因对次生代谢物质绿原酸和类黄酮合成的影响
李洋1,李明1,岳玮2,丁新华1,储昭辉1
1作物生物学国家重点实验室,山东省农业微生物重点实验室,山东农业大学, 泰安岱宗大街61号 271018;
2 高密市环保局,山东省高密市人民大街(西)1758 号 261500
为验证NtHCT是否参与烟草类黄酮的合成,构建pCXSN::NtHCT超量表达载体,利用农杆菌转化法将NtHCT基因转入野生型烟草三生烟,通过HPLC (High Performance Liquid Chromatography高效液相色谱)检测转基因烟草中绿原酸和类黄酮物质的含量变化。结果表明,转基因烟草叶片中绿原酸的含量最高比野生型对照提高了6.3倍,类黄酮成份芦丁和山奈酚芸香苷分别提高了41.6和13.6倍,而生长表型未见明显差异。从而证明NtHCT基因不仅参与调控绿原酸的合成,也正向调控了类黄酮的合成。
烟草NtHCT基因;绿原酸;类黄酮;烟草
BAHD酰基转移酶家族是对植物生长发育过程中存在的次生代谢活动进行酰基化修饰的一类蛋白[1]。莽草酸/奎宁酸羟基肉桂酰转移酶(shikimate/ quinate hydroxycinnamoyl transferase, HCT) 属于BAHD酰基转移酶家族,催化香豆酰辅酶A(Coenzyme A,CoA)生成香豆酰莽草酸/奎宁酸,经过其它酶的羟化作用后,HCT再一次对其产物进行酰基转移,形成咖啡酰CoA,继而在一些甲基转移酶的作用下形成芥子醇,最后形成了S型木质素[2,3]。
同时,HCT也参与了绿原酸的合成。已经发现在缺失羟基肉桂酰辅酶A奎宁酸转移酶(hydroxycinnamoyl CoA quinate transferase, HQT)的烟草中,通过HCT基因仍可以形成绿原酸[4,5]。通过VIGS沉默掉NbHCT基因之后,本生烟草茎中绿原酸含量上升,对叶片中绿原酸含量下降[5]。在拟南芥中抑制AtHCT基因表达发现伴随木质素积累减少同时,类黄酮积累量升高[6]。但在烟草中超量表达NtHCT会对绿原酸、类黄酮合成的影响尚不清楚。
绿原酸及类黄酮类物质对人类抗衰老,防止心脑血管疾病的发生都具有重要的作用[7-9],分析NtHCT基因对烟草次生代谢物质的影响,获得富含绿原酸及类黄酮的转基因烟草,不仅是研究烟草次生代谢机制的必要材料,还为研究富含营养物质的烟叶的应用做基础铺垫。本研究对烟草NtHCT在烟草次生代谢中的作用做了初步探讨。
1 材料与方法
1.1 材料
三生烟(Nicotiana tabacum cv. samsun),植株培养在25 ℃, 16h/8h光暗周期,相对湿度为(70±10)%的培养间中。烟草在营养钵中培养至8叶期,取中部叶片进行检测。
大肠杆菌Escherichia coli DH5ɑ,农杆菌LBA4404和真核表达载体pCXSN 由本实验室保存提供。LAmp-Taq 酶、反转录等试剂及试剂盒等均购自康为生物公司,限制性内切酶和T4DNA连接酶等均购自NEB公司,DNA凝胶回收试剂盒购自OMEGA Biotek公司。引物合成和DNA测序分别由上海生工及华大基因科技股份有限公司完成。
1.2 方法
1.2.1 NtHCT的克隆和表达载体的构建
采用TRI Reagent (Sigma) 提取烟草叶片总RNA,以其为模板进行第一链NtHCT cDNA合成。具体操作如下:1.5 μg上述得到的总RNA用DNaseI(NEB,美国)37 ℃处理15min,75 ℃放置10min,去除基因组DNA。在上述体系中加入1.5 μL oligo(dT)15寡聚引物,70 ℃反应10min后冰上急速冷却2min。加入1.5 μL dNTP (10 μM), 0.5 μL 反转录酶 M-MLV (Invitrogen,USA), 5×M-MLV Buffer,DEPC水补充至20 μL体系。42 ℃条件下反应1 h,70 ℃处理15min得到cDNA第一链产物。
以上述反应得到的cDNA为模板,根据已有的烟草NtHCT基因序列(GeneBank AJ507825)和EST序列特征,设计NtHCT基因的引物NtHCT F1:5'-ATTTCAGGGAATTGAACCG-3'和NtHCT R1:5'-TAAACCCCAAAAGAAGC AG-3'RT-PCR 采用LAmp高保真DNA聚合酶(康为,北京)进行扩增,反应体系50 μL:20-50 ng模板,10×PCR缓冲液,4 μL dNTPs (2.5mm), 1 μL引物(10 μM), 1U DNA聚合酶。 PCR反应条件: 94 ℃预变性3min;循环数 35, 94 ℃变性 30s, 58 ℃复性 30 s,72 ℃延伸90 s (30-60 s/kb 速度);72 ℃延伸10min。将表达载体pCXSN通过Xcm I进行酶切,并对酶切后的载体进行酶的灭活和纯化,将NtHCT基因连接到纯化后的载体上,形成烟草转化载体 pCXSN:: NtHCT。将烟草转化载体转入大肠杆菌DH5ɑ,挑白斑扩繁后用菌液PCR的方法进行初筛,挑选阳性克隆送出测序。经测序无误后,转化农杆菌LBA4404。
1.2.2 农杆菌介导的烟草转化
选烟草叶片作为外植体采用农杆菌(LBA4404)介导的叶盘转化法[10],将已构载体pCSXN::NtHCT转化三生烟草受体材料。待生根培养基中转基因烟草根系发育良好后,移栽到土壤中。采用CTAB[11]法提取转基因和非转基因植株叶片基因组DNA,以35S启动子内部序列设计的引物 35SF:5’ -ACGCACAATCCCACTATCCTT-3’和基因序列内部设计的引物NtHCTR1: 5’-TAAACCCCAAAAGAAGCAG-3’ 组 合 进行 PCR 阳性检测。PCR产物经1%琼脂糖凝胶电泳分析扩增出1300 bp片段,为阳性植株。
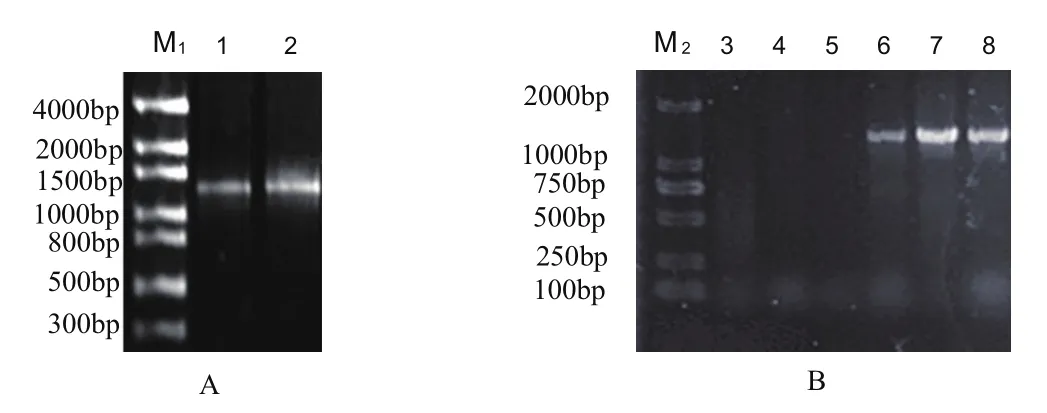
图1 NtHCT 扩增电泳及菌落检测图Fig. 1 Cloning of NtHCT and NtHCT veri fi cation by colony PCR
1.2.3 类黄酮提取和HPLC测定
取转基因烟草叶片用液氮研磨至粉末状,各取0.3 g,3 mL 100 %色谱甲醇-20 ℃萃取2 h,每15min振荡一次使充分萃取。4 ℃、10000 rpm离心2min,上清经0.22 μM微孔滤膜过滤至样品瓶,取10 μl过滤液用于HPLC分析,按照Luo[11]等设置HPLC条件,标准品为芦丁(Sigma),山奈酚芸香苷(购自Extrasynthese)和绿原酸(购自Sigma)。
2 结果
2.1 NtHCT基因的克隆
按照三生烟草中NtHCT的已知序列设计引物,以三生烟草叶片cDNA 为模板,通过PCR获得长为1307 bp的清晰目标序列(图1A),切胶回收后连接已经用Xcm I酶切后的pCXSN载体,进行大肠杆菌DH5ɑ转化,挑白斑扩增繁殖过夜后用菌液PCR的方法进行初筛,并挑选3个阳性克隆送出测序。
将测序结果与目标序列NtHCT(GeneBank AJ507825)比对后发现,二者序列完全一致,从而确认克隆成功三生烟草中NtHCT的完整基因序列。
2.2 NtHCT基因表达载体的构建和转化
将转化成功的大肠杆菌阳性克隆提取质粒,通过两端引物35S F和NtHCTR1进行PCR阳性验证(图1B),证明含有NtHCT的真核表达载体构建正确,提取重组质粒,转入农杆菌LAB4404。通过叶盘转化法,获得转NtHCT转基因烟草。PCR检测转基因烟草阳性(图2)。在获得的12棵转基因材料中,有10棵扩增到了目标基因序列,确认为阳性转基因植株,转化率为83.3%。在生育期内,转基因烟草在表型上与野生型没有明显差异(图3)。

图2 NtHCT T0 代值株阳性检测电泳图Fig. 2 Positive detection of transgenic tobacco in T0 generation

图3 T1代三个不同株系转基因烟草与野生烟草生长表型Fig. 3 Phenotype between three different lines of NtHCT transgenic tobacco in T1 generation and wild-type tobacco.
2.2 转基因烟草叶片中的类黄酮含量检测
待烟草叶片长到8叶期,参照Luo[12]等用HPLC检测类黄酮物质含量的方法,对部分转基因和非转基因烟草叶片进行了含量检测。结果显示,转NtHCT基因的烟草叶片中绿原酸、芦丁、山奈酚芸香苷的含量都有不同程度明显的提高(图4, 表1)。

图4 转基因烟草叶片T0代中绿原酸及类黄酮含量HPLC检测Fig. 4 HPLC analysis CGA and fl avonoid contents of NtHCT transgenic tobacco leaves in T0 generation and control
其中,转NtHCT基因的烟草叶片中绿原酸的含量提高了2.0-6.3倍,最高含量达到了1791.5 μg/g FW。芦丁含量和山奈酚芸香苷含量最高分别达到了524.6和159.2 μg/g FW,分别是相同条件下对照三生烟草叶片中含量的41.6倍和13.6倍。
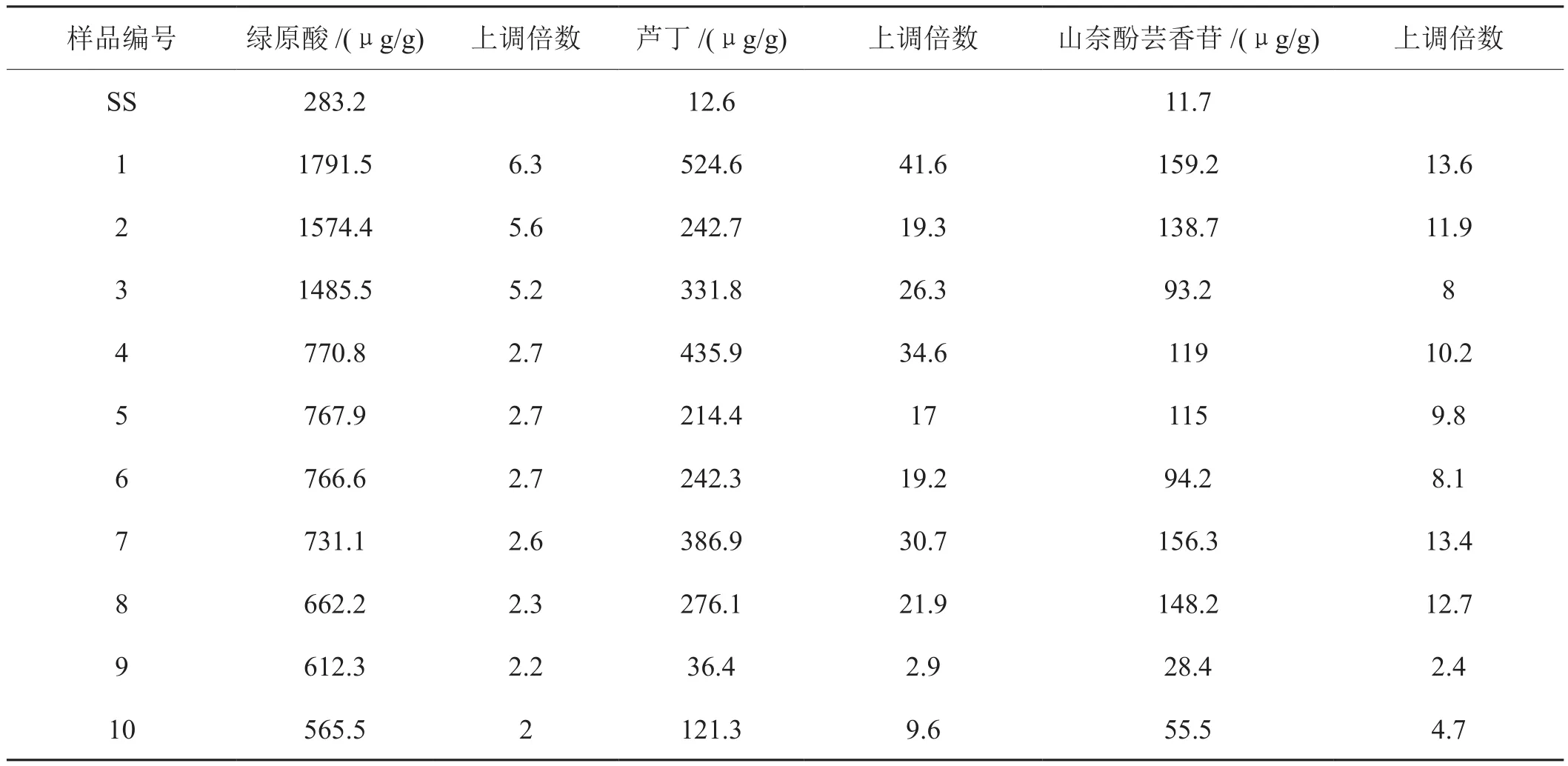
表1 转基因烟草T0代叶片中各物质含量Tab.1 Quanti fi cation of CGA and fl avonoids in the T0 generation of NtHCT expressing tobacco and wild type (SS) tobacco leaves
在PCR检测阳性的植株中随机选择T0代3个株系编号为(2,6和10)收取种子后进行T1代种植及阳性检测,对阳性植株叶片混合后进行HPLC含量测定。转基因烟草T1代植株三种物质含量与T0基本一致,说明NtHCT转基因烟草高含绿原酸及类黄酮的优势可以稳定遗传(图5,表2)。
3 讨论
HCT基因作为BAHD家族的一员,参与植株次生代谢的调控,近年来,该基因参与木质素合成的功能得到广泛验证,同时该基因参与绿原酸及类黄酮的合成也有所提及[5,6]。通过VIGS的方法将本生烟中NbHCT基因沉默表达后,烟草茎中的绿原酸含量虽然明显提高,但主要的累积部位叶片中的绿原酸含量降低[5],说明NbHCT基因正向调控绿原酸的合成。本研究将烟草自身的NtHCT基因通过35S启动子的超量表达构建真核表达载体,由农杆菌介导转化后得到的转基因烟草绿原酸含量有不同程度的提高,与前人得到的研究结果一致。
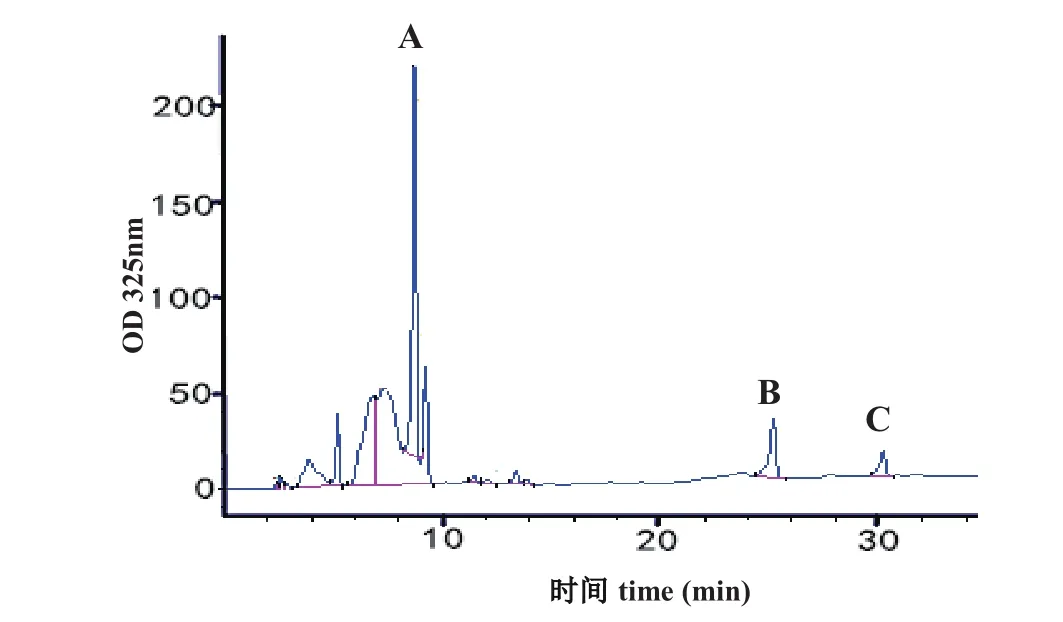
图5 转基因烟草T1代叶片中绿原酸及类黄酮含量检测Fig.5 HPLC analysis CGA and fl avonoid contents of NtHCT transgenic tobacco leaves in T1 generation
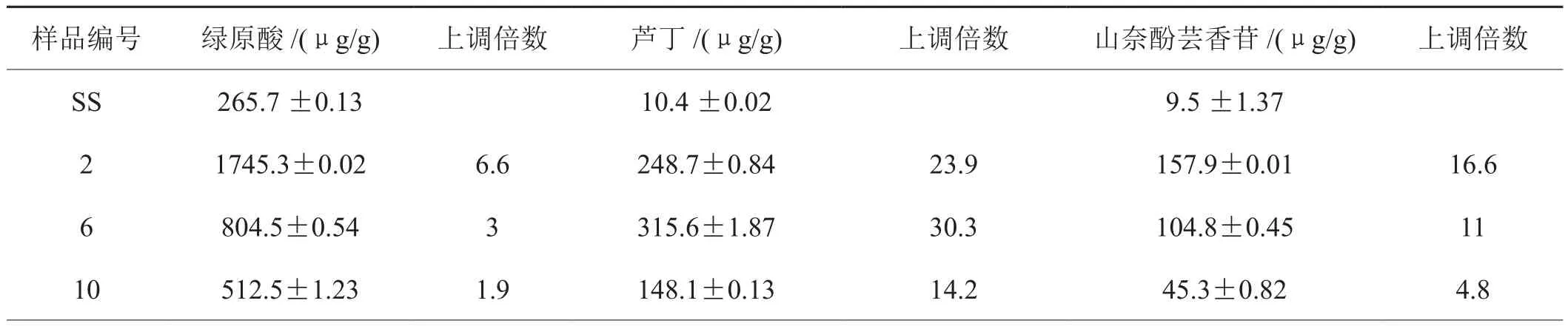
表2 转基因烟草T1代叶片中各物质含量Tab.2 Quanti fi cation of CGA and fl avonoids in the T1 generation of NtHCT expressing tobacco and wild type (SS) tobacco leaves
不同的是,Besseau等[6]在拟南芥中沉默掉AtHCT基因后,类黄酮物质的累积量提高。本研究中超量表达NtHCT,烟草中芦丁及山奈酚芸香苷两种类黄酮物质含量也得到大幅度提高,在鲜重测量的前提下最多分别提高了41.6倍和13.6倍(图4,表1),并且这种含量的改变可以在后代中稳定遗传(图5,表2)。说明HCT基因在类黄酮合成与累积过程中可能同时参与正向和反向调控作用。抑制AtHCT基因的表达,造成几丁质合成和累积出现障碍,从而促进了另外代谢支路类黄酮的合成和积累[6],值得注意的是,相关转基因植株生长发育受到较大影响,由于生理或环境胁迫也经常促进类黄酮等次生代谢物的合成和积累,相关影响生长发育从而造成类黄酮信号途径的激活的可能性也可能存在。另外,当前研究表明,咖啡酰奎尼酸和类黄酮合成途径可以同时被增强表达[12,13],本研究中超量表达NtHCT同时提高类黄酮和绿原酸含量也暗示相关的合成通路同时被激活,一些黄酮醇合成途径中关键酶基因的表达有待进一步调查[13]。
4 结论
本研究超量表达烟草NtHCT,烟草中绿原酸、芦丁及山奈酚芸香苷,三种物质含量均得到大幅度提高,在鲜重测量的前提下最多分别提高了6.3倍、41.6倍和13.6倍。且这种优势在后代中稳定遗传。转基因烟草与野生型烟草生长发育表型并没有任何差异,说明富含类黄酮的烟草植株并且生长发育没有受到抑制,这一特点证明NtHCT转基因烟草的大量种植不会造成烟叶减产,不会对烟农的经济收入造成任何损失。
本研究对烟草自身NtHCT基因进行超量表达获取转基因烟草,分析转基因烟草中绿原酸及类黄酮物质的含量变化,为进一步了解该基因的作用和功能提供了一定的研究基础。相对于其他植物,对烟草本身有益健康的类黄酮物质的研究有限。通过对合成关键基因的研究有助于了解类黄酮物质的合成机理,并且从实际生产上为解决烟草对身体健康的负作用提供一定的理论依据。
[1]Luo J, Nishiyama Y, Fuell C, et al. Convergent evolution in BAHD family of acyl transferases: identification and characterization of anthocyanin acyl transferases from Arabidopsis thaliana [J]. Plant Journal, 2007, 50:678-695.
[2]Maud L, Gerald C, Nicolas T, et al. Chlorogenic acid synthesis in coffee; An analysis of CGA content and real-time RT-PCR expression of HCT, HQT, C3H1, and CCoAOMT1 genes during grain development in C. Canephora [J]. Plant Science, 2007, 175(5): 978-996.
[3]Laurent H, Stephane M, Francoise M, et al. Puri fi cation, cloning, and properties of an acyltransferase controlling shikimate and quinate ester intermediates in phenylpropanoid metabolism [J]. J. Biol. Chem, 2003,278:95-103.
[4]Niggeweg R, Michael A, Martin C. Engineering plants with increased levels of the antioxidant chlorogenic acid [J]. Nature Biotechnology,2004,22(6):746-754.
[5]Hoffmann L, Besseau S, Pierrette G, et al. Silencing of hydroxycinnamoycoenzyme A shikimate/quinate hydroxycinnamoyltransferase affects phenyl-propanoid biosynthesis [J]. Plant Cell,2004,16: 1446-1465.
[6]Besseau S, Hoffmann L, Geoffroy P, et al. Flavonoid accumulation in Arabidopsis repressed in lignin synthesis affects auxin transport and plant growth [J]. Plant Cell, 2007, 19(1): 148-162.
[7]Koes R E, Quattrocchio F, Mol J N M. The flavonoid biosynthetic pathway in plants: function and evolution [J]. BioEssays, 1994, 16(2):123-132.
[8]Birt D F, Hendrich S, Wang W. Dietary agents in cancer prevention:fl avonoids and iso fl avonoids [J]. Pharmacology amp; Therapenties, 2001,90(2-3): 157-177.
[9]Hertog M G L, Kromhout D, Aravanis C, et al. Flavonoid intake and long-term risk of cornary heart disease and cancer in the seven coutries study [J]. Archives of Internal Mediecine, 1995, 155:381-386.
[10]李晓薇, 张艳,赵旭,等. 大豆 GmMYB12B2 植物表达载体的构建及转化烟草的研究 [J]. 中国农学通报, 2011, 287(12) : 91-95[11]杜希华,陆海,高述民,等. 文冠果花药总RNA提取方法研究 [J].北京林业大学学报,2003, 25(1) : 10-13
[12]Luo J, Butelli E, Hill L, et al. AtMYB12 regulates caffeoyl quinic acid and flavonol synthesis in tomato: expression in fruit results in very high levels of both types of polyphenol [J]. The Plant Journal, 2008,56(2) : 316-326.
[13]Lister CE, Lancaster JE, Walker JR. Phenylalanine ammonia-lyase(PAL) activity and its relationship to anthocyanin and falvonoid levels in New Zealand-grown apple cultivars [J]. Journal of the American Society for Horticultural Science, 1996, 121 : 281-285.
[14]俞银姣. 吸烟的危害与尼古丁替代疗法 [J]. 药物不良反应杂志,2008, 10(5) : 346-351
[15]朱列书, 赵松义, 戴林建. 烟草生物技术研究及在育种上的应用[J]. 作物研究, 2004, 5 : 402-407
[16]Ackland ML, van de Waarsengurg S, Jones R. Synergistic antiproliferative action of the flavonols quercetin and kaempferol in cultured human cancer cell lines [J]. In Vivo, 2005, 19 : 69-76.
Effect of NtHCT gene on synthesis of chlorogenic acid and fl avonoid in tobacco
LI Yang1, LI Ming1, YUE Wei2, DING Xinhua1, CHU Zhaohui1
1 State Key Laboratory of Crop Biology, Shandong Provincial Key Laboratory of Agricultural Microbiology, Shandong Agricultural University, Taian 271018, Shandong, China;
2 Gaomi Environmental Protection Bureau, Gaomi 261500, Shandong, China
A vector pCXSN::NtHCT was established and introduced into Nicotiana tabacum var. Samsun via Agrobacterium mediated transformation in order to investigate whether NtHCT was involved in the synthesis of fl avonols. The concentrations of different fl avonoids and CQAs (caffeoylquinic acids) were quanti fi ed with HPLC in leaves of wild-type and transgenic lines. Compared with wild-type tobacco,transgenic tobacco exhibited no visible phenotypic differences. Contents of fl avonols and CGAs (chlorogenic acid) were also determined.Results showed that in NtHCT-expressing transgenic tobacco plants, the highest concentrations of rutin and kaempferol rutinoside were increased by 41.6- and 13.6-fold than those in wild-type, and CGAs increased by 6.3 times It was suggested that NtHCT could positively regulate the synthesis of fl avonols as well as CGAs.
NtHCT; chlorogenic acid; fl avonoid; tobacco
李洋,李明,岳玮,等. 烟草NtHCT基因对次生代谢物质绿原酸和类黄酮合成的影响[J]. 中国烟草学报,2015,21(6)
国家高技术研究发展计划(863,2010AA10Z103);国家自然科学基金 (31171836)
李 洋(1988—),博士研究生,研究方向为植物次生代谢调控,Email:younuowanwan@126.com
储昭辉(1977—),教授,研究方向为植物次生代谢调控,Email:zchu@sdau.edu.cn
2015-04-02
:LI Yang, LI Ming, YUE Wei, et al. Effect of NtHCT gene on synthesis of chlorogenic acid and fl avonoid in tobacco [J]. Acta Tabacaria Sinica, 2015,21(6)
