线粒体旁路氧化途径抑制剂水杨肟酸(SHAM)协同下烟草赤星病菌对嘧菌酯的敏感性
2015-11-23黄艳飞陈庆园王进薛娟娟王茂胜鲁红学商胜华张长青汪汉成
黄艳飞,陈庆园,王进,薛娟娟,王茂胜,鲁红学,商胜华,张长青,汪汉成
1长江大学 农学院,湖北 荆州 434025;
2贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵阳 550081;
3长江大学 生命科学学院,湖北 荆州 434025
线粒体旁路氧化途径抑制剂水杨肟酸(SHAM)协同下烟草赤星病菌对嘧菌酯的敏感性
黄艳飞1,陈庆园2,王进3,薛娟娟1,王茂胜2,鲁红学1,商胜华2,张长青1,汪汉成2
1长江大学 农学院,湖北 荆州 434025;
2贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵阳 550081;
3长江大学 生命科学学院,湖北 荆州 434025
测定了线粒体旁路氧化途径抑制剂水杨肟酸(SHAM)协同下烟草赤星病菌对嘧菌酯的敏感性。结果表明:嘧菌酯抑制病原菌菌丝生长和孢子萌发的EC50值分别为25.8300 mg/L和0.0500 mg/L,在100 mg/L SHAM协同下,EC50值分别降低为15.5200和0.0038 mg/L;SHAM对烟草赤星病菌菌丝的生长和分生孢子的萌发没有影响。研究说明SHAM增强了嘧菌酯对烟草赤星病菌的毒力,线粒体电子传递的旁路氧化途径存在于烟草赤星病菌中,且在孢子萌发中的增效强于菌丝生长阶段。
烟草赤星病菌;嘧菌酯;水杨肟酸 ;敏感性
由 Alternaria alternata(Frises)Keissler引 起 的烟草赤星病(tobacco brown spot)是烟草生长中后期发生最为严重的叶部病害[1-5],导致烟叶品质下降,烘烤价值降低[6-8]。化学防治是目前该病害防治上最为普遍的防治措施。然而,长期大量的使用杀菌剂,导致了病原菌抗药性问题日趋严重[9-13]。
甲氧基丙烯酸酯类杀菌剂是一种新型、高效、广谱、内吸性的杀菌剂,可抑制几乎所有的真菌界病菌孢子的萌发及产生,控制菌丝体的生长和病原孢子的侵入[14-16]。嘧菌酯是这类杀菌剂中典型的代表,具有全新的生化作用机制,主要作用于真菌的线粒体,与线粒体上细胞色素b(cyt b)的Qo位点相结合,阻断细胞色素b和细胞色素c1之间的电子传递,破坏能量合成,从而抑制真菌生长或杀死真菌[17-20]。近些年来,甲氧基丙烯酸酯类杀菌剂(QoI类)在全球许多国家被登记用来防治链格孢属真菌性病害,其中最为广泛的为嘧菌酯[16,21]。由于真菌体内的产能代谢不止线粒体呼吸作用一条,还包括真菌在呼吸作用受抑制的情况下,诱导启动的旁路氧化途径[22]。旁路氧化途径的补偿作用是导致部分病原真菌对QoIs类杀菌剂不敏感或敏感性下降的重要原因之一[23-26]。旁路氧化途径被报道存在于辣椒炭疽病菌(Colletotrichum capsici)、黄瓜灰霉病菌(Botrytis cinerea)、水稻纹枯病菌(Rhizoctonia solani)和水稻稻瘟病菌(Magnaporthe grisea)中[23,27];该途径是否存在于烟草赤星病菌中目前还不清楚。
水杨肟酸是调节旁路氧化途径中旁路氧化酶的专性抑制剂,作用于旁路氧化酶,使其失活,从而专一地抑制旁路氧化作用的产能[28]。本文旨在研究烟草赤星病菌旁路氧化途径被抑制前后,烟草赤星病菌对嘧菌酯的生物活性,以期为嘧菌酯防治烟草赤星病提供参考。
1 材料与方法
1.1 病原菌、培养基及供试药剂
供试烟草赤星病菌菌株C2由贵州省烟草科学研究院真菌实验室分离、鉴定和提供,为敏感菌株。马铃薯培养基(PDA):土豆200 g煮沸20min后过滤,滤液添加20 g琼脂和20 g葡萄糖煮沸,定容至1 L,灭菌,用于病原真菌的敏感性测定。相同阶段敏感性测定,所有药剂均采用同一批培养基以减少试验误差。
对照药剂95.3%氟硅唑、96%醚菌酯、95%苯醚甲环唑原药分别由南通柯林化学品有限公司、盐城福利德化工有限公司和江苏扬农化工集团有限公司提供。将上述药剂溶于甲醇,分别配成10000 mg/L的母液。对照药剂96%多菌灵由江苏蓝丰生物化工股份有限公司生产,将其溶于0.2M的稀盐酸配成10000 mg L-1的母液。对照药剂97.3%异菌脲由泰安圣聚华有限公司生产,将该药剂溶于丙酮配成10000 mg/L的母液。用无菌水将上述母液稀释成系列浓度的药液,于4 ℃黑暗条件下保存、备用。96.8%嘧菌酯由先正达(中国)投资有限公司提供,溶于甲醇,配成10000 mg/L的母液。99%水杨肟酸(salicyhydroxamic acid, SHAM)美国Acros Organics公司生产,溶于甲醇配置成1.0×105mg/L的母液,4℃保存备用。试验时将上述系列浓度的药液加至50℃左右的PDA培养基中制备含药平板,其中甲醇、丙酮、稀盐酸的含量小于待测溶液体积的0.25%,此浓度的甲醇、丙酮、稀盐酸不影响烟草赤星病菌菌丝的生长和孢子的萌发(数据略)。无菌水中加入相同体积的甲醇、丙酮或稀盐酸处理作为空白对照。
1.2 烟草赤星病菌对6种杀菌剂的敏感性
采用“菌丝生长速率”法,将供试烟草赤星病菌菌株移至PDA培养基上,于28℃、黑暗条件下预培养5 d,用5mm孔径打孔器在菌落边缘打制菌碟。将制好的菌碟置于9 cm直径的含系列浓度药剂的PDA平板上。嘧菌酯和醚菌酯的最终供试浓度为(0、3.13、6.25、12.50、25、50、100) mg /L。多菌灵、氟硅唑、异菌脲、苯醚甲环唑的最终供试浓度为(0、0.16、0.31、0.63、1.25、2.50、5、10 )mg/ L。各药剂处理均重复3次。接菌后,28℃黑暗条件下培养6 d,用“十字交叉法”测量各菌落直径,并计算各药剂处理对烟草赤星病菌菌丝生长的抑制率。菌落增长直径=菌落直径-菌碟直径

1.3 水杨肟酸协同下烟草赤星病菌对嘧菌酯的敏感性
参照上述方法在PDA培养基上进行测定。配制含100 mg/L水杨肟酸的待测药剂系列浓度的PDA平板。将制好的菌碟置于PDA平板上。嘧菌酯的最终供试浓度为0、3.13、6.25、12.50、25、50、100 mg/L。所有处理均重复3次。在28℃黑暗条件下培养6 d,用“十字交叉法”量取菌落直径。
参考袁善奎等的方法[29],将烟草赤星病菌在PDA培养基上28 ℃黑暗培养7 d,用打孔器(5mm)在菌落边缘制取菌碟,挑出5块菌碟,将其分散于含有500 µL系列浓度嘧菌酯的1 mL离心管中,以含有相同体积无菌水的离心管为对照,涡旋后获得含不同浓度药剂的孢子悬浮液。嘧菌酯的最终供试浓度为(0、0.03、0.05、0.10、0.20、0.40) mg/L。协同作用下所有处理中水杨肟酸的浓度均为100 mg/L。取上述含药孢子悬浮液各20 µL于载破片上,将载玻片置于一次性培养皿中,保湿,各浓度药剂处理均重复3次。28℃黑暗培养10 h,在显微镜下(10 × 10倍)镜检孢子萌发的数量,每个玻片随机挑选3个视野,3次重复。当萌发芽管的长度超过孢子长度一半时,视为萌发。
1.4 数据处理
综合试验数据,用Excel软件进行统计分析。以药剂的浓度对数为横坐标,以对病菌所测对象抑制率的几率值为纵坐标,建立线形回归方程,并进行相关性分析(r)[30]。根据方程计算各种药剂抑制菌丝生长、孢子萌发的EC50和EC90值。最后根据EC50值,分析比较不同杀菌剂对烟草赤星病菌的毒力。
2 结果与分析
2.1 烟草赤星病菌对6种杀菌剂的敏感性
结果表明,苯醚甲环唑和氟硅唑对烟草赤星病菌的菌丝生长毒力最强,其EC50值和EC90值分别为0.3000 mg/L、0.3300 mg/L和 10.6700 mg/L、3.4600 mg/L;其次为异菌脲及嘧菌酯,其EC50值和EC90值分别为2.1500 mg/L、25.8300 mg/L和 7.9700 mg/L、> 100 mg/L,醚菌酯和多菌灵的毒力较弱,其EC50值均>100 mg/L(表1)。空白对照处理黑暗条件下培养6d后烟草赤星病菌的菌落直径为67mm。

表1 烟草赤星病菌对6种杀菌剂的敏感性Tab. 1 Sensitivity of Alternaria alternata to six fungicides
2.2 水杨肟酸协同下烟草赤星病菌对嘧菌酯的敏感性
结果表明,嘧菌酯对烟草赤星病菌孢子的萌发和菌丝的生长均有抑制作用,其中对孢子萌发的毒力较强。随着药剂浓度的增加,对分生孢子的萌发和菌丝的生长抑制逐渐增强(图1、3),其EC50和EC90值分别为0.0500和0.3200 mg/L,25.8300和>100 mg/L(表2)。嘧菌酯低剂量处理时,烟草赤星病菌分生孢子萌发芽管显著畸形(图3)。空白对照分子孢子萌发率为90%。
100 mg/L水杨肟酸作用下,烟草赤星病菌分生孢子具有同空白对照处理一样的孢子萌发率(90%)和菌丝生长速率(65.50mm),水杨肟酸对赤星病菌孢子的萌发(图3A、4A)和菌丝生长无抑制作用图(2A、2B)。
100 mg/L水杨肟酸协同作用下,嘧菌酯对烟草赤星病菌孢子萌发和菌丝生长的毒力均显著增强(图2、4),其EC50和EC90值分别为0.0038和0.1200 mg/L,15.5200和100 mg/L(表2)。

表2 嘧菌酯及其与水杨肟酸协同作用下对烟草赤星病菌菌丝生长和孢子萌发的毒力Tab. 2 Toxicity of azoxystrobin and its synergistic effect with salicylhydroxamic acid against mycelial growth and conidial germination of Alternaria alternata

图1 嘧菌酯对烟草赤星病菌菌丝生长的影响Fig. 1 Effect of azoxystrobin on mycelial growth of Alternaria alternata (A to G were 0, 3.13, 6.25, 12.50, 25, 50, 100 mg/L azoxystrobin, respectively.)
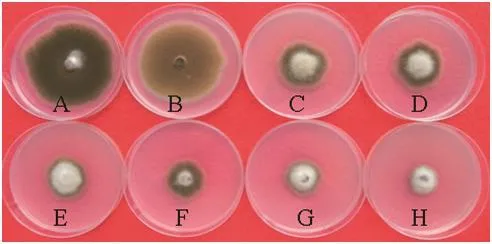
图2 水杨肟酸100 mg/L协同下嘧菌酯对烟草赤星病菌菌丝生长的影响Fig.2 Effect of azoxystrobin on mycelial growth of Alternaria alternata in combination of 100 mg/L SHAM (A was water treatment; B to H were 0, 3.13, 6.25, 12.50, 25, 50, 100 mg/L azoxystrobin, respectively.)
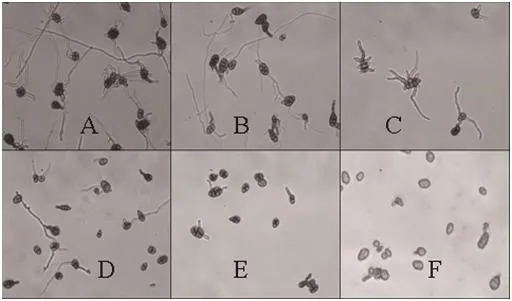
图3 嘧菌酯对烟草赤星病菌孢子萌发的影响 (100倍)Fig.3 Effect of conidial germination of Alternaria alternata under various pressures of azoxystrobin (A to F were 0, 0.025, 0.05, 0.10, 0.20 and 0.40 mg/L azoxystrobin, respectively.)
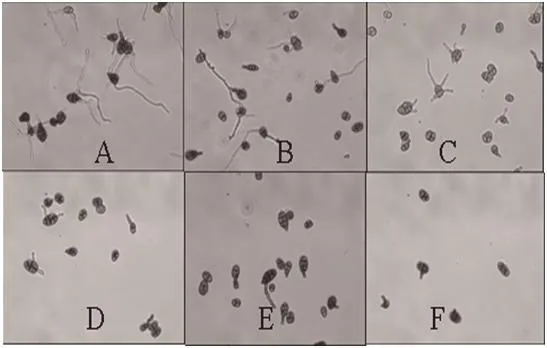
图4 水杨肟酸100 mg/L协同下嘧菌酯对烟草赤星病菌分生孢子萌发的影响(100倍)Fig.4 Effect of azoxystrobin on conidial germination of Alternaria alternata in combination of 100 mg/L SHAM (A to F were 0,0.025, 0.05, 0.10, 0.20 and 0.40 mg/L azoxystrobin, respectively.)
3 讨论
在SHAM的作用下,嘧菌酯对烟草赤星病菌的毒力增强(对菌丝生长和孢子萌发毒力分别提高1.66和14倍),进一步证实了烟草赤星病菌的菌丝生长和孢子萌发过程中均存在旁路呼吸作用。旁路呼吸作用能削弱嘧菌酯对烟草赤星病菌的生物活性;但烟草赤星病菌孢子萌发和菌丝生长阶段,该呼吸途径在电子传递上的贡献存在差异,差异的大小可能与孢子萌发阶段病原菌需要大量的能量(ATP),而其菌丝生长阶段需要ATP的量较少有关[27]。
本文所测定的药剂中,多菌灵对烟草赤星病菌的生物活性较低;苯醚甲环唑、异菌脲及氟硅唑对烟草赤星病菌菌丝的生长均表现出强烈的抑制作用,测定结果与严清平等的报道一致[31],也与其他类链格孢属病原菌对上述药剂的敏感性相似[31-33],但由于三唑类药剂对作物易产生药害、且残留较高等方面的原因[34-35],尚未在烟草上正式登记。而赤星病菌已经对异菌脲产生广泛的抗药性[36]。所以上述药剂均不宜用于烟草赤星病的防治。
甲氧基丙烯酸酯类的嘧菌酯和醚菌酯对赤星病菌孢子萌发和菌丝生长均有一定的生物活性,因此,它们对赤星病的防治可能同时表现出保护和治疗活性。由于嘧菌酯对孢子萌发的毒力(EC50值0.0540 mg/L)高于菌丝生长的毒力(EC50值25.8300 mg/L),因此,在烟草上它的保护作用(病菌侵染前对孢子的抑制)可能优于治疗作用(病菌侵染后对菌丝的抑制),但如何用于烟草赤星病的防治,其防治技术有待深入研究,如嘧菌酯的最宜使用剂量、使用次数、使用间隔期、药剂在烟草上的内吸性与传导活性、残留与持效期等。
此外,由于甲氧基丙烯酸酯类杀菌剂作用靶标单一,国内外长期高浓度、高频率的使用这类杀菌剂,已经导致部分其它病原菌对包括嘧菌酯在内的多种此类杀菌剂产生了抗药性;因此,嘧菌酯用于烟草赤星病的防治需要遵循国际杀菌剂抗性行动委员会(Fungicide Resistance Action Committee)的使用指南。
4 结论
研究结果证实嘧菌酯对赤星病菌孢子萌发的毒力(EC50值0.0540 mg/L)高于菌丝生长的毒力(EC50值25.8300 mg/L)。水杨肟酸能增强嘧菌酯对烟草赤星病菌的毒力,且孢子萌发阶段更为明显。真菌线粒体电子传递的旁路氧化途径存在于烟草赤星病菌中,由于对菌丝生长和孢子萌发都具有较强的生物活性,嘧菌酯可进一步用于烟草赤星病的防治研究。
[1]谭荫初. 烟草赤星病的为害症状与药剂防治 [J]. 植保技术与推广, 1997, 17(3): 29-30.TAN Yinchu. Damage symptoms and chemical control of tobacco brown spot [J]. Plant Protection Technology and Extension, 1997,17(3): 29-30. (in Chinese)
[2]刘学敏, 李大壮, 常稳. 烟草赤星病研究现状及存在问题 [J]. 东北农业大学学报, 2000, 31(1):80-85.LIU Xuemin, Li Dazhuang, Chang Wen. Research status and existing problems of tobacco brown spot [J]. Journal of Northeast Agricultural University, 2000, 31(1):80-85. (in Chinese)
[3]Lucas G B, Pero R W, Snow J P, Harlan D. Analysis of tobacco for the Alternaria toxins, Alternariol and Alternariol monomethyl ether [J]. Journal of Agricultural and Food Chemistry, 1971, 19(6):1274-1275.
[4]Stavely J R, Main CE. In fl uence of temperature and other factors on initiation of tobacco brown spot [J]. Phytopathology, 1970, 60:1591-1596.
[5]Lucas G B. Alternaria alternata (Fries) Keissler, the correct name for A. tenuis and A. longipes [J]. Tobacco Science, 1971 (15): 37-42.
[6]Stavely J R. Relationship of postinoculation leaf wetness to initiation of tobacco brown spot [J]. Phytopathology, 1975, 65:897-901.
[7]彭希文, 刘光珍, 杨永柱, 等. 云南省烟草赤星病(Tobacco brown spot)病原研究及其防治药剂的筛选 [J]. 西南农业大学学报, 2000, 22(2): 153-156.PENG Xiwen , Liu Guangzhen , Yang Yongzhu , et al. Identi fi cation of pathogens for brown spots on tobacco plants in Yun Nan province and selection for effecitive fungicides for it’s control [J].Journal of Southwest Agricultural University, 2000, 22(2): 153-156. (in Chinese)
[8]张万良, 翟争光, 谢扬军, 等. 烟草赤星病研究进展 [J]. 江西农业学报, 2011, 23(1):118-120.ZHANG Wanliang, ZHAI Zhengguang, XIE Yangjun, et al.Research advance in tobacco brown spot [J]. Acta Agriculturae Jiangxi, 2011, 23(1):118-120. (in Chinese)
[9]孟建玉, 曹毅, 陆宁, 等. 贵州省烟草赤星病菌对菌核净的抗药性 [J]. 植物保护学报,2013, 40(5):497-480.MENG Jianyu, CAO Yi, LU Ning, et al. Resistance of Alternaria alternata to dimethachlon in Guizhou province [J]. Acta Phytophylacica Sinica, 2013, 40(5):497-480. (in Chinese)
[10]李梅云, 祝明亮. 烟草赤星病菌对菌核净的抗药性测定 [J]. 西南农业学报, 2007, 20(3): 412-416.LI Yunmei, ZHU Mingliang. Determination of dimethachlon resistance in Alternaria alternata [J]. South west China Journal of Agricultural Sciences, 2007, 20(3): 412-416. (in Chinese)
[11]Dry I B, Yuan K H, Hutton D G. Dicarboximide resistance in fi eld isolates of Alternaria alternata is mediated by a mutation in a twocomponent histidine kinase gene [J]. Fungal Genetics and Biology,2004, 41(1): 102-108.
[12]王美琴, 赵晓军, 刘慧平, 等. 番茄叶霉病菌对代森锰锌的抗性检测[J]. 山西农业科学, 2005, 33(3):66-68.WANG Meiqin , ZHAO Xiaojun , LIU Huiping, et al. Resistance detection of Fulvia fulva to mancozeb [J]. Journal of ShanXi Agricultural Sciences, 2005, 33(3):66-68. (in Chinese)
[13]王美琴, 刘慧平, 韩巨才, 等. 番茄叶霉病菌对多菌灵、乙霉威及代森锰锌抗性检测 [J]. 农药学学报, 2003, 5(4):30-36.WANG Meiqin , LIU Huiping, Han Jucai, et al. Detecting the resistance of Fulvia fulva to carbendazim, diethofencarb and mancozeb [J]. Chinese Journal of Pesticide Science, 2003, 5(4):30-36. (in Chinese)
[14]Clough J M, Anthony V M, Defraine P J, et al.Synthesis of fungicidal β-Methoeyacrylates [A]. Ragsdale NN, Kearny PC, Plimmer JR.Eighth International Congress of Pesticide Chemistry: Option 2000 [C].Washington, DC: American Chemical Society, 1995: 59-73.
[15]Sauter H, Steglich W, Anke T.Strobilurins: evolution of a new class of active substances [J]. Angewandte Chemie International Edition, 1999, 38: 1328-1349.
[16]张舒亚, 周明国. 甲氧基丙烯酸酯类杀菌剂的生物学及应用技术研究 [C]. 中国植物病害化学防治研究( 第三卷) [M]. 北京:中国农业科技出版社, 2002: 1-10.ZHANG Shuya,ZHOU Mingguo. Studies on the biology and applied technology of strobin fungicides [C]. Chinese plant disease chemical control research (Volume third) [M]. Beijing: China Agriculture Press, 2002: 1-10. (in Chinese)
[17]Guo Z, Miyoshi H, Komyoji T, et al. Uncoupling activity of a newly developed fungicide, fluazinam [J]. Biochemica et Biophysica Ada, 1991, 1056: 89-92.
[18]Brandt U, Schagger H, Von JG. Characterization of binding of the methoxyacrylate inhibitors mitochondrial cytochrome c reductase[J]. European Journal of Biochemistry, 1988, 173: 499-506.
[19]Veronika H, Johannes D, Dorte K. New benzodioxepin type strobilurins from basidiomycetes structural revision and determination of the absolute configuration of strobilurin D and related methoxyacrylate antibiotics [J].Tetrahedron, 1999, 55:10101-10118.
[20]Becker W F, Jagow G V, Anke T. Oudemansin, strobilurin A,strobilurin B and myxothiazol: new inhibitors of the Bcl segment of the respiratory chain with an E-Methoxyacrylate system as common structural element [J]. FEBS Lett, 1981, 132: 329-333.
[21]Bartelett D W, Clough J M, Godwin J R, et al. The strobilurin fungicide [J]. Pest Management Science, 2000, 58:649-662.
[22]Chin K M, Chavalia D, Kacsbohrea M, et al. Characterizing resistance risk of Erysipelas gaminsterri fi c to strobilurins [J]. Crop Protection, 2001, 20:87-96.
[23]金丽华,陈长军,王建新,等. 嘧菌酯及SHAM对4种植物病原真菌的活性和作用方式研究 [J].中国农业科学, 2007, 40(10):2206-2213.JIN Lihua, CHEN Changjun,WANG Jianxin. Activity of azoxystrobin and SHAM of four plant pathogens [J]. Scientia Agricultura Sinica, 2007, 40(10): 2206-2213. (in Chinese)
[24]Ziogas N B, Baldwin C B, Young E J. Alternative respiration: a biochemical mechanism of resistance to azoxystrobin (ICIA 5504)in Septoria tritici [J]. Pesticide Science, 1999, 50:28-34.
[25]Olaya G , Zhang D, Koller W. Differential responses of germinating Venturia inaequalis conidia to kresoxim-methyl [J]. Pesticide Science, 1998, 54:230-236.
[26]Yukioka H, Inagaki S, Tanakn R, et al. Transcriptional activation of the alternative oxidase gene of the fungus Magnaporthe grisea by a respiratory-inhibiting fungicide and hydrogen peroxide [J].Biochem Biophys Acta, 1995, 1442:161-169.
[27]Inoue K, Tsurumi T, Ishii H, Park P, Ikeda K. Cytological evaluation of the effect of azoxystrobin and alternative oxidase inhibitors in Botrytis cinerea [J]. FEMS Microbiological Letter,2012, 326(1): 83-90.
[28]祁之秋, 李兴海, 王英姿, 等. 不同甲氧基丙烯酸酯类杀菌剂对辣椒疫霉的离体活性及防病方式的影响 [J]. 沈阳农业大学学报, 2009, 40(1): 95-98.QI Zhiqiu, LI Xinghai, WANG Yingzi, et al. Inhibition of Strobilurin fungicides against Phytophthora capsici [J]. Journal of Shenyang Agricultural University,2009,40(1):95-98. (in Chinese)
[29]Caten C E, Jinks J L. Spontaneous variability of single isolates of Phytophthora infestans. I. Cultural variations [J]. Canadian Journal of Botany, 1968, 46(4): 329-348.
[30]Brandt U, Schagger H, Von JG. Characterization of binding of the methoxyacrylate inhibitors mitochondrial cytochrome c reductase[J]. European Journal of Biochemistry, 1988, 173: 499-506.
[31]严清平, 袁善奎, 王晓军, 等. 5种链格孢属植物病原真菌对10种杀菌剂的敏感比较 [J]. 植物保护, 2008, 34(2):124-127.YAN Qingping, YUAN Shankui, WANG Xiaojun, et al.Comparison of the sensitivities of fi ve Aiternaria plant pathogens to ten fungicides[J]. Plant Protection, 2008, 34(2):124-127. (in Chinese)
[32]施永平, 陈杰, 贾忠建. 异菌脲对烟草赤星病的室内生测及药效评价[J]. 现代农药, 2010, 9(5):54-56.SHI Yongping, CHEN Jie, JIA Zhongjian. Bioassay and fi eld trials of iprodione on Alternaria alternata [J]. Modern Agrochemicals,2010, 9(5):54-56. (in Chinese)
[33]刘霞, 杨克强, 姜兴印, 等. 危害核桃的链格孢(Alternaria alternata )对4种杀菌剂的敏感性 [J]. 农药, 2013, 52(1): 67-70.LIU Xia, YANG Keqiang, JIANG Xingyin, et al. Sensitivity of walnut-associated Alternaria alternata to four fungicides [J].Agrochemicals, 2013, 52(1): 67-70. (in Chinese)
[34]王军, 刘丰茂, 温家钧, 等. 苯醚甲环唑在茶叶中的残留量及其在茶汤中的浸出动态研究[J]. 农药学学报, 2010, 12(3):299-302.WANG Jun, LIU Fengmao, WEN Jiajun, et al. Study on residue of difenoconazole in tea and it stransfer from made tea to infusion[J]. Chinese Journal of Pesticide Science, 2010, 12(3):299-302. (in Chinese)
[35]梁宏武, 李薇, 李莉, 等. 氟硅唑在黄瓜及土壤中的残留动态研究[J]. 长江蔬菜,2010, (16):65-68.LIANG Hongwu, LI Wei, LI Li, et al. Research on Residue and Dissipation of Flusilazole in Cucumber and Soil [J]. Journal of Chang Jiang Vegetables, 2010, (16):65-68. (in Chinese)
[36]祝明亮, 严金平, 孙启玲, 等. 植物病原真菌对二甲酰亚胺类杀菌剂的抗性分子机制[J]. 生物技术, 2005, 15(5): 95-97.ZHU Mingliang, YAN Jingping, SUN Qiling, et al. Molecular Mechanisms of the Resistance to Dicarboximides Fungicides(DCFs)in Phytopathogenic Fungi [J]. Biotechnology, 2005, 15(5):95-97. (in Chinese)
Sensitivity of Alternaria alternata to azoxystrobin at the synergism of alternative oxidative inhibitor salicylhydroxamic acid
HUANG Yanfei1, CHEN Qingyuan2, WANG Jin3, XUE Juanjuan1, WANG Maosheng2, LU Hongxue1, SHANG Shenghua2,ZHANG Changqing1, WANG Hancheng2
1 College of Agriculture, Yangtze University, Jingzhou 434025, Hubei, China;
2 Key Laboratory of Molecular Genetics, Guizhou Academy of Tobacco Science, Guiyang 550081, China;
3 College of Life Science, Yangtze University, Jingzhou 434025, Hubei, China
This paper investigates the sensitivity of Alternaria alternata to Azoxystrobin in the synergistic effects of alternative oxidative inhibitor salicylhydroxamic acid (SHAM). Results showed that azoxystrobin inhibited both mycelial growth and conidial germination of A.alternata, with EC50 values of 25.8300 and 0.0500 mg L-1, respectively; while in the combination of 100 mg L-1 SHAM, it showed EC50 values of 15.5200 and 0.0038 mg L-1, respectively. SHAM presented no effects on mycelial growth or conidial germination of the pathogen.Studies showed that SHAM enhanced the sensitivity of A. alternata to azoxystrobin, and alternative oxidative pathway of electron transport chain existed in pathogen A. alternata., especially in the stage of conidial germination.
tobacco brown spot; azoxystrobin; salicylhydroxamic acid; sensitivity
黄艳飞,陈庆园,王进,等. 线粒体旁路氧化途径抑制剂水杨肟酸(SHAM)协同下烟草赤星病菌对嘧菌酯的敏感性[J].中国烟草学报,2015,21(6)
国家自然科学基金(31360448、31501679);中国烟草总公司贵州省公司科技项目(201305,201336,201436);黔西南州烟草公司(2013-06)
黄艳飞(1989—),在读硕士研究生,主要从事烟草微生物研究,Email:974603170@qq.com
汪汉成(1982—),博士,研究员,主要从事烟草植保及微生物方面的研究,Email:xiaobaiyang126@hotmail.com
张长青(1960—),教授,植物病害,Email:qingchangzhang@tom.com
2015-03-13
:HUANG Yanfei, CHEN Qingyuan, WANG Jin, et al. Sensitivity of Alternaria alternata to azoxystrobin at the synergism of alternative oxidative inhibitor salicylhydroxamic acid [J]. Acta Tabacaria Sinica, 2015,21(6)
