新型双亲性载药温敏凝胶IPF/PECT的实验研究
2015-11-21贾玉荣黄力迅王永兰董岸杰
贾玉荣, 尹 利, 黄力迅, 王永兰, 董岸杰
( 天津: 1.天津医科大学口腔医院, 300070; 2.天津大学化工学院, 300072)
新型双亲性载药温敏凝胶IPF/PECT的实验研究
贾玉荣1, 尹 利2, 黄力迅1, 王永兰1, 董岸杰2
( 天津: 1.天津医科大学口腔医院, 300070; 2.天津大学化工学院, 300072)
目的: 制备负载布洛芬(IPF)的新型温敏凝胶IPF/PECT,并探讨其在牙周局部缓释用药的可行性。方法:采用纳米沉淀技术制备IPF/PECT 纳米粒(IPF/PECT NPs),将其冻干并用双蒸水溶解成凝胶制剂后,分别用TEM观察其纳米粒形貌;MTT法检测其生物相容性;ELISA法测定其体外细胞抗炎效果;于37 ℃下观察其液-胶转变情况及药物缓释特性。结果:IPF/PECT纳米粒径均匀,无明显聚合现象;用含不同浓度(0、200、400、800、1 200、1 600、2 000 μg/mL)IPF/PECT的培养基培养牙龈成纤维细胞(HGFs)48 h后,各组间平均OD值两两相比差异均无统计学意义(P﹥0.05);在0.1 μg/mL LPS刺激下同时加入60 μg/mL 的IPF或IPF/PECT,并与HGFs共同培养10、24、48、72 h后,各时间点的前列腺素E2(PGE2)浓度均为IPF/PECT组明显低于IPF组(P<0.05);IPF/PECT体外释放IPF可持续32 d以上,药物累积释放量达85%。 结论:本实验所制备的新型双亲性载药温敏凝胶IPF/PECT具有良好的生物安全性和缓慢释药功能,其抗炎效果明显优于IPF水溶液。
布洛芬(IPF); 原位凝胶; 双亲性; 局部缓释; 载药
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.10.003
[Chinese Journal of Conservative Dentistry,2015,25(10): 587]
牙周炎是以牙周致病菌为始动因子而引发的牙周软硬组织的感染性破坏性疾病,当病变发展到一定程度时,会造成牙周支持组织的大量丧失[1]。牙周基础治疗是牙周炎最基本的治疗方法,其中机械去除牙菌斑是目前应用最广泛、最行之有效的方法。但在完成机械洁、刮治疗后,若器械不易到达的感染部位(深而复杂牙周袋、根分叉处等)、深袋内有散落的细菌、牙周组织内有微生物侵入、牙周组织的急性感染等情况存在时,则需要药物辅助治疗以达到更理想治疗效果[2]。然而,若长期全身应用抗菌药物不仅会产生胃肠道反应,同时还易引起菌群失调等副作用。因此,局部缓释给药一直都是牙周局部药物治疗的研究热点。
本实验研究的IPF/PECT是由环醚侧基修饰的新型三嵌段共聚物,聚(5-乙二醇缩酮-ε-己内酯-ε-己内酯)-聚乙二醇-聚(5-乙二醇缩酮-ε-己内酯-ε-己内酯)(PECT)[3]与布洛芬(ibuprofen, IPF)以纳米沉淀技术制成的IPF/PECT NPs,将其冻干后再溶解为IPF/PECT溶液,并置于37 ℃环境下使之快速形成凝胶。然后分别从IPF/PECT 温敏凝胶的温敏效应、药物缓释曲线、生物安全性、抗炎效果等方面,初步探讨该温敏凝胶用作牙周缓释剂的可行性。
1 材料和方法
1.1 主要材料和仪器
聚乙二醇1 500(PEG1 500)、ε-己内酯(CL)(Alfa Aesar,美国);聚乳酸(PLA)、四氢呋喃(THF)、N-N-二甲基甲酰胺(DMF)、二氯甲烷(DCM)(天津江天);四甲基偶氮哇盐(MTT)(Sigma,美国);二甲基亚砜(DMSO)(Amresco,美国);布洛芬(含量 98.5%)(苏巨化集团);CO2恒温培养箱(香港力康);倒置相差显微镜(1X2-ILL30,Olympus,日本);离心机(CD5-2B,北京京立);冻干机(天津大学提供);酶标仪(Rayto RT-6000, TECAN,澳大利亚);透射电镜(TEM)(FEI Quanta 200,美国);紫外分光光度计(Perkin- Elmer,美国)。
1.2 方法
1.2.1 PECT三嵌段共聚物的制备
CL内加人适量CaH2并进行蒸馏后,即得到纯净而无色透明的CL;取1,4-环己二酮单乙二醇缩酮,加入DCM使其溶解后,再分批加入间氯过氧苯甲酸,待反应完毕后进行过滤,并将其置于乙醚中重结晶3次,即得到纯净的 TOSUO;最后以CL为引发剂,以己内酯与5-乙二醇缩酮-ε-己内酯为单体,在辛酸亚锡催化下,通过开环聚合制备三嵌段共聚物PECT。
1.2.2 IPF/PECT温敏凝胶的合成
分别精确称取布洛芬与PECT(质量比为5 ∶100), 用一定量的THF溶解后,将其以4/1 000比例滴加到双蒸水中;持续搅拌6 h后离心,确定无药物沉淀后将上清液置于冻干机中使其冻干,即获得载药纳米粒(IPF/PECT NPs)。同时以上述相同的方法制备不载药的PECT NPs用于对照。然后取IPF/PECT NPs冻干粉,以1 ∶3质量比溶于双蒸水后置于37 ℃温箱内,使其溶液快速形成凝胶状态。
1.2.3 PECT、IPF/PECT的形貌观测
分别取PECT NPs、IPF/PECT NPs,TEM观察其形态。
1.2.4 IPF/PECT溶液相转变(小瓶翻转)实验
将IPF/PECT凝胶溶液置于小瓶内,分别观察其在27 ℃和37 ℃环境下的形态变化。
1.2.5 体外释药曲线的测定
将0.5 g IPF/PECT冻干粉溶液放置于内径为2 mm的试管内(设置3个平行样),在37 ℃环境下稳定12 h后,分别在每管中各加入5 mL PBS(pH为7.4),并将其置于振荡器上以70 r/min的恒速进行振荡;然后每隔24 h从每管中各取4 mL释放液(同时补充相同体积的新鲜PBS),用紫外分光光度计测其230 nm波长处的吸光度(OD值),并计算IPF/PECT凝胶在各时间点的药物释放量;最后以时间为横坐标,药物累计释放量为纵坐标绘制药物释放曲线。药物释放量计算公式如下。
式中,E为累计释放量(%);VE为取样体积(4 mL);V0为起始释放液体积(5 mL);Ci和Cn为布洛芬浓度(μg/mL);i和n为取样次数;m0为凝胶中布洛芬的起始质量(μg)。
1.2.6 IPF/PECT体外生物相容性检测
取人牙龈成纤维细胞(HGFs)用含100 g/L小牛血清DMEM培养基(含谷氨酰胺及4.5 g/L不含丙酮酸钠的葡萄糖)制成细胞密度为2×104/孔的悬液,并将其接种于96孔板(200 μL/孔),置于37 ℃、50 mL/L CO2的培养箱中进行培养;24 h后弃原培养液,并将细胞随机分为7组(每组复3孔),分别加入含IPF/PECT浓度为0、200、400、800、1 200、1 600、2 000 μg/mL的DMEM继续培养。共同培养48 h后取各组细胞,采用MTT法在酶标仪上测定各孔490 nm长处的OD值,并按以下公式计算各组细胞的存活率。
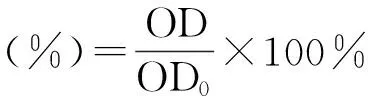
式中OD是样品的吸光度值,OD0是空白对照的吸光度值。
1.2.7 IPF/PECT抗炎效果检测
用Pg-LPS制造HGFs炎症模型后分别加入相同浓度的IPF、IPF/PECT溶液进行培养,并通过检查培养后不同时间点的前列腺素E2(PGE2)浓度以评价IPF/PECT的抗炎效果。具体方法如下:取HGFs以2×104/孔的密度接种于96 孔板中,加入DMEM培养基并置于 37 ℃、 50 mL/L CO2培养箱中培养24 h后,弃原培养液,并将细胞随机分为A、B、C、D 4组,A组:加入DMEM培养基(空白对照);B组:加入1 μg/mL LPS的DMEM;C组: 加入1 μg/mL LPS和60 μg/mL IPF的DMEM; D组:加入1 μg/mL LPS和60 μg/mL IPF/PECT的DMEM继续培养。分别于培养后10、24、48、72 h各时间点取各组细胞的培养上清液,采用ELISA法检测其PGE2浓度。
1.3 统计学分析
2 结果
2.1 IPF/PECT溶液相转变观察结果
IPF/PECT冻干粉溶于双蒸水中形成凝胶溶液后,小瓶翻转实验显示,其在常温下(27 ℃)呈溶液状态;而将小瓶置于37 ℃温箱时, 1 min内即可见凝胶溶液发生相转变,成为半固体凝胶状态(图1)。

27 ℃环境下 37 ℃环境下
图1 IPF/PECT溶液向凝胶状态转变示意图
2.2 PECT 、IPF/PECT形貌观测
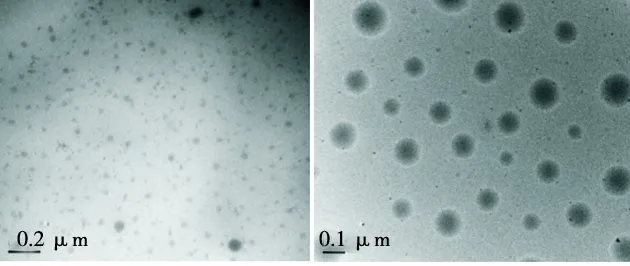
TEM观察显示,载药后的IPF/PECT NPs粒径较PECT NPs的粒径变大,约150 nm,且大小均匀,无聚合现象(图2)。
PECT NPs IPF/PECT NPs
图2 TEM观察PECT及IPF/PECT形貌
2.3 IPF/PECT释药曲线
药物释放曲线测量结果显示,IPF/PECT体外释放布洛芬可持续32 d以上,累积释放量可达85%,前9 d以线性关系释放药物,后期药物释放较缓慢,但趋势稳定,无明显突释现象(图3)。
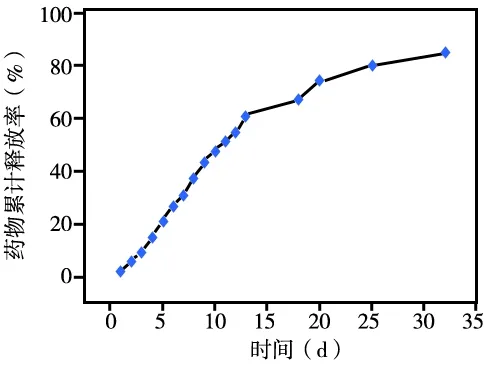
图3 IPF/PECT凝胶制剂体外累计释药曲线
2.4 IPF/PECT的生物相容性结果
分别将200、400、800、1 200、1 600、2 000 μg/mL不同浓度的IPF/PECT与HGFs共培养48 h后,细胞增殖活性检查结果显示:各实验组细胞的平均OD值分别为0.28±0.01、0.29±0.02、0.29±0.03、0.29±0.03、0.29±0.03、0.28±0.02,分别与对照组的OD值(0.29±0.01)相比,差异均无统计学意义(P﹥0.05)(图5)。细胞存活率计算结果显示,不同浓度的IPF/PECT对HGFs均无毒,提示其具有良好生物相容性。
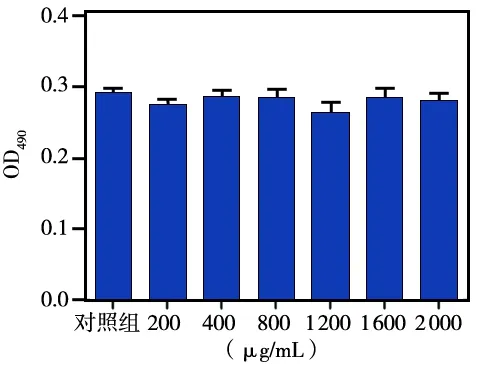
图5 不同浓度IPF/PECT对HGFs增殖的影响
2.5 IPF/PECT抗炎效果
抗炎实验结果显示,B组细胞培养液中的PGE2浓度在各时间点均较A组明显增高(P<0.05),说明0.1 μg/mL的LPS可刺激HGFs产生炎症反应。C组与B组相比,虽在24、48、72 h各时间点均能明显降低其PGE2浓度(P<0.05),但在10 h时降低不明显(P>0.05); C组除72 h时其PGE2浓度明显低于A组(P<0.05)外,其他各时间点的PGE2浓度仍均高于A组,但在10、48 h时两者差异均有统计学意义(P<0.05)。D组培养液中的PGE2浓度在各时间点均明显低于A、B、C各组(P<0.05),且随着培养时间的延长,PGE2浓度越来越低; 72 h时,PGE2浓度仅占C组的19.54%(图6)。以上结果提示,IPF/PECT的抗炎效果明显优于IPF。
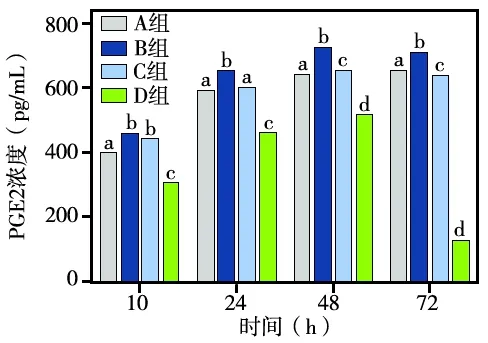
同一时间点内各组两两相比,不同字母组间P<0.05
3 讨论
牙周病的发生涉及一系列免疫反应和炎症过程。在免疫炎症过程中,机体产生的多种炎症因子与牙周组织破坏密切相关,Offenbacher等[4]报道,牙龈炎时龈沟液中的PGE2浓度高于健康牙龈,而在牙周炎的进展期其浓度则非常高。布洛芬[a-甲基-4(2-甲基丙基)苯乙酸, ibuProfen, IPF]为苯丙酸类非甾体抗炎药(non-steroid-anti-inflammatory-dugs,NSAIDs),其作用机制主要是通过抑制环氧化物酶(COX)的活性,降低PGs的合成,从而减少炎症和牙槽骨吸收,达到治疗牙周炎的作用[5]。
目前,聚己内酯/聚乙二醇(PCL/PEG)嵌段共聚物的温敏原位凝胶已在牙周局部给药方面得到了应用,但由于PCL具有强结晶性与疏水性,为了保证其能够形成凝胶并方便注射,在制备PCL/PEG凝胶时需先将聚合物溶液加热到60 ℃,然后再0 ℃淬灭,这不仅会影响蛋白质类药物的负载以及临床注射,同时还会使凝胶的降解和疏水药物的释放速率变慢,不适用于一些特定时间和位置的植入[6-8]。有研究认为,将 PLA或PGA嵌入到PCL中虽可改善其凝胶化和降解行为,但仍需要起始的高、低温孵化处理;而且改善后的凝胶降解速率依然太慢,并不能获得满意的药物释放行为[9]。本研究的PECT是通过将环醚基团引入PCL侧基,以改善PCL的结晶性和疏水性,不仅避免了PEG/PCL凝胶制备时所必须的高、低温处理,同时还适当加快了药物释放的速度,从而使上述问题得以解决[10-11]。本结果显示,IPF可持续释放32 d,累积释放量达85%;前9 d以线性关系释放药物,后期药物释放较缓慢,但趋势较稳定,无明显突释现象。药物释放前期的速率较快可能与药物需经载体降解而释放到外界有关,在释药初期由于载药凝胶的表面首先发生降解,且降解速率较快所以释药速率也较快;随着凝胶的继续降解,凝胶内部的药物才开始释放出来,加之凝胶内部降解较慢,所以后期的药物释放速率相对较小[12]。另外,载药纳米粒镶嵌于凝胶内,随着降解,IPF/PECT大部分以纳米粒的形式释放出来,且这一过程缓慢、稳定,所以无明显药物突释现象。生物相容性检测结果显示,当HGFs培养液中的PECT浓度从200 μg/mL增大到2 000 μg/mL时,各实验组的吸光度值均无明显变化,且与空白对照组相比无显著性差异(P>0.05),表明PECT具有良好的生物安全性。TEM观察发现,IPF/PECT NPs径粒较PECT NPs稍大,且大小均匀,无聚合现象。
体外细胞抗炎效果检测显示, IPF/PECT在各时间点的抗炎效果均明显优于IPF,且随着时间的延长,IPF/PECT组的PGE2浓度从占IPF组的70%下降到20%,说明其抗炎效果随作用时间而逐渐增强,分析其原因可能是:①IPF为疏水性药物,细胞摄取布洛芬水溶液内药物的能力较差,从而延缓了药物的作用时间[13]; ②PECT是环醚侧基修饰的新型三嵌段双亲性共聚物[聚(5-乙二醇缩酮-ε-己内酯-ε-己内酯)-聚乙二醇-聚(5-乙二醇缩酮-ε-己内酯-ε-己内酯)],PCL为疏水性物质、PEG为亲水性物质,从而使PECT或其纳米粒冻干粉均可在常温下快速溶解于水中,并形成稳定性良好的壳核结构的纳米粒水溶液;而载药IPF/PECT中的布洛芬为疏水性物质,当壳核结构形成时,布洛芬可与PECT的PCL疏水嵌段结合并被包裹于纳米粒壳核结构内部,同时使PEG的亲水嵌段外露于水中[14];另外,由于环醚侧基的引入又可赋予PCL一定的亲水性,这样整个IPF/PECT载药系统就具有了亲、疏水双亲性,既可使PECT能与布洛芬形成良好的结合关系,又可使IPF/PECT易溶于水中[15],而且因IPF/PECT部分亲水性的存在,使得细胞摄取药物的能力增强[13],从而提高了药物的作用效果。
牙周炎的治疗除必要的基础治疗、手术治疗等方法外,药物治疗也是一种不可或缺的辅助方法[16]。牙周局部缓释用药作为一种高效给药方法日渐受到人们的广泛关注并进行了大量的研究,特别是载体的生物相容性、制作工艺、缓释效果等特性更是研究的重点。IPF/PECT温敏凝胶具有制作简便、发生相转变迅速、药物大部分以载药纳米粒的形式释放等特点,加之其纳米粒呈亲、疏水双亲性,从而使细胞摄取药物的效率提高,抗炎效果增强。其中作用的环醚侧基修饰的PECT载体为双亲性新型原位温敏凝胶,其作为一种理想的局部缓释用药载体,有着十分广阔的应用前景。
[1]Bottino MC, Thomas V,Schmidt G,etal. Recent advances in the development of GTR/GBR membranes for periodontal regeneration- a materials perspective[J].DentMater,2012,28(7):703-721.
[2]Reddy MS,Geurs NC,Gunsolley JC.Periodontal host modulation with antiproteinase, anti- inflammatory, and bone-sparing agents.A systematic review[J].AnnPeriodontol,2003,8(1):12-37.
[3]王伟伟.环醚侧基修饰的PCL/PEG嵌段共聚物可注射温敏凝胶及肿瘤局部给药的研究[D]. 天津:天津大学, 2012.
[4]Offenbacher S, Heasman PA, Collins JG. Modulation of host PGE2 secretion as a determinant of periodontal disease expression[J].JPeriodontol,1993,64(5):432-444.
[5]Offenbacher S,Williams RC, Jeffcoat MK,etal. Effects of NSAIDs on beagle crevicular cyclooxygenase metabolites and periodontal bone loss[J].JPeriodontalRes,1992,27(3):207-213.
[6]Hyun H,Kim YH,Song IB,etal.In vitro and in vivo release of albumin using a biodegradable MPEG- PCL diblock copolymer as an in situ gel-forming carrier[J].Biomacromolecules, 2007,8(4):1093-1100.
[7]Moreira S,Gil Da Costa RM, Guardäo L,etal.In Vivo Biocompatibility and Biodegradability of Dextrin- based Hydrogels[J].JBIOACTCOMPATPOLYM, 2010,25(2):141-153.
[8]Moon SK,Hoon H,Kwang SS,etal.Preparation and characterization of MPEG- PCL diblock copolymers with thermo- responsive sol- gel- sol phase transition[J].JPolymSciA(PolymChemistry), 2006,44(18):5413-5423.
[9]Yun MK,Sang HL,Ju YL,etal.A biodegradable,injectable,gel system based on MPEG-b-(PCL- ran- PLLA) diblock copolymers with an adjustable therapeutic window[J].Biomaterials, 2010,31(9):2453-2460.
[10]Lv Z,Chang L,Long X,etal.Thermosensitive in situ hydrogel based on the hybrid of hyaluronic acid and modified PCL/PEG triblock copolymer[J].CarbohydrPolym, 2014,108:26-33.
[11]Wang W,Deng L,Huang P,etal.Toxicity and in vivo biological effect of the nanoparticular self- supported hydrogel of a thermosensitive copolymer for non- invasive drug delivery[J].JBiomedMaterResA,2014,102(1):17-29.
[12]Xu S,Wang W,Li X,etal. Sustained release of PTX- incorporated nanoparticles synergized by burst release of DOXHCl from thermosensitive modified PEG/PCL hydrogel to improve anti- tumor efficiency[J].EurJPharmSci, 2014,62:267-273.
[13]Zhang X,Zhang Z,Su X,etal.Phenylboronic acid- functionalized polymeric micelles with a HepG2 cell targetability[J].Biomaterials, 2013,34(38):10296-10304.
[14]Wang WW,Deng LD,Xu SX,etal.A reconstituted “two into one” thermosensitive hydrogel system assembled by drug- loaded amphiphilic copolymer nanoparticles for the local delivery of paclitaxel[J].JMatersChemB, 2013,1(4):552-563.
[15]Wang WW, Deng LD, Liu SS,etal.Adjustable degradation and drug release of a thermosensitive hydrogel based on a pendant cyclic ether modified poly(epsilon- caprolactone) and poly(ethylene glycol)co- polymer[J].ActaBiomater, 2012,8(11):3963-3973.
[16]Paquette DW,Ryan ME,Wilder RS.Locally delivered antimicrobials:clinical evidence and relevance[J].JDentHyg, 2008,82 (3):10-15.
Investigation of a novel PECT based drug delivery system of IPF loaded amphiphilic thermosensitive hydrogel
JIA Yu- rong*, YIN Li, HUANG Li- xun, WANG Yong- lan, DONG An- jie
(*StomatologicalHospitalofTianjinMedicalUniversity,Tianjin300070,China)
AIM: To investigate the biosafety, anti- inflammatory effect and drug-release property of a novel PECT- based drug delivery system of ibuprofen(IPF) loaded amphiphilic thermosensitive hydrogel. METHODS: IPF/PECT nanoparticles (IPF/PECT NPs) were manufactured by nanoprecipitation, then the particles were freeze-dried and dissolved into double distilled water to become a liquid solution. The morphology of the particles was observed by TEM, the anti- inflammatory effect of IPF/PECT nanoparticles was examined by MTT and ELISA with a human gingival fibroblasts(HGFs) based inflammation model. RESULTS: The particles were uniform-sized and no aggregation was observed. After loading different concentrations (0, 200, 400, 800, 1,200, 1,600 and 2,000 μg/mL respectively) of IPF/PECT, the means of OD value of HGFs were 0.29±0.01, 0.28±0.01, 0.29±0.02, 0.29±0.03, 0.29±0.03, 0.29±0.03, and 0.28±0.02 respectively (between each 2 groups,P﹥0.05). At every point-in-time, the IPF/PECT group showed lower PGE2 level than IPF group(P<0.05). The total release process could last for 32 days, with a cumulative release amount of 85%. CONCLUSION: The novel PECT-based drug delivery system is biocompatable with slow- releasing property and anti- inflammatory effect.
ibuprofen(IPF); hydrogel; amphiphilic; sustained- release; drug-loaded
2015-06-13
国家自然科学基金(81371667)
贾玉荣(1988-),女,汉族,河北衡水人。硕士生(导师:王永兰)
王永兰 ,E-mail: wyldoctor@qq.com
R781.4
A
1005-2593(2015)10-0587-05
天津市高等学校科技发展基金计划项目(20110410)
