周期性张应力对人牙周膜细胞Periostin表达的影响
2015-11-21赖玲芝吴补领徐会勇陈秋月刘庆娜
赖玲芝, 吴补领, 徐会勇, 陈秋月, 刘庆娜
(1. 南方医科大学南方医院; 2. 南方医科大学口腔医学院, 广东 广州 510515)
周期性张应力对人牙周膜细胞Periostin表达的影响
赖玲芝1,2, 吴补领1,2, 徐会勇1,2, 陈秋月1,2, 刘庆娜1,2
(1. 南方医科大学南方医院; 2. 南方医科大学口腔医学院, 广东 广州 510515)
目的: 研究在机械力作用下人牙周膜细胞(hPDLCs)内Periositn(PN)mRNA和蛋白的表达变化。方法: 采用组织块酶消化法培养hPDLCs,经鉴定后将第4代细胞随机分为4个实验组和1个对照组(非加力组),4个实验组分别采用Flexcell- 5000 Tension System应力加载系统对hPDLCs加载6、12、24、48 h的周期性张应力;然后采用qRT- PCR、Western blot分别检测各组hPDLCs中PN mRNA和蛋白的表达变化。结果: 在正常hPDLCs中表达PN mRNA和蛋白;与对照组相比,加力6 h后,PN mRNA和蛋白的表达水平均明显降低(P<0.05);加力12 h后,PN mRNA和蛋白的表达均逐渐升高,并持续至24 h达最高水平(P<0.05);而在加力48 h时,PN mRNA和蛋白表达均明显下降,并恢复至对照组的表达水平(P>0.05)。结论: 机械力可诱导hPDLCs中PN的表达增强及活化,且具有时间依赖性;提示PN可能参与了细胞内生物力学信号的转导。
周期性张应力; 人牙周膜细胞(hPDLCs); periositn; 牙周组织改建
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.02.004
[Chinese Journal of Conservative Dentistry,2015,25(2):79]
通过机械力启动牙周膜细胞的生理反应是正畸牙齿移动的直接原因,而细胞外基质的改建则是正畸牙齿移动的基础 。牙周膜细胞作为矫治力的直接效应细胞,当其受到机械应力作用时,会发生形态和功能状态的变化,并可通过特定的信号转导途径对机械力做出反应,从而引发一系列细胞生物学反应[1-3];在此过程中,不仅合成人牙周膜细胞外基质中大多数的各型胶原纤维和蛋白多糖,而且还通过分泌和合成多种多样的细胞因子与酶共同参与调节牙周组织的代谢和改建。
Periositn(PN)是新发现的一种多功能的细胞外基质蛋白,在骨膜和牙周膜中特异性表达,属成束蛋白( fasciclin) 家族成员,分子量为90 kD。近年来的一系列体内和体外研究表明,PN可促进纤维的分化和成熟,在维护牙周组织的完整性、牙齿的发育、萌出以及机械应激导致的组织修复和再生中发挥着重要的作用,被认为是一种对牙周膜稳态的调节起关键作用的细胞外基质蛋白[4];并推测其可能对正畸牙移动中牙周组织的改建也起着关键的作用。目前PN仅仅限于啮齿类动物的牙和牙周组织的体内外试验性研究,但从体外细胞基因和蛋白水平研究正畸牙齿移动过程中人牙周膜细胞(hPDLCs)中PN的表达变化尚未见报道。
本实验采用Flexcell- 5000 Tension System应力加载系统对体外培养的人牙周膜细胞加载周期性张应力,以模拟正畸牙齿移动过程中的施力方式,并通过qRT- PCR和Western blot测定机械张应力对hPDLCs中PN表达的影响,为进一步系统性探讨机械力作用下牙周组织改建的分子生物学机制奠定基础。
1 材料和方法
1.1 主要试剂和仪器
Ⅰ型胶原酶、2.5 g/L 胰酶(Gibco 公司,美国);胎牛血清(Corning 公司,美国);Trizol逆转录试剂盒、SYBR Green I荧光定量PCR试剂盒(Takara公司,日本);羊抗人、鼠多克隆PN抗体(Abcam公司,美国);PVDF膜(Millipore, 德国);Flexcell 5000XT 细胞力学装置(Flexcell公司,美国);倒置荧光显微镜(Olympus公司,日本);罗氏480荧光定量PCR仪(ABI公司,美国);电泳槽、电泳仪、电转仪制胶器(Amersham Biosciences公司,美国)。
1.2 hPDLCs的培养和鉴定
1.2.1 hPDLCs的分离和培养
取12~18岁志愿者因正畸减数而新鲜拔除的牙周组织健康的前磨牙,立即置于含双抗(青、链霉素)的DMEM培养液中,并用含双抗的PBS冲洗3遍;然后在无菌湿润条件下刮取根中1/3的牙周膜组织,用PBS冲洗并离心后加入200μLⅠ型胶原酶,37 ℃培养箱内消化10 min;终止消化并离心后,将组织块平整置于6孔板中,上盖无菌盖玻片,每孔加入2 mL含100 mL/L 胎牛血清的DMEM培养液,37 ℃、50 mL/L CO2孵箱中培养。次日首次换液,以后每3 d换液1次,并用倒置相差显微镜观察细胞生长情况;待细胞从组织块中爬出并铺满瓶底达80%时进行首次传代。
1.2.2 hPDLCs的鉴定
取第3代hPDLCs经2.5 g/L胰蛋白酶消化后,采用常规ABC免疫细胞化学染色法分别进行波形丝蛋白(Vmentin)、角蛋白 (Cytokeratin)染色,倒置相差显微镜下观察免疫组织化学染色结果,并判断是否符合中胚层来源的成纤维细胞样细胞的特征[5-7]。鉴定正确后,取第4~6代细胞用于后续实验。
1.3 细胞张应力加载
取生长状况良好的hPDLCs,以5×105/mL 的密度接种于包被I型胶原的BioFlex 6孔板弹性基底膜内,为使细胞同步化,在细胞继续生长密度达到80%时,更换含20 mL/L FBS为DMEM培养液,继续培养24 h。然后,将细胞随机分为4个实验组和1个对照组,4个实验组采用Flexcell- 5000 Tension System应力加载系统分别加载6、12、24、48 h;对照组不加力,在相同条件下静态培养。力学刺激满足形变率为10%,频率为0.5 Hz,波形为正弦波[8]。
1.4 qRT- PCR检测机械张应力作用下PN mRNA的表达
应力加载结束后,用Trizol法提取各组细胞的总RNA,并用Takara逆转录试剂盒合成cDNA。然后以cDNA为模板,以GAPDH为内参,用SYBR Select Master Mix试剂盒和罗氏480荧光定量PCR仪进行qRT- PCR检测;所用引物由英潍捷基(上海)贸易有限公司合成,具体序列见表1;反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,95 ℃延伸15 s,循环40次。利用罗氏480荧光定量PCR System联机软件进行Ct值相对定量分析,分别计算各组PN mRNA相对表达量。每组3个平行孔,实验重复3次。

表1 PCR引物序列
1.5 Western blot检测周期性张应力作用下PN蛋白的表达
取应力加载结束后的各组细胞,分别在其BioFlex 6孔板的各孔中各加250 μL含PMSF的裂解液裂解细胞;细胞裂解后离心取上清液,加入20 μL 2×SDS 上样缓冲液混匀,煮沸3~5 min后离心取上清进行 SDS- PAGE蛋白电泳。电泳结束后将目的蛋白转印至PVDF膜上,并将其放入平皿中;加入封闭液摇动封闭1 h后,再加入用封闭液稀释的一抗(1 ∶500)摇动孵育1 h,并4 ℃过夜;分别用PBS洗膜3次(每次5~10 min)、TBS洗膜1次(每次5~10 min)后,加入TBS配制的10 g/L脱脂奶粉溶液稀释的二抗(1 ∶1000),37 ℃摇动反应 1~2 h;再次用TBS洗膜3次(每次5~10 min)后用电化学发光显色剂进行显色,暗室下曝光显影,并用Quanlity one分析软件对条带灰度值进行半定量分析。
1.6 统计学分析
采用SPSS 13.0统计软件进行统计分析,所得结果经正态性及方差齐性检验后,采用单因素方差分析对总体进行比较,若方差齐,组间两两比较用LSD检验;若方差不齐,则选用Dunnett's T3检验。检验水准α=0.05。
2 结果
2.1 hPDLCs的培养及鉴定结果
2.1.1 hPDLCs形态学观察
组织块酶消化法连续培养5~10 d时,可见细胞从组织块中游出,并以组织块为中心成放射状、漩涡状生长,有时互相连接成网状;细胞均呈长梭形或星形,核为圆形或椭圆形,位于细胞中央,细胞透明度大,折光性强,轮廓不清(图1)。 传代扩大培养后,细胞贴壁性能良好,并可稳定传代(图 2)。
2.1.2 细胞来源鉴定结果
免疫组化染色结果显示:细胞抗波形丝蛋白染色阳性,胞浆内棕黄色,阳性颗粒分布均匀,胞核清晰无染色(图3);而抗角蛋白染色阴性(图4)。表明所培养的细胞符合中胚层来源的成纤维细胞样细胞的特征。
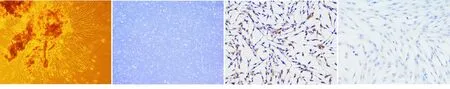

图1 hPDLCs原代培养第7天(×100)图2 第3代hPDLCs(×40)图3 抗波形蛋白阳性染色图(×100)图4抗角蛋白阴性染色图(×100)
2.2 加力不同时间对hPDLCs PN mRNA表达的影响
在正常hPDLCs内表达PN,加载张应力6 h后,PN表达降低,而加力12 h后,PN表达开始增强,并持续增强至加力24 h达最高峰,加力48 h后开始减弱;其中加力6 h和24 h组分别与对照组相比,差异均有统计学意义(P<0.05),而加力12 h和48 h组与对照组相比,差异均无统计学意义(P>0.05)(图5)。
2.3 加力不同时间对hPDLCs PN蛋白表达的影响
经Western blot检测结果显示,各组PN蛋白的表达与mRNA的表达变化一致,即在正常hPDLCs中有PN蛋白的表达,与之相比,PN蛋白的表达在细胞加载张应力6 h时,明显降低(P<0.05); 加力到12 h后开始升高并达到对照组水平(P<0.05);加力24 h时,达到最高(P<0.05);而在加力48 h时开始下降,恢复至对照组的表达水平(P>0.05)(图6)。

图5 加力不同时间点hPDLCs PN mRNA的表达变化

图6 加力不同时间点hPDLCs PN蛋白的表达变化
3 讨论
本结果显示,hPDLCs中的PN基因和蛋白表达水平在应力作用下有明显的变化,并具有时间相关性。但是,由于hPDLCs在口腔内处在复杂的力学环境中,使得实验条件不易控制,无法从单一因素来研究力学刺激对hPDLCs的结构、功能的影响。因此,应用体外细胞加力装置,研究细胞如何精确地控制并模拟生物牵张力对细胞增殖、分化及凋亡的影响越来越受到国内外学者的关注。目前广泛应用的力学模型有:离心力加载装置[9]、流体剪切力加载装置[10]、基底形变加载装置[11]等,其中基底形变加载装置产生的主要是牵张力,与牙周膜细胞在口腔内主要受牵张力的影响基本一致[12]。所以本实验采用目前应用最广泛、最理想的Flexcell 5000XT 体外细胞拉伸加力装置[13],以模拟正畸牙移动过程中的方式;并探讨机械张应力对hPDLCs 表达PN的影响。
本实验中发现,周期性张应力刺激6 h组的 hPDLCs中 PN的mRNA和蛋白表达水平均较对照组明显减弱,但在加力12 h后,两者的表达均出现回升。提示,在应力作用的早期阶段,受力细胞可能对应力刺激做出了保护性反应;随着加力时间的延长,细胞逐渐适应了应力的作用并随之做出积极的反应,同时也说明hPDLCs对张应力的适应较快。加力24 h后,hPDLCs 中的PN mRNA和蛋白的表达水平均达到最高峰(P<0.05);而在加力48 h 时,两者的表达均有所下降,并恢复至对照组的表达水平(P>0.05),表明在周期性张应力作用下,适宜的加力时间可促进PN的表达,但过长的时间会降低PN的表达。该结果与Wilde等[14]的研究结果一致,Wilde等对7周龄雄性SD大鼠进行实验性牙移动,并在加力后不同时间点测量其牙周膜中PN mRNA的表达;结果显示,加力24 h后PN mRNA的表达最强,牙齿移168 h后PDL中PN mRNA的表达表现出与对照类似的分布。Wen等[8]在研究TGF- β1和FAK对Periostin在牙周成纤维细胞中表达的调节作用时发现,当单轴应力循环加载于牙周成纤维细胞48 h后,其Periostin的mRNA表达水平高于加力24 h组,与本结果有所不同。分析原因可能与加力方式不一致有关,加之Wen等的实验仅设计两个加力时间点和一个基因水平检测指标;而本实验设计了4个时间点,并分别从基因水平和蛋白水平同时分析hPDLCs 内PN的表达,更具有代表性。近年来已有不少学者研究了机械力对牙周膜细胞表达PN的影响,Rios等[15]报道,人工诱导的大鼠咬合功能减退,可使其牙周膜细胞中的PN mRNA会出现暂时性的表达降低。fanador等[16]发现,小鼠右下颌磨牙的咬合功能减退后,其牙周膜细胞中的PN表达水平明显下降。Iekushi等[17]发现,机械力牵拉心肌细胞和成纤维细胞均可使骨膜蛋白的表达上调。以上研究均表明,PN是力学敏感的一种细胞因子,并高表达于牙周组织。虽然上述研究的对象、方法、结果不尽相同,但PN在hPDLCs中的表达均在应力作用下发生了变化,提示PN可能在正畸牙移动时的牙周组织改建过程中发挥积极的作用。
现在 PN与TGF- β1的关系越来越受各界的关注,多项研究表明PN参与多个系统疾病的发生发展,且其表达与 TGF- β1密切相关。PN作为TGF- β1的下游因子,具有趋化心肌纤维细胞、促进胶原的合成和成熟的作用;并可促进形成稳定的胶原网而参与胶原重构[18]。PN蛋白参与反馈机制主要通过TGF- β1信号系统刺激,由αv-整联蛋白阳性的成纤维细胞表达,生成的PN蛋白能够进一步增加纤维细胞的移动性、收缩性及其合成基质蛋白的能力;PN在这一反馈机制中成为板机点。但TGF- β1信号相关通路是否也介导了正畸牙移动中PN对牙周膜改建的作用尚不清楚,有待进一步研究。
[1]Dangaria SJ, Ito Y, Walker C,etal. Extracellular matrix- mediated differentiation of periodontal progenitor cells[J].Differentiation, 2009, 78(2-3):79-90.
[2]Rawlinson SC, Pitsillides AA, Lanyon LE. Involvement of different ion channels in osteoblasts' and osteocytes' early responses to mechanical strain[J].Bone, 1996, 19: 609- 614.
[3]Pender N, McCulloch CAG. Quantitation of actin polymerization in two human fibroblast subtypes responding to mechanical stretching[J].JCellSci, 1991, 100: 187- 193.
[4]Padial- Molina M, Volk SL, Rodriguez JC,etal. Tumor Necrosis Factor- α and Porphyromonas gingivalis Lipopolysaccharides Decrease PNin Human Periodontal Ligament Fibroblasts[J].JPeriodontolo, 2013, 84(5): 694-703.
[5]Fini M, Motta A, Torricelli P,etal. The healing of confined critical size cancellous defects in the presence of silk fibroin hydrogel[J].Biomaterials, 2005, 26(17): 3527-3536.
[6]Li C, Vepari C, Jin HJ,etal. Electrospun silk- BMP- 2 scaffolds for bone tissue engineering[J].Biomaterials, 2006, 27(16): 3115-3124.
[7]Altman GH, Horan RL, Lu HH,etal. Silk matrix for tissue engineered anterior cruciate ligaments[J].Biomaterials, 2002, 23(20): 4131-4141.
[8]Wen W,Chau E,Jackson- Boeters L,etal. TGF- β1 and FAK regulate Periostin expression in PDL fibroblasts[J].JDentRes,2010,89(12):1439-1443.
[9]Nakashima K, Zhou X, Kunkel G,etal. The novel zinc finger- containing transcription factor osterix is required for osteoblast differentiation and bone formation[J].Cell, 2002, 108(1): 17-29.
[10]Kapur S, Baylink DJ, William Lau KH. Fluid flow shear stress stimulates human osteoblast proliferation and differentiation through multiple interacting and competing signal transduction pathways[J].Bone, 2003, 32(3): 241-251.
[11]Liu J, Zou L, Zheng Y,etal. NF- κB responds to mechanical strains in osteoblast- like cells, and lighter strains create an NF- κB response more readily[J].CellBiolInt, 2007, 31(10): 1220-1224.
[12]Gooch KJ, Tennant CJ. Mechanical forces: their effects on cells and tissues[M].NewYork:Springer, 1997.
[13]Bouchareb R, Boulanger MC, Fournier D,etal. Mechanical strain induces the production of spheroid mineralized microparticles in the aortic valve through a RhoA/ROCK- dependent mechanism[J].JMolecularCellularCardiology, 2014, 67: 49-59.
[14]Wilde J, Yokozeki M, Terai K,etal. The divergent expression of PNmRNA in the periodontal ligament during experimental tooth movement[J].CellTissueResearch, 2003, 312(3): 345-351.
[15]Rios HF, Ma D, Xie Y,etal. PNis essential for the integrity and function of the periodontal ligament during occlusal loading in mice[J].Jperiodontol, 2008, 79(8): 1480-1490.
[16]Afanador E, Yokozeki M, Oba Y,etal. Messenger RNA expression of PNand Twist transiently decrease by occlusal hypofunction in mouse periodontal ligament[J].ArchivesOralBiology, 2005, 50(12): 1023-1031.
[17]Iekushi K, Taniyama Y, Azuma J,etal. Novel mechanisms of valsartan on the treatment of acute myocardial infarction through inhibition of the antiadhesion molecule periostin[J].Hypertension, 2007, 49(6): 1409-1414.
[18]Ellmers LJ, Scott NJ, Medicherla S,etal. Transforming growth factor- β blockade down- regulates the renin- angiotensin system and modifies cardiac remodeling after myocardial infarction[J].Endocrinology, 2008, 149 (11): 5828-5834.
Expression of Periositn mRNA and protein in cultured human periodontal ligament cells after cyclic stretch
LAI Ling- zhi*, WU Bu- ling, XU Hui- yong, CHEN Qiu- yue, LIU Qing- na
(*Dept.ofStomatology,NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
AIM: To observe the effects of cyclic stretch on the expression of periositn(PN) in human periodontal ligament cells(hPDLCs). METHODS: Primary hPDLCs were cultured by tissue block enzymolytic method. Cells were subjected to cyclic stretch by Flexcell FX- 5000T system at 0.5 Hz of 10% elongation for 6, 12, 24 and 48 hours respectively. The mRNA and protein expression of PN were measured by qRT- PCR and western blot respectively. RESULTS: PN mRNA and protein were positively expressed in control hPDLCs. PN mRNA and protein were decreased after 6- hour cyclic stretch, then increased after 12- hour cyclic stretch and reached to the highest level after 24- hour treatment(P<0.05). After 48 hour treatment, PN expression began to decline, consistent with the expression level of the control cells. CONCLUSION: Cyclic stretch may change the expression level of PN in hPDLCs in a time- dependent manner. PN may plays an important role in cell signal transduction of mechanical strain.
cyclic stretch; human periodontal ligament cells(hPDLCs); periositn(PN); periodontal tissue remodeling
2014-08-13
广东省高等学校人才引进科研资助项目(C1030270)
赖玲芝(1985-),女,汉族,广东人。硕士生(导师: 吴补领)
吴补领,E-mail:bulingwu0605@yahoo.com
R780.2
A
1005-2593(2015)02-0079-05
