两种不同植物来源果胶低聚糖的抑菌性能研究
2015-11-20沈雪亮张建勋章银军汪钊
沈雪亮,张建勋,章银军,汪钊
(浙江工业大学生物与环境工程学院,浙江杭州310014)
两种不同植物来源果胶低聚糖的抑菌性能研究
沈雪亮,张建勋,章银军,汪钊
(浙江工业大学生物与环境工程学院,浙江杭州310014)
探讨了向日葵果胶低聚糖和柑橘果胶低聚糖的抑菌活性。以食品中常见的大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌为对象,研究了不同聚合度的两种不同来源的果胶低聚糖抑菌活性,同时测定了不同聚合度的果胶低聚糖的最小抑菌浓度。结果显示在聚合度为15~50的情况下,向日葵果胶低聚糖和柑橘果胶低聚糖的抑菌活性最好。相同浓度下,柑橘果胶低聚糖对大肠杆菌和枯草芽孢杆菌的抑菌活性高于向日葵果胶低聚糖,对金黄色葡萄球菌抑菌活性要低于向日葵果胶低聚糖。向日葵果胶低聚糖和柑橘果胶低聚糖对三种菌的最小抑菌浓度为0.06~0.6 mg/mL。
向日葵果胶低聚糖;柑橘果胶低聚糖;抑菌活性;最小抑菌浓度
果胶低聚糖,称为果胶低聚糖或者低聚半乳糖醛酸,是由2~20个半乳糖醛酸通过a-1,4-糖苷键连接而成的功能性低聚糖,部分半乳糖醛酸的残基以甲酯形式存在[1]。果胶低聚糖存在于所有高等植物中,结构随植物种类、组织部位、生长条件和环境因素等条件的不同而发生细微的变化。由于果胶结构的复杂性与多变性,利用降解果胶的方法得到果胶低聚糖的结构也相对复杂[2]。
果胶低聚糖具有增殖双岐杆菌、抑制有害菌增长、调整肠道菌群平衡性等功能[3]。1970年,ELNakeeb报道果胶寡糖有抑制微生物生长的作用;1984年,日本山梨大学横土冢弘毅教授等在研究中发现,以酶分解果胶而得到的果胶分解物具有很强的抗菌作用。研究表明DP值1~8的寡聚半乳糖醛酸在pH值小于7的条件下,有抑菌性作用[4]。本文通过对向日葵果胶低聚糖和柑橘果胶低聚糖抑菌活性的研究,为其在新型食品防腐剂的开发应用上提供理论依据。
1 材料与方法
1.1实验材料
向日葵盘粉末和柑橘果胶分别添加100 U/g的果胶酶(酶活力28 866 U/mL,浙大百川),酶解pH为5.2,酶解温度50℃,酶解6 h得到酶水解液,水解液分别经过截留分子量为1 000、3 000、10 000、30 000 Da的超滤膜截留得到不同聚合度(DP)的向日葵果胶低聚糖(SPO)和柑橘果胶低聚糖(CPO):U1(0<Mw<1 000,0<DP<5)、U2(1 000<Mw<3 000,5<DP<15)、U3(3 000<Mw<10 000,15<DP<50)、U4(Mw>10 000,DP>50)。
1.2菌种
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococus eureus)、枯草芽抱杆菌(Bacillus subltillus),均由本实验室提供。
1.3培养基
细菌培养基(牛肉膏蛋白胨培养基)(g/L):牛肉膏3,蛋白胨10,氯化钠5,琼脂15~20,pH 7.0~7.2。
牛肉膏蛋白胨液体培养基:除不加琼脂外,其他配方同牛肉膏蛋白胨固体培养基。
1.4培养方法
金黄色葡萄球菌、大肠杆菌、枯草芽抱杆菌菌种在无菌操作环境下划线,接种于已经准备好的牛肉膏蛋白胨斜面培养基上。将斜面放置于隔水式电热恒温培养箱内37℃培养约2~3 d,待菌落长好后重新划线接种于新的牛肉膏蛋白胨培养基上,在同样的条件下进行二次培养。
1.5实验方法
1.5.1SPO和CPO的单糖组成测定
样品制备:分别称取2 mg SPO和CPO样品,置于带塞梨型瓶中,加入4 mL三氟乙酸(2 mol/L,TFA),于110℃下密封水解2 h。取出水解液冷却至室温,然后在低于40℃条件下减压蒸干,再加入3 mL甲醇,减压浓缩蒸干,重复4~5次,完全除去三氟乙酸。然后按照文献[5]衍生化的操作步骤进行衍生化,得到的样品低温贮存备用。
色谱条件:采用Waters公司的Waters 1525泵和Waters 2487紫外检测器的高效液相色谱进行分析,采用Symmetry C18柱,流动相为乙腈∶醋酸铵(pH 5.5)=22∶78,流速为0.8 mL/min,进样量10 μL,在245 nm处检测单糖衍生物。
1.5.2SPO和CPO的红外光谱分析
分别取2~3 mg干燥后的样品,经溴化钾(KBr)压片后,在4 000~400 cm-1范围内扫描红外吸收,用Tensor27型傅立叶红外光谱仪记录样品的红外光谱。
1.5.3 SPO和CPO的抑菌性测定
菌悬液的制备:试验菌株经活化培养后,用已灭过菌的移液管移取10 mL无菌生理盐水至斜面试管内,在无菌操作条件下用接种环小心将菌苔洗下。倒入带有玻璃珠的烧瓶内,将菌悬液打散,保证浓度的均一性,并用10倍稀释法将菌液稀释,采用平板计数法计数,配制菌浓度为1× 107~1×108cfu/mL的菌悬液。
抑菌圈直径的测定:将灭过菌的培养基倒入培养皿,待其冷却凝固后,再各吸取0.2 mL菌(孢子)悬液到平板上用无菌涂布棒涂布均匀,然后将3个灭过菌的牛津杯平稳地放在培养基表面上,保证各牛津杯之间距离相当。用移液枪移取200 μL配置好的一定浓度的水解液至牛津杯中,以无菌水作为对照。每种浓度重复做3次,最后将平皿放置于培养箱中37℃培养24 h。取出培养皿测量抑菌圈直径大小,并取3组实验值的平均值作为记录。
1.5.4SPO和CPO最小抑菌浓度测定
果胶低聚糖用培养基配成不同浓度的溶液,对照样品除不加果胶低聚糖外,其他条件一致。培养基121℃灭菌20 min。待培养基冷却后再接入0.2 mL实验菌悬液,充分振荡均匀,使各管中含菌量为1×106~1×107cfu/mL,放置于培养箱中37℃培养24 h。然后再从各管中取出培养液0.2 mL,涂布于牛肉膏蛋白胨培养基平板上,继续培养24 h。培养完成后观察有无菌落生长,若有菌落生长,记为(+),相反则为(-),每种处理做3个平行。以无菌生长的最低的果胶低聚糖浓度为果胶低聚糖的最低抑菌浓度(简称为MIC值)。
2 结果与讨论
2.1SPO和CPO的单糖组成
SPO和CPO的单糖组成见表1,SPO主要由甘露糖、鼠李糖、半乳糖醛酸、半乳糖和少量的木糖、葡萄糖和阿拉伯糖组成;CPO主要由甘露糖、鼠李糖、半乳糖醛酸、半乳糖和少量的葡萄糖和阿拉伯糖组成,CPO中没有检测到木糖。SPO中的鼠李糖没有CPO中含量高,但是阿拉伯糖高于CPO。可能原因是由于不同的生长环境,不同的植物组织中糖的组成和含量有所不同。

表1 SPO和CPO的单糖组成
2.2SPO和CPO的红外光谱分析
SPO和CPO的红外光谱图如图1所示。从图中可以看出两种果胶低聚糖在3 417 cm-1左右有宽而强的吸收峰,该峰是糖分子中-OH基团的伸缩振动吸收峰;2 936 cm-1左右的吸收峰是C-H的伸缩振动峰;1 633.8~1 733.4 cm-1区间的吸收峰是多糖结合水而引起的水合振动峰或C=O引起的吸收峰;950和1 148 cm-1为吡喃环的伸缩振动强带。CPO在1 633 cm-1和1 733 cm-1附近有吸收,分别为自由和酯化羧基的振动。而SPO只在1 625 cm-1处有吸收,在1 733 cm-1附近没有吸收,说明SPO是一个低酯化度的果胶分子,在结构上与CPO存在差异。
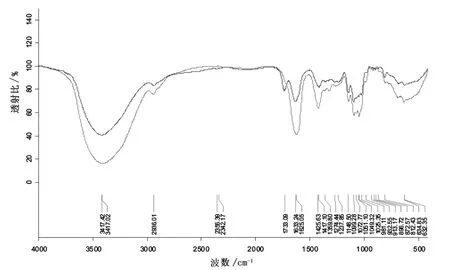
图1 SPO(红色)和CPO(黑色)的红外光谱图
2.3果胶低聚糖对枯草芽孢杆菌的抑菌活性分析
通过对比分析向日葵盘果胶低聚糖与柑橘果胶低聚糖同一聚合度不同浓度以及同一浓度下不同聚合度的组分对枯草芽孢杆菌抑菌活性的影响,结果如图2所示。由于U1、U2、U3、U4在不同浓度下对枯草芽孢杆菌的抑菌趋势基本保持一致,仅显示U3超滤组分结果分析,如图2(a)。
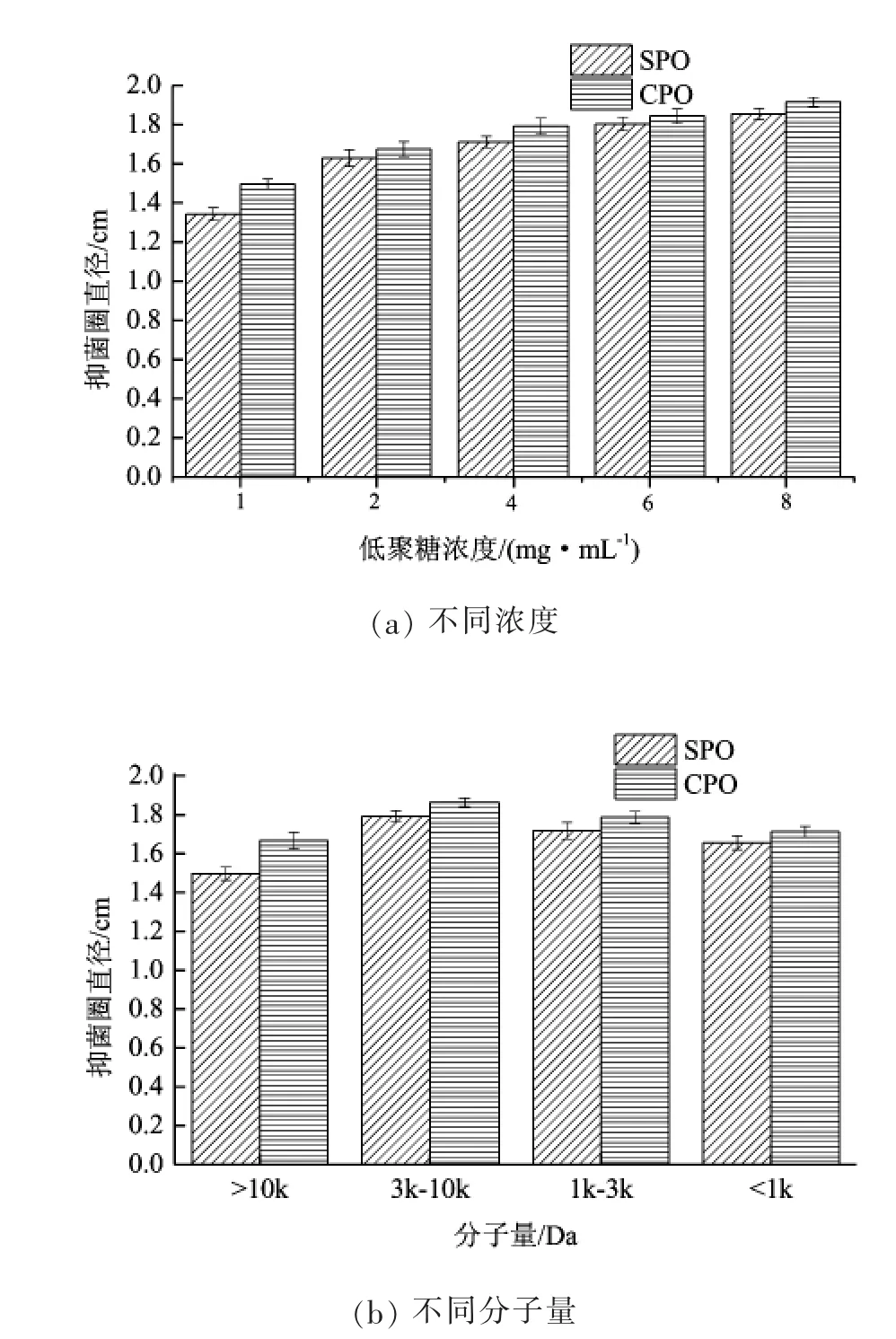
图2 果胶低聚糖对枯草芽孢杆菌的抑菌活性
从图2(a)可以看出在同一聚合度,不同浓度下,向日葵果胶低聚糖和柑橘果胶低聚糖对枯草芽孢杆菌的抑菌活性存在差异性。可能原因是活性物质的生理功能由其结构所决定,向日葵果胶低聚糖和柑橘果胶低聚糖糖分子结构上存在差异,糖组成和糖与糖之间的连接方式等影响其功能的发挥。随着浓度的增加,抑菌活性逐渐增强,前者对枯草芽孢杆菌的抑菌活性要比后者低。图2(b)可以看出,对于同一种菌,不同聚合度同一种浓度(6 mg/mL)条件下,对其抑制活性不同。两种类型的果胶低聚糖对枯草芽孢杆菌的抑制效果趋势相同。按抑制活性的高低排列为U3>U2>U1>U4。DP为15~50的抑制效果较明显,其他的聚合度对枯草芽孢杆菌抑制效果相差不大。
2.4果胶低聚糖对大肠杆菌的抑菌活性分析
通过对比分析向日葵果胶低聚糖与柑橘果胶低聚糖同一聚合度不同浓度以及同一浓度下不同聚合度的组分对大肠杆菌抑菌活性的影响,结果如图3所示。

图3 果胶低聚糖对大肠杆菌的抑菌活性
从图3(a)可以看出,从抑菌圈直径的大小来看,无论是向日葵盘果胶低聚糖还是柑橘果胶低聚糖,对大肠杆菌的抑制活性相比对枯草芽孢杆菌的活性要低。说明不同的菌株对果胶低聚糖的耐受力不一样。从图3(b)也可以看出,6 mg/mL浓度下不同聚合度的果胶低聚糖对大肠杆菌的抑制效果不同,其抑制活性的高低与果胶低聚糖对枯草芽孢杆菌的抑制结果一致。
2.5果胶低聚糖对金黄色葡萄球菌的抑菌活性分析
通过对比分析向日葵果胶低聚糖与柑橘果胶低聚糖同一聚合度不同浓度以及同一浓度下不同聚合度的组分对金黄色葡萄球菌抑菌活性的影响,结果如图4所示。

图4 果胶低聚糖对金黄色葡萄球菌的抑菌活性
从图4(a)可以看出,向日葵果胶低聚糖对金黄色葡萄球菌的抑制活性要强于柑橘果胶低聚糖,与两者对大肠杆菌和枯草芽孢杆菌的抑菌效果刚好相反。可能的原因是金黄色葡萄球菌对向日葵盘果胶低聚糖更敏感,导致自身代谢紊乱。两者在抑菌活性方面还是存在相应的差异。图4(b)显示的结果与果胶低聚糖分子对大肠杆菌和枯草芽孢杆菌的结果一致,聚合度15~50的低聚糖溶液对金黄色葡萄球菌抑制效果较好。
2.6果胶低聚糖的最小抑菌浓度分析
通过对果胶低聚糖对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的最小抑菌浓度的测定,各物质最小抑菌浓度见表2。
从表2可知,SPO和CPO对金黄色葡萄球菌和枯草芽孢杆菌的抑菌效果要比大肠杆菌好,最小抑菌浓度在0.06~0.10 mg/mL之间,对大肠杆菌的最小抑菌浓度在0.4~0.6 mg/mL之间。从表中也可以看出不同聚合度的果胶低聚糖对三种菌的抑菌活性不同,U2和U3的最小抑菌浓度要低于其他两种聚合度的低聚糖,其浓度为0.06~0.4 mg/mL。

表2 SPO和CPO的最小抑菌浓度
3 结论
SPO和CPO在单糖组成和酯化度上存在一定的差异,结构的不同可能导致功能的不同。相同浓度下,CPO对大肠杆菌和枯草芽孢杆菌的抑菌活性要高于SPO,对金黄色葡萄球菌抑菌活性要低于SPO。抑菌性存在的差异可能与SPO和CPO的结构差异有关。在聚合度为15~50的情况下,SPO和CPO的抑菌活性最好,其次为聚合度5~15。SPO和CPO对三种菌的最小抑菌浓度为0.06~0.6 mg/mL。
[1]BISHOP P D,MAKUS D J,PEARCE G,et al.Proteinase inhibitor-inducing factor activity in tomato leaves resides in oligosaccharides enzymically released from cell walls[J].Proceedings of the National Academy of Sciences,1981,78(6):3536-3540.
[2]AN H J,LURIE S,GREVE L C,et al.Determination of pathogen-related enzyme action by mass spectrometry analysis of pectin breakdown products of plant cell walls[J].Analytical Biochemistry,2005,338(1):71-82.
[3]丁长河,鲁慧芳,张建华,等.双歧因子果胶低聚糖的研究进展[J].现代食品科技,2005,21(4):80-82.
[4]谷利伟,赵金兰.日本低聚糖开发新动态[J].食品与机械,1999(2):27-28.
[5]TIAN Lingmin,ZHAO Yan,GUO Chao,et al.A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata[J].Carbohydrate Polymers,2011,83(2):537-544.
(责任编辑:朱小惠)
Study on antibacterial activity of two plant derived pectin oligosaccharides
SHEN Xueliang,ZHANG Jianxun,ZHANG Yinjun,WANG Zhao
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,China)
The antibacterial activity of sunflower pectin oligosaccharides(SPO)and citrus pectin oligosaccharides(CPO)was evaluated in this paper.The antibacterial activities of these two pectin oligosaccharides with different polymerization degrees were examined by determination of the minimum inhibitory concentrations against Escherichia coli,Staphylococcus aureus and Bacillus subtilis in food.The results showed that the 15-50 polymerization degree of SPO and CPO displayed the best antibacterial activity.Under the same concentration,the antibacterial activity of CPO against Escherichia coli and Bacillus subtilis was higher than that of SPO.However,the antibacterial activity of CPO against Staphylococcus aureus was lower than that of SPO.The minimum inhibitory concentration of SPO and CPO against these three kinds of bacteria was 0.06-0.6 mg/mL.
sunflower pectin oligosaccharides;citrus pectin oligosaccharides;antibacterial activity;minimum inhibitory concentration
TQ281
A
1674-2214(2015)03-0023-05
2015-04-16
浙江省重大科技专项(2009C12046)
沈雪亮(1977—),女,浙江杭州人,副教授,博士,研究方向为可再生资源生物转化,E-mail:shenxl_pat@aliyun. com.通信作者:汪钊教授,E-mail:hzwangzhao@163.com.
