单核苷酸多态性与华法林初始抗凝疗效和维持剂量的研究
2015-11-20邬升超张春燕宋斌斌王蓓丽潘柏申
吴 炯, 李 军, 邬升超, 张春燕, 宋斌斌, 王蓓丽, 郭 玮, 潘柏申
(1.上海复旦大学医学院附属中山医院检验科,上海200032;2.上海复旦大学医学院附属中山医院心外科,上海200032)
华法林是临床上防治静脉和动脉血栓栓塞疾病广泛使用的口服抗凝药物,主要针对有房颤、心脏瓣膜置换、深静脉血栓以及肺栓塞患者。患者通过检测血液国际标准化比值(international normalized ratio,INR),以 INR 是否进入 1.8~3.0的有效治疗范围来判断华法林抗凝治疗是否疗效。华法林本身狭窄的治疗窗以及个体代谢能力的差异导致抗凝不足或抗凝过量等问题一直无法得到很好的解决。
众多研究表明基因及非基因因素(种族、年龄、体重、胺碘酮等)共同对患者所需华法林剂量产生影响。基因因素公认与个体间华法林抗凝疗效存在显著相关性[1-5],包括华法林体内代谢与药物作用靶点相关基因(CYP2C9和VKORC1)以及维生素K1代谢循环中相关酶类的活性改变的相关基因(GGCX、EPHX1和 CYP4F2)[6-8]。我们通过选取不同的2组人群,研究包括 CYP2C9、VKORC1、GGCX、EPHX1、CYP4F2 在内的5 个基因共9个单核苷酸多态性位点对华法林初始抗凝疗效和维持剂量的影响,为临床上更安全、有效地使用华法林提供依据。
材料和方法
一、对象
1.初始抗凝疗效组 选取2012年10月至2013年3月在上海复旦大学附属中山医院心脏外科病区进行心脏瓣膜置换手术的汉族患者212例,其中男106例、女106例,年龄(53±13)岁。入组患者需满足以下条件:18周岁以上、心脏瓣膜置换术后即开始服用华法林、基础INR≤1.4、目标INR在1.8~3.0之间。同时临床医生均在对患者基因型不知情的情况下进行抗凝治疗,首剂量为2.5~3.75 mg(2.5 mg/片,华法林钠片)之间,之后根据INR的检测结果进行剂量调整。
2.维持剂量组 选取2012年10月至2013年3月在上海复旦大学附属中山医院就诊的汉族患者266例,其中男146例、女120例,年龄(61±14)岁。入选患者中房颤78例、心脏瓣膜置换120例、肺栓塞36例、深静脉血栓12例。所有患者均服用华法林3个月以上,通过调整达到稳定服药剂量(相隔7 d,2次INR检测结果均在1.8~3.0之间)。
上述两组患者均无既往肝肾疾病史,除胺碘酮外不服用其它会影响华法林药效的药物,如阿司匹林、氯吡格雷、肝素及维生素K等。
二、方法
1.标本和基本信息采集 (1)初始抗凝疗效组:在患者完成心脏瓣膜置换手术后,采用乙二胺四乙酸二钾(ethlene diamine tetraacetic acid-K2,EDTA-K2)抗凝管采集患者血液标本,通过查阅电子病历记录患者术后4 d内的基本信息,包括每日服用华法林剂量(mg)、每日INR检测结果、是否使用胺碘酮,3 d引流总量(mL)等;(2)维持剂量组:入组患者按要求于门诊随访时采用EDTA-K2抗凝管采集患者血液标本,同时记录近期INR检查情况、达到稳定状态后华法林剂量以及其它合并药物的使用情况。将采集的血液样本分装后置于-20℃保存。
2.基因组DNA抽提 使用基因组DNA抽提试剂盒提取基因组DNA,按照试剂盒提供说明书操作,测定DNA含量。
3.基因分型 使用Primer Premier 5.0软件针对 CYP2C9(rs1799853、rs1057910)、VKORC1(rs9923231)、CYP4F2(rs2108622)、GGCX(rs12714145)、EPHX1(rs1877724、rs2292566、rs4653436)基因位点设计引物,引物序列见表1,由上海生工生物工程有限公司合成引物。聚合酶链反应(polymerase chain reaction,PCR)扩增体系:上下游引物各 0.5 μL(10 μmol/L)、DNA 模板 4 μL(100~120 ng)、Premix TaqTMHot Start Version(TaKaRa)10 μL、去离子水5μL,反应总体积20μL。循环参数:95℃预变性5 min,94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸30 s,40个循环后72℃再延伸2 min。以2%琼脂糖凝胶电泳进行扩增片段长度验证,见图1。由华大基因科技股份有限公司进行测序,以Chromas软件判读基因型,见图2。
图1 PCR扩增产物琼脂糖凝胶电泳
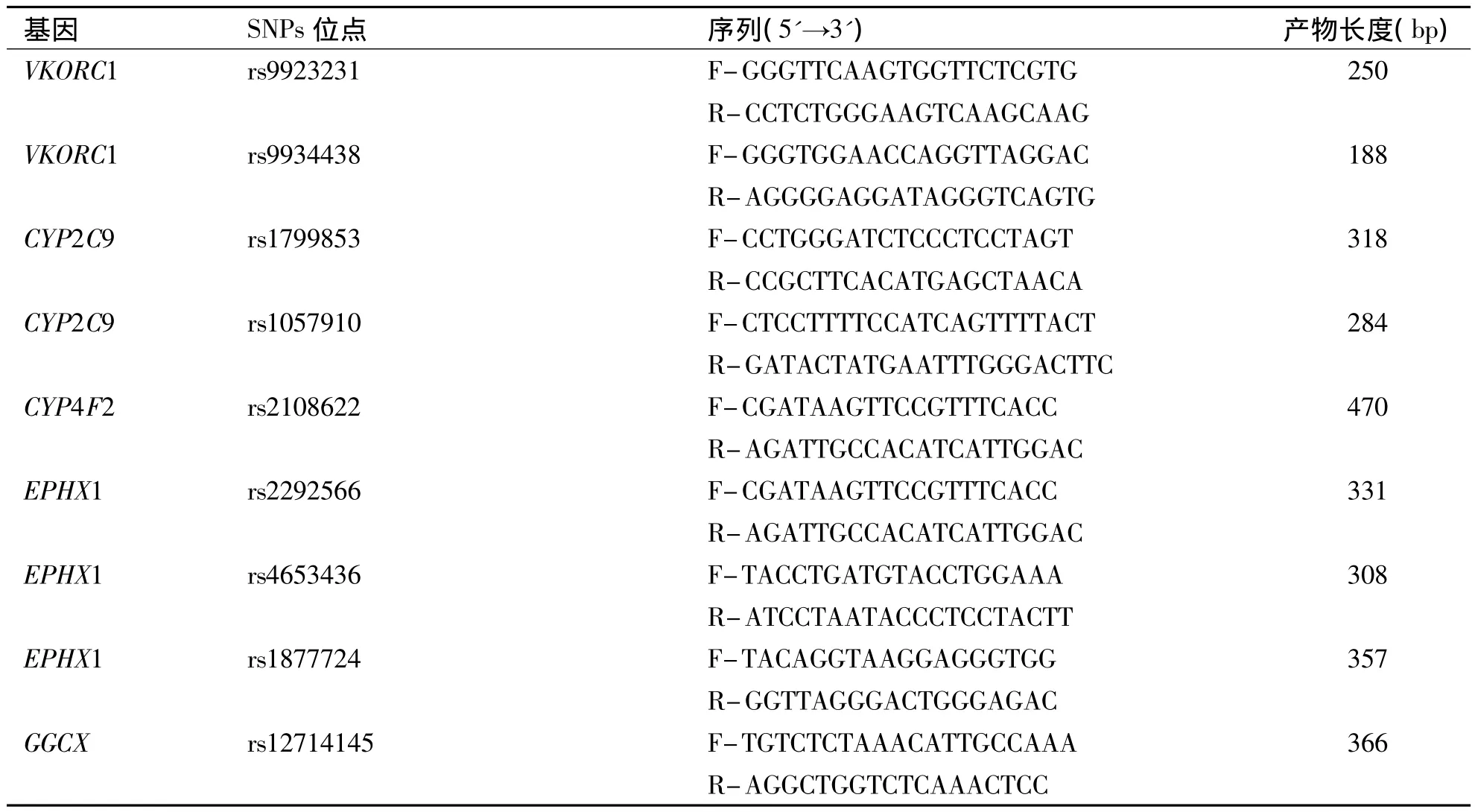
表1 华法林相关基因引物序列表

图2 测序法基因分型结果
4.观察指标的设定 患者服用华法林后的目标INR范围定义“有效治疗范围”(1.8~3)。(1)初始抗凝疗效组:设定初始抗凝疗效观测期为4 d。我们认为患者在以基本相同的经验性给药方式下进行抗凝治疗,在观测期结束时INR的结果与初始INR的差值可以反映初始抗凝的疗效,因此我们将该差值以△INR4-1表示。同时还设定了其它观测指标,包括首日服药后INR检测结果与初始INR值的差,以△INR2-1表示;INR进入治疗窗的例数;INR>3的例数;INR>4的例数;出血事件;(2)维持剂量组:将“达到稳定状态”定义为相隔7 d以上,在服用相同剂量华法林的情况下,2次INR检测结果均在治疗窗内,则该剂量即为患者华法林维持剂量。
三、统计学方法
采用SPSS17.0软件进行统计分析。使用卡方检验判断各SNPs的等位基因频率和基因型频率是否符合Hardy-Weinberg平衡(P>0.05)。正态分布的数据以±s表示,非正态分布的数据以中位数(四分位数间距)表示。非正态分布的数据如维持剂量,使用自然对数进行变换。采用Kolmogorov-Smirnov检验验证数据的正态性。符合正态分布的数据,如Ln(维持剂量)、体重、体表面积(body surface area,BSA)和年龄等以两独立样本t检验比较两组间的差异,以单因素方差分析比较多组间的差异。非正态分布的数据,如△INR4-1,2组间比较采用Mann-Whitney非参数检验。连续变量之间的相关性采用Pearson相关分析进行检验。以P<0.05为差异有统计学意义。
结 果
一、初始剂量组基本资料及初始抗凝疗效
初始剂量组共入组212例心脏瓣膜置换患者基本资料见表2。根据△INR4-1的结果,将其进行四分位分组后观察影响因素。基因因素中CYP2C9(rs1057910)、VKORC1(rs9923231)及EPHX1(rs2292566)对△INR4-1有明显影响(P<0.05)。CYP2C9(rs1057910)和 EPHX1(rs2292566)对三日内INR是否进入治疗范围有明显影响(P<0.001、P<0.05)。见表3。
筛选得到的基因 CYP2C9(rs1057910)、VKORC1(rs9923231)和 EPHX1(rs2292566)进一步分析显示,CYP2C9(rs1057910)AC/CC型患者的△INR4-1[中位数(四分位间距)]为1.10(0.87~1.41),明显高于 AA 型患者[0.69(0.30~1.05)](P<0.05)。VKORC1(rs9923231)AA 型患者的△INR4-1为0.81(0.45~1.25),明显高于GA 型患者[0.31(0.12~0.75)],P<0.05。EPHX1(rs2292566)GA/AA型患者的△INR4-1为0.84(0.45~1.22),明显高于 GG 型患者[0.63(0.27~0.97)](P<0.05)。见表4。
根据CYP2C9(rs1057910),VKORC1(rs9923231)和EPHX1(rs2292566)的基因型分组。结果显示CYP2C9基因AC/CC型患者服药3 d后INR进入治疗范围(1.8~3.0)的例数明显高于CYP2C9基因AA型(P<0.05),且并不受VKORC1基因型的影响。CYP2C9基因AA型和VKORC1基因AA型、EPHX1基因GA/AA型患者服药3 d后INR进入治疗范围(1.8~3.0)的例数明显高于EPHX1基因GG型(P<0.05)。见表5。
二、维持剂量组基本资料及维持剂量的研究
维持剂量组的患者基本资料见表2。平均每日华法林剂量为(3.01±1.05)mg,每日服用最高剂量为6.88 mg,最低为0.83 mg;平均每周华法林剂量为(21.02±7.45)mg,每周服用最高剂量为48.13 mg,最低为5.78 mg。
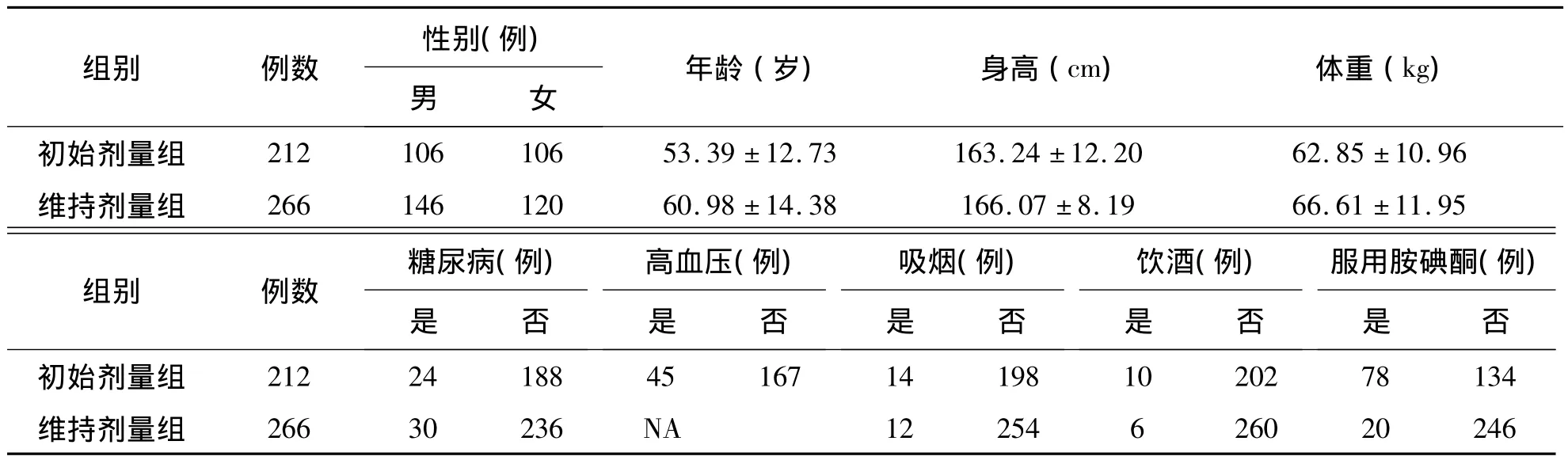
表2 入组患者基本信息
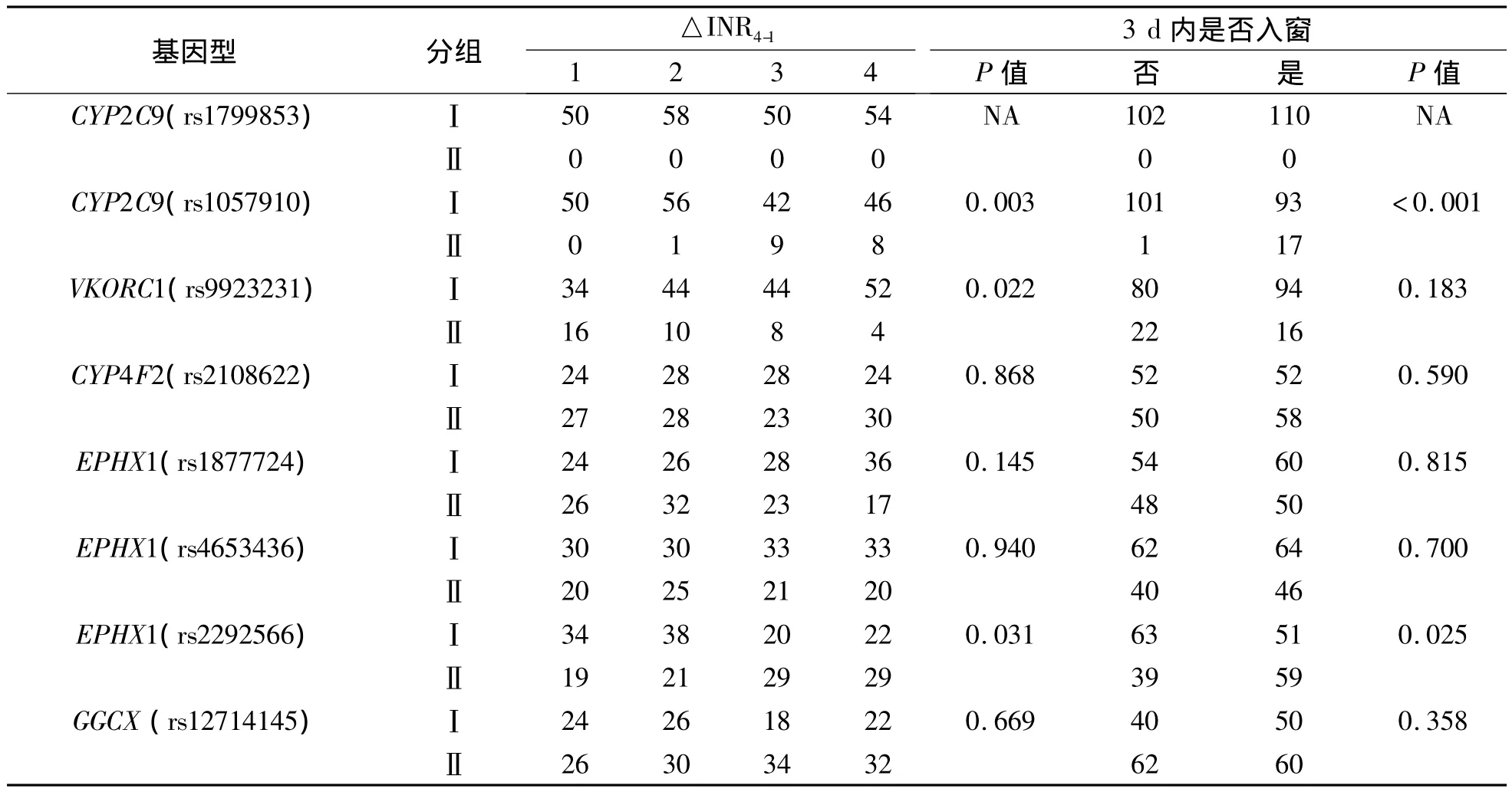
表3 初始疗效相关基因因素筛选
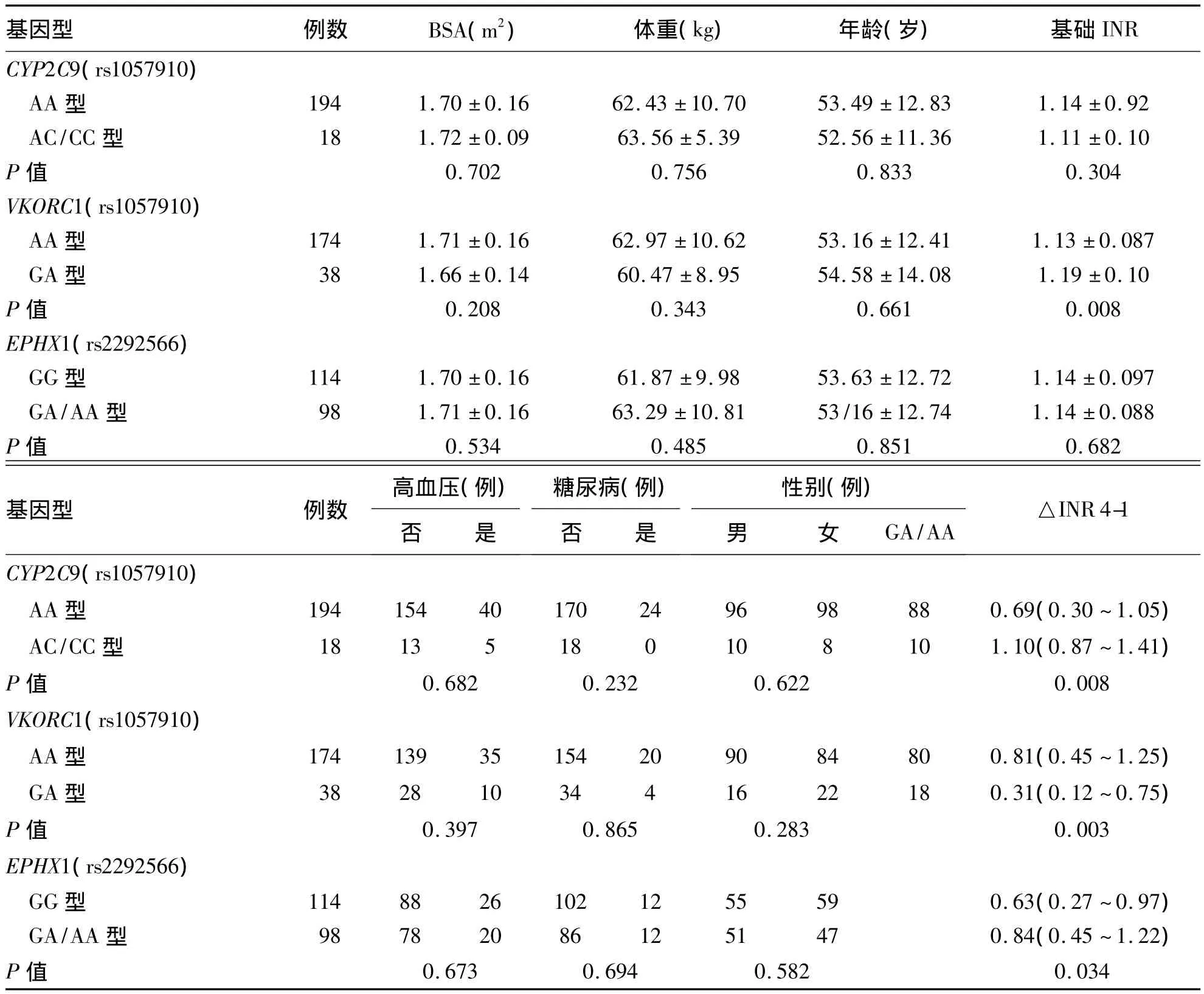
表4 不同基因型间的影响因素分析

表5 不同基因型间的终点事件的差异
CYP2C9(rs1057910)及VKORC1(rs9923231)之间每日华法林剂量及每周华法林剂量存在明显差异。非基因因素中,房颤患者华法林维持剂量为(2.91±0.88)mg/d、心脏瓣膜置换患者为(3.03±1.11)mg/d、肺栓塞患者为(3.27±1.42)mg/d、深静脉血栓患者为(2.86±0.61)mg/d,单因素方差分析显示不同病因组间华法林维持剂量差异无统计学意义(P<0.05)。单因素统计结果显示胺碘酮、体重、BSA、年龄吸烟、饮酒、糖尿病和性别均与维持剂量不相关。见表6。
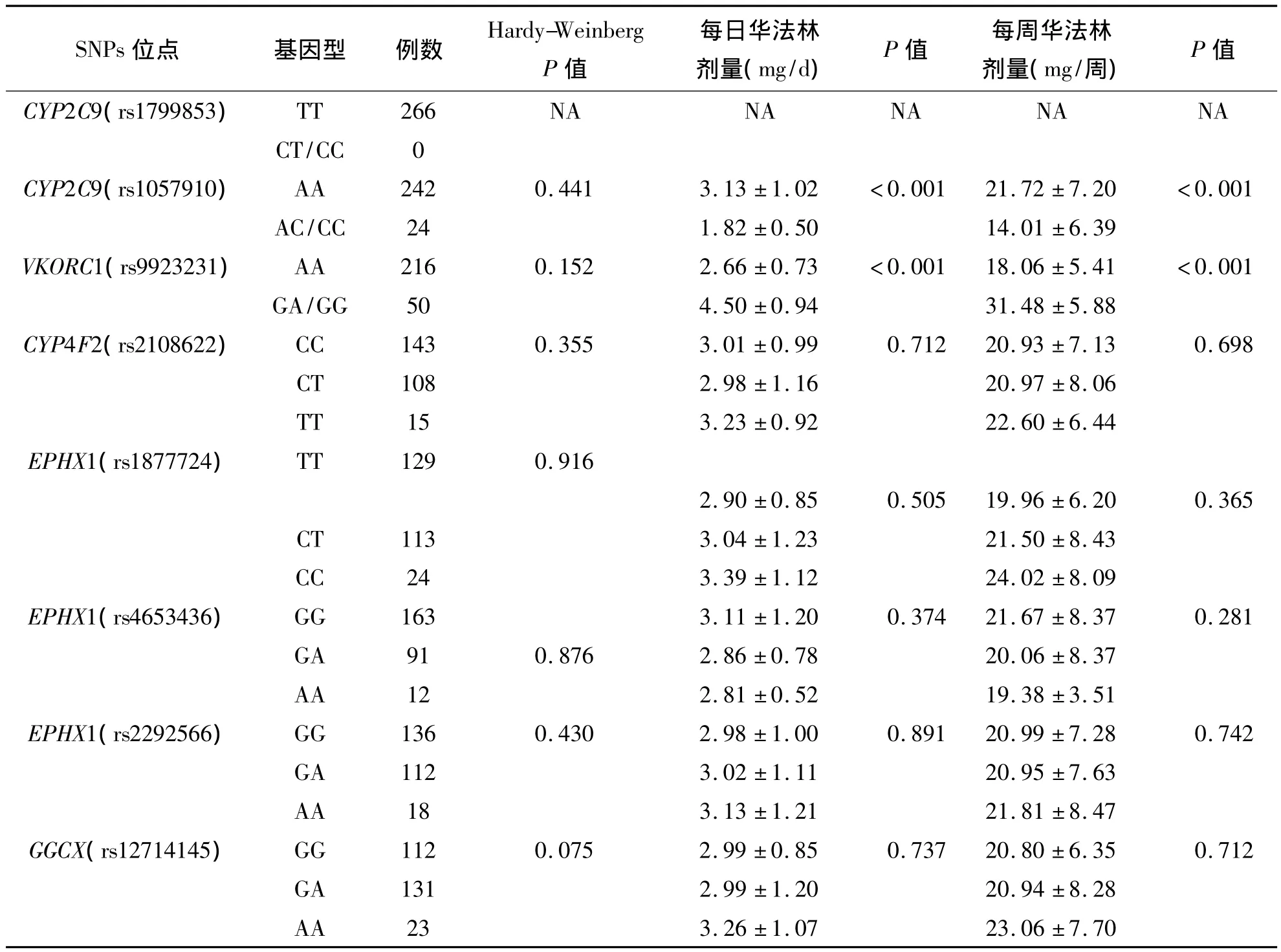
表6 华法林相关基因不同基因型间每日及每周华法林剂量的比较
讨 论
口服抗凝药物华法林广泛用于临床,主要面向静脉和动脉血栓栓塞疾病患者。但由于华法林个体间的剂量差异较大,受年龄、体重、相关基因多态性、其它药物使用和饮食习惯等的影响。近年来,对于华法林药物基因组学的研究主要关注初始抗凝治疗阶段和维持剂量。初始抗凝阶段研究中所涉及的基因主要以CYP2C9和VKORC1为主[3-5],而针对维持剂量的研究除和华法林代谢和作用相关的基因外,还包含与维生素K1体内循环和代谢相关的基因如CYP4F2、GGCX和EPHX1等[6-8]。大多数研究均以非中国人群为研究对象。众多研究均显示基因突变的频率存在显著的种族差异,因此需要研究多基因对中国汉族人群在华法林初始抗凝疗效和维持剂量的影响。
本研究包括初始抗凝疗效和维持剂量两方面。针对初始抗凝疗效,国内学者主要研究的是CYP2C9和 VKORC1[4-5]。但除上述 2个基因以外,我们还对CYP4F2、GGCX和EPHX1这3个基因共5个SNPs位点对初始抗凝疗效的影响进行了研究。同时还设定了初始抗凝疗效观测指标“△INR4-1”,通过该观测指标对所得数据的统计和分析,得到在各基因组基础INR均值均<1.2的 前 提 下,CYP2C9(rs1057910)、VKORC1(rs9923231)和EPHX1(rs2292566)均与初始抗凝疗效显著相关。文献报道CYP2C9和初始抗凝治疗中发生的抗凝过度事件有关[9-10]。本研究中虽然INR>3的患者有18例,INR>4的患者有4例,但结果显示CYP2C9(rs1057910)并不与初始抗凝期内发生抗凝过度的事件显著相关。这可能与我们仅研究初始3 d的抗凝疗效,观察期较短有关。另外,本研究群体首日剂量在2.5~3.75 mg之间,之后根据INR的检测结果调整剂量。结果显示该华法林初始给药方式能使得大部分CYP2C9(rs1057910)AC/CC型患者在3日内INR进入有效治疗范围,而对于CYP2C9(rs1057910)AA型患者尚无法使得患者INR在3 d内进入有效治疗范围内。由于CYP2C9(rs1057910)在中国汉族人群的等位基因突变频率为4%[4~5,10],在本研究中为4.54%,所占比例很低。因此本研究群体中的大部分患者在目前的给药方式下无法尽快进入有效治疗范围内。
在维持剂量的研究中,研究对象均服用3个月以上的华法林,期间多次根据INR检测结果对剂量进行调整后,得到了个性化的维持剂量。研究发现CYP2C9和VKORC1的基因型对于维持剂量均存在显著影响,CYP2C9(rs1057910)AC/CC型患者维持剂量更低,而VKORC1(rs9923231)GA型患者维持剂量更高,这与之前许多国内外学者的研究结果[7,12-13]相一致。GU 等[7]在以中国汉族人群为对象,对华法林维持剂量的研究中发现EPHX1(rs4653436)携带“G”等位基因的患者需要更低的华法林维持剂量[GG、AG:(1.8±0.6)mg/d,AA:(2.2±1.1)mg/d,P<0.05],但该结果并没有在研究中得以体现。CEN等[6]对CYP4F2 rs2108622在中国人群的分布以及对于华法林维持剂量的影响进行了研究,结果显示CC型患者其维持剂量为(2.9±1.1)mg/d,明显低于CT型和 TT 型患者[(3.2±1.1)mg/d,P<0.05]。此结论在本研究中并没有重现。HUANG等[8]同样针对中国汉族人群研究GGCX 3261对华法林维持剂量的贡献,发现GGCX3261 GG型和AA型2组间维持剂量存在明显差异(P<0.05)。而在研究中虽然GG型所需剂量要比AA型低0.27 mg/d,但是统计结果显示该差异并不显著(P>0.05)。本研究还通过排除基因影响因素,验证了盐酸胺碘酮与华法林共同使用时对华法林维持剂量有明显影响,即同时服用胺碘酮的患者所需的华法林维持剂量更低。
本研究验证了CYP2C9和VKORC1对华法林初始抗凝疗效和维持剂量均有明显的影响。众多研究均认为,如果针对服用华法林药物的患者,根据其个人的个性化信息包括年龄、体重、合并用药等,同时在服用华法林前进行 CYP2C9(rs1057910)、VKORC1等相关基因的SNPs检测,可使患者能够更为安全有效的进行抗凝治疗。国外许多研究学者和部分国内学者已经通过逐步多重线性回归的方式对患者所需的华法林维持剂量进行公式化,大部分维持剂量公式约可以解释40%~60%的个体间剂量差异[14]。部分学者还通过前瞻性研究的方式通过基于华法林药物基因学的给药方式对初始用药患者的抗凝疗效进行研究,得到了较好的结果[3,15~16]。因此我们将以本研究的结果作为基础,建立华法林药物基因学相关的剂量方程,并进一步在更大样本的人群中进行验证。
[1]WADELIUS M.Point:use of pharmacogenetics in guiding treatment with warfarin [J].Clin Chem,2009,55(4):709-711.
[2]WADELIUS M,CHEN LY,ERIKSSON N,etal.Association of warfarin dose with genes involved in its action and metabolism [J].Hum Genet,2007,121(1):23-34.
[3]GONG IY,TIRONA RG,SCHWARZ UI,etal.Prospective evaluation of a pharmacogenetics-guided warfarin loading and maintenance dose regimen for initiation of therapy[J].Blood,2011,118(11):3163-3171.
[4]刘媛,钟诗龙,谭虹虹,等.CYP2C9与VKORC1基因变异对华法林初始抗凝治疗反应性的影响[J].中华心血管病杂志,2011,39(10):929-935.
[5]娄莹,刘红,韩璐璐,等.CYP2C9和VKORC1基因多态性对肺栓塞患者华法林初始抗凝疗效的影响[J].中国临床药理学杂志,2012,28(4):256-259.
[6]CEN HJ,ZENF WT,LENG XY,etal.CYP4F2 rs2108622:a minor significant genetic factor of warfarin dose in Han Chinese patients with mechanical heart valve replacement[J].Br J Clin Pharmacol,2010,70(2):234-240.
[7]GU Q,KONG Y,SCHNEEDE J,etal.VKORC1-1639G>A,CYP2C9,EPHX1691A>G genotype,body weight,and age are important predictors for warfarin maintenance doses in patients with mechanical heart valve prostheses in southwest China[J].Eur J Clin Pharmacol,2010,66(12):1217-1227.
[8]HUANG SW,XIANG DK,HUANG L, etal.Influence of GGCX genotype on warfarin dose requirements in Chinese patients[J].Thromb Res,2011,127(2):131-134.
[9]KEALEY C,CHEN Z,CHRISTIE J,etal.Warfarin and cytochrome P450 2C9 genotype:possible ethnic variation in warfarin sensitivity [J].Pharmacogenomics,2007,8(3):217-225.
[10]HIGASHI MK,VEENSTRA DL,KONDO LM,etal.Association between CYP2C9 genetic variants and anticoagulation-related outcomes during warfarin therapy[J].JAMA,2002,287(13):1690-1698.
[11]MIAO L,YANG J,HUANG C,etal.Contribution of age, body weight, and CYP2C9 and VKORC1 genotype to the anticoagulant response to warfarin:proposal for a new dosing regimen in Chinese patients[J].Eur J Clin Pharmacol,2007,63(12):1135-1141.
[12]SCONCE EA,KHAN TI,WYNNE HA,etal.The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements:proposal for a new dosing regimen[J].Blood,2005,106(7):2329-2333.
[13]吴小盈,章伟平,陈慧,等.VKORC1-1639 G/A基因多态性与华法林应用剂量关系的研究[J].中华临床医师杂志(电子版),2008,2(3):271-275.
[14]ZHU Y,SHENNAN M,REYNOLDS KK,etal.Estimation of warfarin maintenance dose based on VKORC1(-1639 G>A)and CYP2C9 genotypes[J].Clin Chem,2007,53(7):1199-1205.
[15]WANG M,LANG X,CUI S, etal. Clinical application of pharmacogenetic-based warfarin-dosing algorithm in patients of Han nationality after rheumatic valve replacement:a randomized and controlled trial[J].Int J Med Sci,2012,9(6):472-479.
[16]HUANG SW,CHEN HS,WANG XQ, etal.Validation of VKORC1 and CYP2C9 genotypes on interindividual warfarin maintenance dose: a prospective study in Chinese patients [J].Pharmacogenet Genomics,2009,19(3):226-234.
